Un acide aminé
Un acide aminé est une molécule essentielle d'une protéine avec un rôle important dans le métabolisme pour l'expression des gènes et la régulation du signal cellulaire. La molécule d'aminoacide comporte au moins un groupement amine primaire et un groupe carboxyle. Les acides aminés sont les protides de la matière vivante.
Structure d'un acide aminé :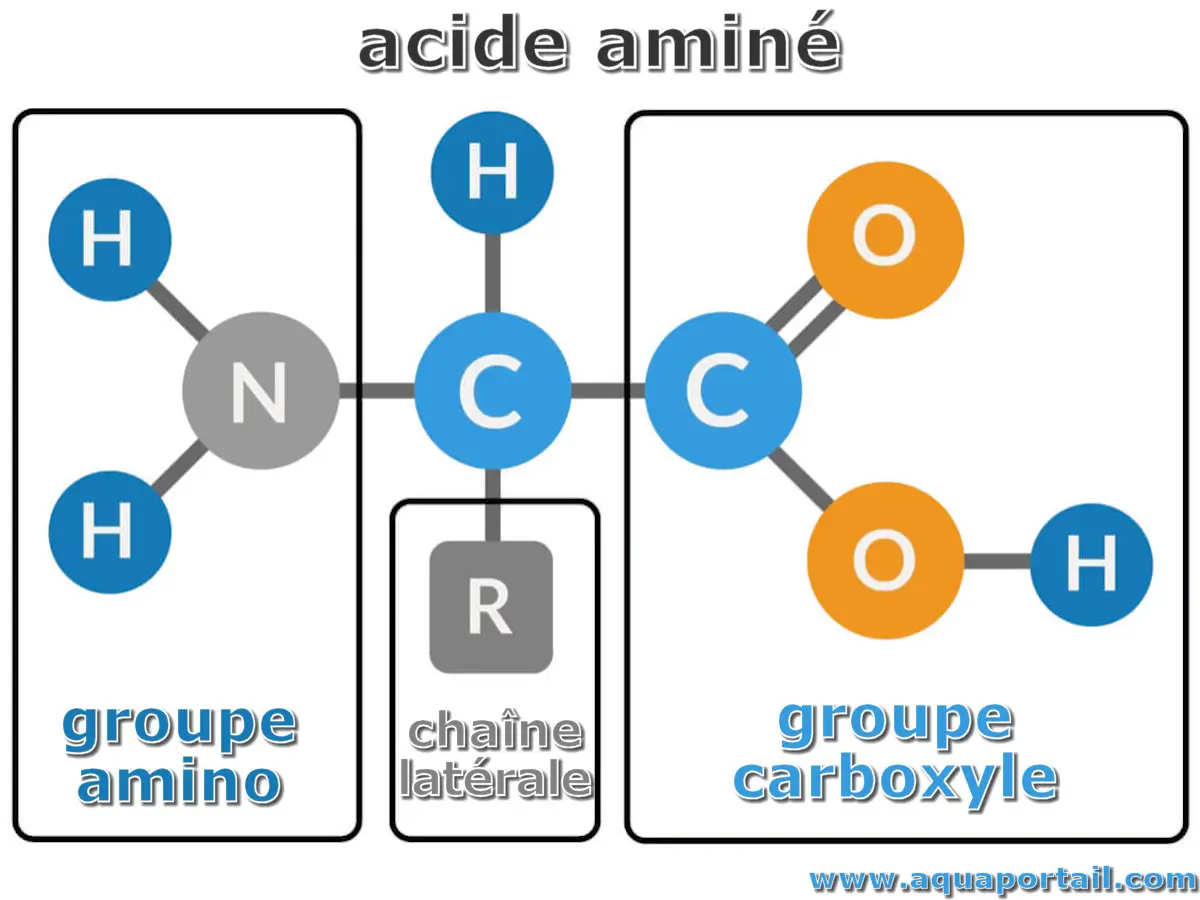
Un acide aminé est composé d'un groupe amino, d'une chaîne latérale et d'un groupe carboxyle. Un acide aminé a un radical amine (-NH2) et un radical carboxyle (COO-) sur le même carbone, en étant reliés par des liaisons peptidiques.
Généralités
Les humains ont besoin de 20 acides aminés (9 issus des aliments et 11 synthétisés dans le corps). Les 20 acides aminés sont les constituants élémentaires des chaînes protéiques, assemblées au niveau des ribosomes.
Les acides aminés les plus fréquents et les plus intéressants sont ceux qui font partie des protéines. Ils jouent un rôle clé dans presque tous les processus biologiques. Les acides aminés sont la base des protéines. Chez les vertébrés, 9 de ces 20 acides aminés ne peuvent pas être synthétisés par l'organisme et doivent être apportés par l'alimentation.
Les avantages des acides aminés sont simples à nommer car, sans acides aminés, une organisme ne peut pas exister. Chaque caractéristique anatomique et physiologique d'un organisme vivant est rendue possible grâce à l'existence d'acides aminés. La synthèse des acides aminés nutritionnellement non essentiels dans le corps humain - alanine, arginine, asparagine, acide aspartique, cystéine, acide glutamique, glutamine, glycine, proline, sérine et tyrosine - intervient par la construction de novo de leurs squelettes carbonés.
Cependant, des études récentes montrent que nous pouvons encore bénéficier de l'ingestion d'acides aminés non essentiels pour favoriser une santé et un bien-être optimaux. Ce n'est que lorsque les quantités d'acides aminés essentiels et de glucose sont suffisantes et disponibles que le taux de synthèse des acides aminés non essentiels peut augmenter. Il est donc important de consommer les deux types d'acides aminés dans l'alimentation afin de bénéficier de leurs nombreux effets positifs, sinon absolument essentiels.
La sérine est un acide aminé :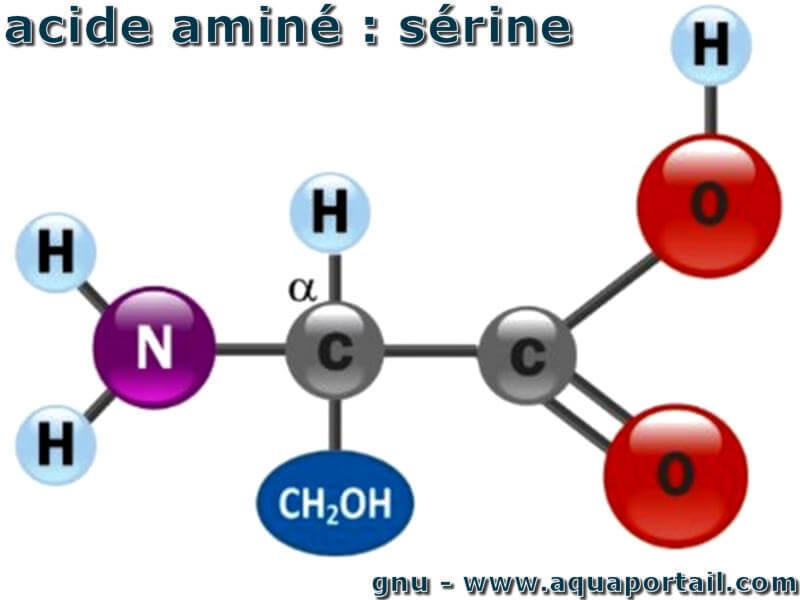
Exemple d'acide aminé avec la sérine. La sérine est l'un des vingt acides aminés essentiels, composants des protéines codées par le génome.
Biologie
Deux acides aminés sont combinés dans une réaction de condensation entre le groupe amine de l'un et le carboxyle de l'autre, libérant une molécule d'eau et formant une liaison amide appelée liaison peptidique. Ces "résidus" de deux acides aminés forment un dipeptide, si un troisième acide aminé est lié, un tripeptide est formé et ainsi de suite, jusqu'à ce qu'un polypeptide soit formé. Cette réaction existe naturellement dans les cellules, dans les ribosomes.
Tous les acides aminés constitutifs des protéines sont des acides L–alpha-aminés. Cela signifie que le groupe amino est lié au carbone adjacent au groupe carboxyle (carbone alpha) ou, en d'autres termes, que le carboxyle et le groupe amino sont tous deux liés au même carbone.
De plus, un atome d'hydrogène et une chaîne (généralement appelée chaîne latérale ou radical R) de structure variable sont liés à ce carbone alpha, ce qui détermine l'identité et les propriétés de chacun des différents acides aminés.
Il existe des centaines de radicaux connus comme des centaines d'acides aminés différents, mais seuls 22 (les deux derniers ont été découverts en 1986 - sélénocystéine - et 2002 - pyrrolysine -) font partie des protéines et possèdent des codons spécifiques le code génétique. Ces 22 acides aminés sont capables de coder pour les protéines et c'est pourquoi ils en font partie.
L'union de plusieurs acides aminés donne lieu à des chaînes appelées peptides ou polypeptides, appelées protéines lorsque la chaîne polypeptidique dépasse une certaine longueur (entre 50 et 100 résidus d'acide aminé, selon les auteurs) ou que la masse moléculaire totale dépasse 5 000 et, en particulier, quand ils ont une structure tridimensionnelle stable définie.
Structure générale d'un acide aminé
La structure générale d'un acide alpha-aminé est établie par la présence d'un carbone central (alpha) lié à un groupe carboxyle (en rouge sur la figure), un groupe amino, un hydrogène et la chaîne latérale.
La "chaîne latérale" "R" est spécifique à chaque acide aminé. Les groupes carboxyle et amino sont des groupes fonctionnels susceptibles d'ionisation en fonction des changements de pH. C'est pourquoi aucun acide aminé en solution n'est en réalité sous la forme généralement représentée sur les figures, mais il est ionisé.
En fonction des substances agissant dans les chaînes latérales, les acides aminés se comportent de différentes manières, généralement à pH bas (acide). Ils se trouvent principalement sous leur forme cationique (chargée positivement), alors qu'à pH élevé (basique) se trouvent sous leur forme anionique (avec une charge négative).
Lorsque le pH est égal au point isoélectrique (PI), nous observons que le groupe carboxyle est déprotoné en formant l'anion carboxyle, dans le cas contraire le groupe amino est protoné en formant le cation ammonium, à cette configuration en solution aqueuse (qui est la forme la plus courante). de les trouver) est connu sous le nom de zwitterion, où il se trouve sous une forme dipolaire (neutre avec charge dipolaire + et -, avec une charge globale de 0).
La majorité des acides alpha-aminés sont des aminés primaires, 19 étant ceux qui partagent cette caractéristique, ceci car ils ne diffèrent que par la chaîne latérale. Seule la proline est une amine secondaire, car les atomes de carbone N et alpha sont contenus dans un cycle.
Classification des acides aminés
On distingue les acides aminés :
- hydrophobes à chaîne latérale non polaire;
- hydrophiles à chaîne latérale polaire neutre, basique ou acide.
Chaque acide aminé existe sous deux formes : un isomère D et un isomère L, en fonction de la disposition des liaisons du carbone et asymétrique. Ils absorbent les rayons de longueur d'onde inférieure à 230 nm.
Selon la chaîne latérale, on distingue les acides aminés :
- aliphatiques : glycine, alanine, valine, leucine, isoleucine;
- diamines : arginine, histidine, lysine;
- à fonction amide : asparagine, glutamine;
- dicarboxyliques : acide aspartique, acide glutamique;
- à fonction alcool : sérine, thréonine;
- aromatiques : phénylalanine, tryptophane, tyrosine;
- soufrés : cystéine, méthionine;
- hétérocycliques : histidine, proline, tryptophane.
Les acides aminés essentiels pour l'Homme, c'est-à-dire que l'Homme ne peut pas synthétiser, sont au nombre de huit : l'isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la thréonine, le tryptophane et la valine.
Pour rappel, une amine, ou groupe amine désigne tout composé qui possède un groupement amine formé par substitution de radicaux hydrocarbonés univalents à l'hydrogène de l'ammoniac. On distingue les :
- amine primaire : R-NH2
- amine secondaire : R-N-R-H
- amine tertiaire : R-N-R'-R"
Voir aussi hexamine, histamine, squalamine, catécholamine, amine biogène.
Acides aminés codés dans le génome
Les protéines, acides aminés canoniques ou naturels sont ceux qui sont codés dans le génome; pour la plupart des êtres vivants, il y en a 20 : alanine, arginine, asparagine, aspartate, cystéine, phénylalanine, glycine, glutamate, glutamine, histidine, isoleucine, leucine, lysine, méthionine, proline, sérine, tyrosine, thyronine, thréonine, tryptine et valine.
Il existe toutefois des exceptions : chez certains êtres vivants, le code génétique comporte de petites modifications et peut coder d'autres acides aminés. L'acide aminé numéro 21 est la sélénocystéine, qui apparaît à la fois chez les eucaryotes et les procaryotes et les archées, et le numéro 22 est la pyrrolysine qui apparaît uniquement dans les archées.
Acides aminés modifiés
Les modifications post-traductionnelles des 20 acides aminés codés génétiquement conduisent à la formation de plus de 100 dérivés d'acides aminés. Les modifications des acides aminés jouent souvent un rôle très important dans la fonctionnalité spécifique d'une protéine.
Il existe de nombreux exemples de modification post-traductionnelle d'acides aminés. La formation de ponts disulfure, essentiels à la stabilisation de la structure tertiaire des protéines, est catalysée par une disulfure isomérase.
La méthylation des lysines a lieu dans les histones. L'acide aminé 4- hydroxyproline est abondant dans le collagène, résultat de l'hydroxylation de la proline. La méthionine initiale de tous les polypeptides (codée par le codon de départ AUG) est presque toujours éliminée par protéolyse.
Certains acides aminés non protéiques ont leur propre fonction, par exemple en tant que neurotransmetteurs ou vitamines. Par exemple, la bêta-alanine ou l'acide gamma-aminobutyrique (GABA). Il existe de nombreux acides aminés non protéiques qui jouent différents rôles dans la nature et peuvent ou non provenir d'acides aminés.
Réactions d'acides aminés
Les réactions dues au groupe carboxyle sont :
- décarboxylation : L'acide aminé subit une décarboxylation alpha pour former l'amine correspondante. De cette manière, certaines amines importantes sont produites à partir des acides aminés. Par exemple : histamine, thiamine, tryptamine, cadavéreuse, entre autres;
- Formation d'amides : le groupe -COOH des acides aminés peut être combiné avec de l'ammoniac pour former l'amine correspondante. Par exemple : l'asparagine, la glutamine, entre autres.
Les réactions dues au groupe amino sont :
- transamination : le groupe alpha-amino d'un acide aminé peut être transféré dans un acide alpha-céto pour former les nouveaux acides aminés et alpha-acétoacides correspondants. Il s'agit d'une réaction importante dans l'organisme pour l'interconversion d'acides aminés et pour la synthèse d'acides aminés non essentiels.
- désamination oxydative : le groupe alpha-amino est retiré de l'acide aminé pour former le cétoacide et l'ammoniac correspondants.
- Formation de composés carbamino : du dioxyde de carbone est ajouté au groupe alpha-amino des acides aminés pour former des composés carbamino.
Avantages des acides aminés non-essentiels
Les bienfaits des acides aminés non essentiels produits par l'organisme (de novo) sont également aussi larges que ceux du groupe essentiel. Bien que ces acides aminés soient fabriqués à partir de zéro, les sources alimentaires peuvent augmenter la disponibilité et fournir ainsi un effet plus fiable et cohérent.
Voir les acides aminés essentiels pour leurs propres avantages.
Les molécules d'alanine et de glutamine sont synthétisées dans le muscle squelettique à l'aide de sources de pyruvate et libérées pour augmenter l'apport énergétique. Les deux sont importants pour un système nerveux sain et l'alanine est nécessaire à la synthèse du tryptophane.
Des niveaux plus élevés d'alanine protègent le système cardiovasculaire, tandis que de faibles niveaux de glutamine augmentent la mortalité chez les patients critiques et contribuent à une perte de masse musculaire importante. Il est également connu que la glutamine est une source d'énergie importante pour les cellules tumorales, juste derrière le glucose.
L'arginine est classée comme un acide aminé conditionnellement essentiel chez les nouveau-nés et un acide aminé non essentiel dans le reste de la population humaine. L'arginine est l'un des ingrédients les plus courants des polypeptides et des protéines et aide à assurer un système immunitaire sain grâce à une production accrue de lymphocytes T.
Il aide à libérer l'insuline et les hormones de croissance humaines, à neutraliser l'ammoniac dans le foie et à améliorer la qualité et la guérison de la peau et du tissu conjonctif. On le trouve également dans le liquide séminal.
L'asparagine joue un rôle important dans la synthèse des glycoprotéines et la santé du foie. De faibles niveaux atténuent les sensations de fatigue et signifient que cet acide aminé est souvent étiqueté comme un remontant. Pourtant, sa contribution à la signalisation et au développement du système nerveux central est tout aussi importante que sa capacité à augmenter les niveaux d'énergie.
L'acide aspartique agit dans les cycles de l'acide citrique et de l'urée et est un précurseur d'autres acides aminés. De plus, c'est également un neurotransmetteur du tronc cérébral excitateur et de la moelle épinière qui augmente les chances de succès de la dépolarisation de la membrane postsynaptique. Son partenaire inhibiteur est la glycine, un acide aminé.
Ces deux acides aminés non essentiels doivent être équilibrés pour profiter au système nerveux central. La glycine est l'acide aminé le plus simple et son action calmante améliore le sommeil et réduit les comportements de recherche de récompense. Il peut être synthétisé par dégradation du collagène et est le principal ingrédient du collagène.
La cystéine, le deuxième et dernier acide aminé soufré qui ajoute un groupe thiol (-SH) aux groupes carboxyle et amino. La cystéine est synthétisée à partir de la méthionine, l'autre acide aminé soufré mais essentiel, par transméthylation pour produire l'homocystéine, puis par trans-sulfuration pour produire la cystéine.
La cystéine est utilisée pour la synthèse des protéines, la synthèse de la coenzyme A et la production de glutathion (un antioxydant) et de sulfure d'hydrogène. C'est un précurseur du pyruvate et de la taurine.
L'acide glutamique est surtout connu pour son rôle de précurseur de l'acide gamma-aminobutyrique (GABA) où une action inhibitrice existe, bien que l'acide glutamique lui-même agit comme un neurotransmetteur excitateur dans tout le système nerveux central. Il s'agit d'un acide aminé alimentaire extrêmement courant qui peut également abaisser la tension artérielle. Le glutamate est parfois ajouté en tant que douzième acide aminé non essentiel mais est un dérivé de l'acide glutamique.
La proline peut être synthétisée à partir de la glutamine ou dérivée de la dégradation du collagène et offre une source d'énergie lorsque le corps est stressé. La production de proline ne peut intervenir avec succès qu'en présence de l'enzyme prolyl hydroxylase et des facteurs pro de l'oxygène, du fer et de la vitamine C. La proline est également cruciale pour la synthèse du collagène. En fait, le collagène nécessite la présence de dix-huit acides aminés différents en quantités variables.
La sérine est nécessaire pour le transfert des groupes méthyle dans le corps et, par conséquent, nécessaire pour la production de substances telles que la créatine, l'épinéphrine, l'ADN et l'ARN. Il a également été associé à la croissance des cellules cancéreuses du sein. Sous une autre forme - D-sérine - elle joue un rôle neuromodulateur (neuromédiateur). De plus, sans sérine, il ne serait pas possible de former de la glycine, de la cystéine, de la taurine et des phospholipides.
La tyrosine a été largement annoncée comme supplément cognitif car cet acide aminé est un précurseur des catécholamines dopamine et noradrénaline, ainsi que de la thyroxine et de la mélanine.
Cependant, ses effets sur la population générale n'ont pas été prouvés et les résultats ont tendance à intervenir dans certains et pas dans d'autres. L'action de la tyrosine doit donc dépendre de la disponibilité ou de l'absence d'autres produits chimiques. Comme pour tout acide aminé, la tyrosine est également un élément constitutif important de la synthèse des polypeptides et des protéines.
En rapport avec "acide aminé"

Un acide aminé essentiel est un acide aminé indispensable qui ne peut pas être synthétisé et fabriqué par l'organisme.

Un aminoacide, ou acide aminé, exprime les qualités d'un composé organique contenant à la fois le groupe amino (NH₂ azoté ou -NR₂ substitué) et le groupe...
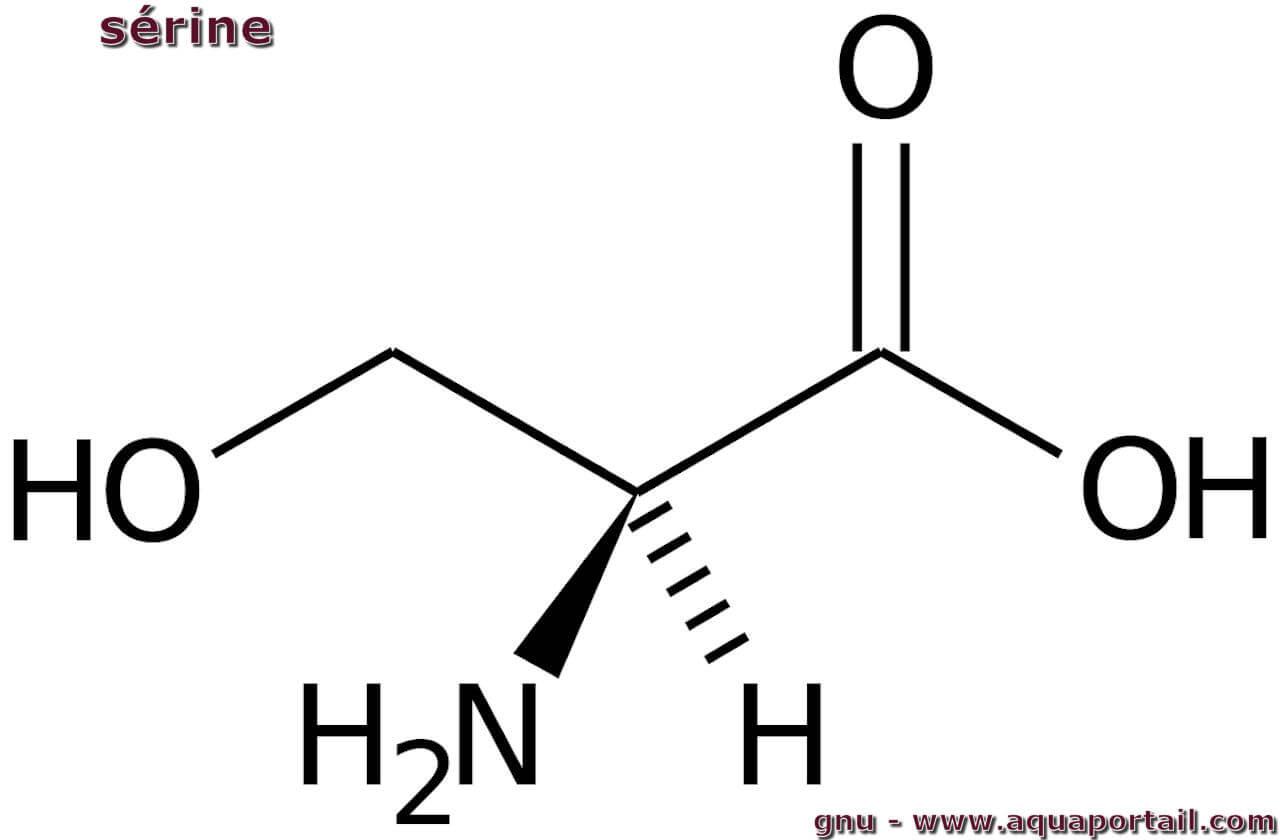
La sérine (Ser) est un acide aminé non essentiel sur le plan nutritionnel, mais elle est essentielle à la production de protéines, d'enzymes et de tissus...
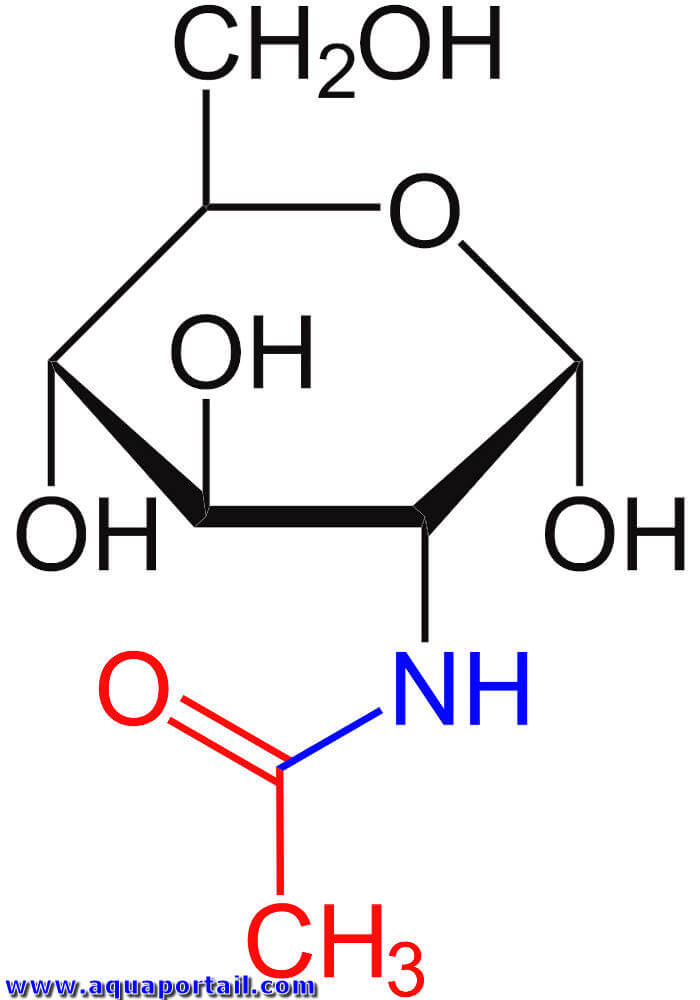
L'acétylglucosamine est un composé de sucre, d'un groupe amine et d'un groupe acétyle, proche de la cellulose.
