Protéolyse
Définition
La protéolyse est la dégradation des protéines soit par des enzymes spécifiques, appelées peptidases, soit par dégradation intracellulaire. Elle sert, par exemple, à éliminer (dégrader) les acides aminés endommagés, dans le cadre d'un catabolisme protéique.
La protéolyse est l'hydrolyse enzymatique des protéines par les peptidases, la dégradation des protéines par dissolution. L'autoprotéolyse intervient quand une peptidase se dégrade. La protéolyse peut être inhibée par les inhibiteurs de protéase. Un hydrolysat de protéines est un produit de la protéolyse.
La protéolyse de l'ubiquitine :
Schéma du processus de protéolyse de l'ubiquitine et rôle du protéasome.
Explications
La protéolyse est la décomposition des protéines en polypeptides ou acides aminés plus petits. La protéolyse est généralement catalysée par des enzymes appelées protéases, mais peut également intervenir par digestion intramoléculaire. Un pH bas ou une température élevée peuvent également provoquer une protéolyse sans enzymolyse. Chez les eucaryotes, il existe deux principaux mécanismes de dégradation des protéines, le lysosome et le protéasome 26S. Les lysosomes traitent principalement les protéines à vie longue de manière non sélective, tandis que les protéasomes dégradent les protéines anormales ou à vie courte de manière strictement régulée.
Le protéasome et le lysosome sont les deux principaux sites protéolytiques des cellules eucaryotes. Ils dégradent diverses protéines, mais la plupart de leurs substrats ont des propriétés très différentes et il n'y a pas beaucoup de chevauchement entre les deux systèmes. Il est à noter que de nombreuses études ont suggéré le rôle des protéasomes dans de nombreuses maladies pathologiques, telles que le cancer et la maladie d'Alzheimer.
Propriétés
La protéolyse peut être classée selon sa localisation :
- Protéolyse intracellulaire ou dégradation intracellulaire :
- Dégradation des protéines cellulaires dans le protéasome;
- Dégradation des protéines absorbées par la phagocytose dans le lysosome.
- Protéolyse extracellulaire :
- Dégradation des protéines de la matrice extracellulaire par des protéases sécrétées ou liées à la membrane au niveau cellulaire;
- Dégradation des protéines ingérées par les aliments dans le tractus gastro-intestinal via des protéases synthétisées dans l'estomac, le duodénum ou le pancréas (par exemple pepsine, carboxypeptidases, aminopeptidases, trypsine, chymotrypsine, élastase, collagénase).
Les peptidases peuvent également être subdivisées en fonction de leur mécanisme de dégradation. Les exopeptidases dégradent les protéines de l'extrémité N ou C de la séquence d'acides aminés, tandis que les endopeptidases clivent une protéine à une séquence de reconnaissance particulière. Les endopeptidases sont en outre classées en fonction de leur centre actif.
Fonctions biologiques
Une protéolyse limitée du polypeptide intervient dans de nombreuses protéines pendant ou après la traduction dans la synthèse des protéines. Cela peut impliquer l'élimination de la méthionine N-terminale, des peptides de signalisation et/ou la conversion de protéines inactives ou non fonctionnelles en protéines actives. Les précurseurs de la forme fonctionnelle finale de la protéine sont appelés proprotéines.
La protéolyse détermine en grande partie la demi-vie biologique des protéines. Les peptides libérés pendant la protéolyse peuvent être réutilisés pour la biosynthèse des protéines ou utilisés pour générer de l'énergie au cours de la dégradation biochimique après avoir été décomposés en acides aminés individuels.
L'organisme utilise également la protéolyse pour libérer des peptides et des protéines de proprotéines comme pour l'activation de zymogènes tels que l'ADH et la neurophysine ou pour la modification post-traductionnelle.
En cas de tumeur (cancéreuse), la cachexine, l'interféron et l'interleukine peuvent se combiner au facteur inducteur de protéolyse secrété par une tumeur et induire la destruction de tissus.
Dégradation protéique
La dégradation protéique (des protéines) peut exister dans les cellules ou à l'extérieur de la cellule. Dans les aliments digestifs, les enzymes digestives peuvent être libérées dans l'environnement pour la digestion extracellulaire, grâce à laquelle le clivage protéolytique décompose les protéines en peptides et acides aminés plus petits qui peuvent être absorbés et utilisés par les organismes. Les protéines des cellules sont également constamment décomposées en acides aminés.
La dégradation intracellulaire de cette protéine a de nombreuses fonctions; il peut éliminer les protéines endommagées et anormales et empêcher leur accumulation, et il peut également réguler les processus cellulaires en éliminant les enzymes inutiles et en régulant les protéines. Les acides aminés peuvent ensuite être réutilisés pour la synthèse des protéines.
Régulation cellulaire
La protéolyse implique également la régulation de nombreux processus cellulaires en activant ou en désactivant des enzymes, des facteurs de transcription et des récepteurs, tels que la biosynthèse du cholestérol, ou la signalisation de la thrombine médiée par les récepteurs activés par les protéases. Certaines enzymes à des points de contrôle métaboliques importants sont complètement régulées par leur taux de synthèse et de dégradation.
D'autres protéines à dégradation rapide comprennent des produits protéiques de proto-oncogènes, qui jouent un rôle important dans la régulation de la croissance cellulaire.
Remplacement des protéines
La digestion cellulaire fait référence à la dégradation intracellulaire des protéines, afin de recycler ou de dégrader leurs acides aminés. Cette protéolyse peut exister dans le lysosome (organite cellulaire spécialisé dans la dégradation des molécules) ou dans le cytoplasme.
Selon le site, il y a :
- Protéolyse lysosomale : l'intérieur de ces organites est à un pH de 5,5, et il contient des protéases et des hydrolases, principalement de la famille des cathepsines, responsables de la digestion des protéines. Ladite digestion peut être :
- Autophagienne, si elle traite des protéines intracellulaires telles que les protéines membranaires, les récepteurs hormonaux ou ribosomiques.
- Hétorophagienne, si elle agit sur les protéines extracellulaires capturées par l'endocytose, telles que celles des lipoprotéines, en particulier les HDL.
- Protéolyse cytoplasmique : cette dégradation des protéines s'effectue bien à partir de protéases dépendantes de Ca2+ (comme la calpaïne) qui ont une activité protéolytique à un pH neutre, ou à travers une structure spécialisée appelée protéosome. Le protéosome est un complexe multienzyme avec diverses activités catalytiques; Il a une structure en forme de tonneau dans laquelle seules les protéines qui ont été précédemment marquées par l'union de petites molécules d'ubiquitine entrent et digèrent.
Réactions de protéolyse
La protéolyse est une réaction d'hydrolyse des liaisons peptidiques dans laquelle les protéines se décomposent en peptides plus petits et/ou en résidus d'acides aminés individuels. Les réactions de clivage protéolytique sont généralement catalysées par des produits chimiques ou des enzymes.
Les réactions de protéolyse ou clivages protéolytiques en l'absence de catalyseurs sont très lentes et peuvent mettre plusieurs années à cliver certaines liaisons peptidiques. Les réactions chimiques de protéolyse sont médiées par des produits chimiques et/ou une température plus élevée. Les produits chimiques utilisés pour hydrolyser les protéines sont soit des acides ou des bases minéraux, soit des réactifs de clivage de liaison protéique hautement spécifiques tels que le bromure de cyanogène.
Les réactions de protéolyse enzymatique sont les réactions les plus courantes et impliquent des enzymes qui sont collectivement appelées protéases. La plupart des protéases sont des endopeptidases, mais certaines exopeptidases existent également dans la nature. Il existe plusieurs catégories de protéases dont certaines peuvent être spécifiques à certaines liaisons peptidiques et sont donc également appelées peptidases.
Par exemple, les sérine protéases clivent les liaisons peptidiques dans lesquelles le résidu Ser agit comme un résidu d'acide aminé nucléophile au niveau du site actif des enzymes. Cependant, certaines protéases sont hautement non spécifiques et dégradent de manière aléatoire les protéines en petits peptides et acides aminés.
Par exemple, la pronase est une protéase non spécifique qui digère souvent les protéines en acides aminés. La protéolyse enzymatique joue un rôle important dans la régulation des processus physiologiques et cellulaires des organismes vivants.
La protéolyse est très importante pour la digestion car les enzymes digestives dans un environnement acide décomposent les protéines présentes dans les particules alimentaires en peptides et/ou en acides aminés essentiels à la croissance des organismes vivants. La protéolyse joue également un rôle très important dans la prévention de l'accumulation de protéines indésirables ou anormales dans les cellules.
De plus, certaines protéines peuvent nécessiter une protéolyse limitée comme étape de traitement initiale pour atteindre leur forme active. La protéolyse joue également un rôle important dans les maladies humaines telles que les maladies auto-immunes, les infections bactériennes, le cancer et les maladies virales.
Synonymes, antonymes
Voir tous les synonymes pour "protéolyse".5 synonymes (sens proche) de "protéolyse" :
- autoprotéolyse
- catabolisme protéique
- dégradation des protéines
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PROTÉOLYSE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PROTEOLYSE est dans la page 9 des mots en P du lexique du dictionnaire.
Mots en P à proximité
protéinoplaste protéinurie protèle protéobactérie protéoglycane protéolyseprotéolytique protéome protéomique protérandrie protérandrique
En rapport avec "protéolyse"
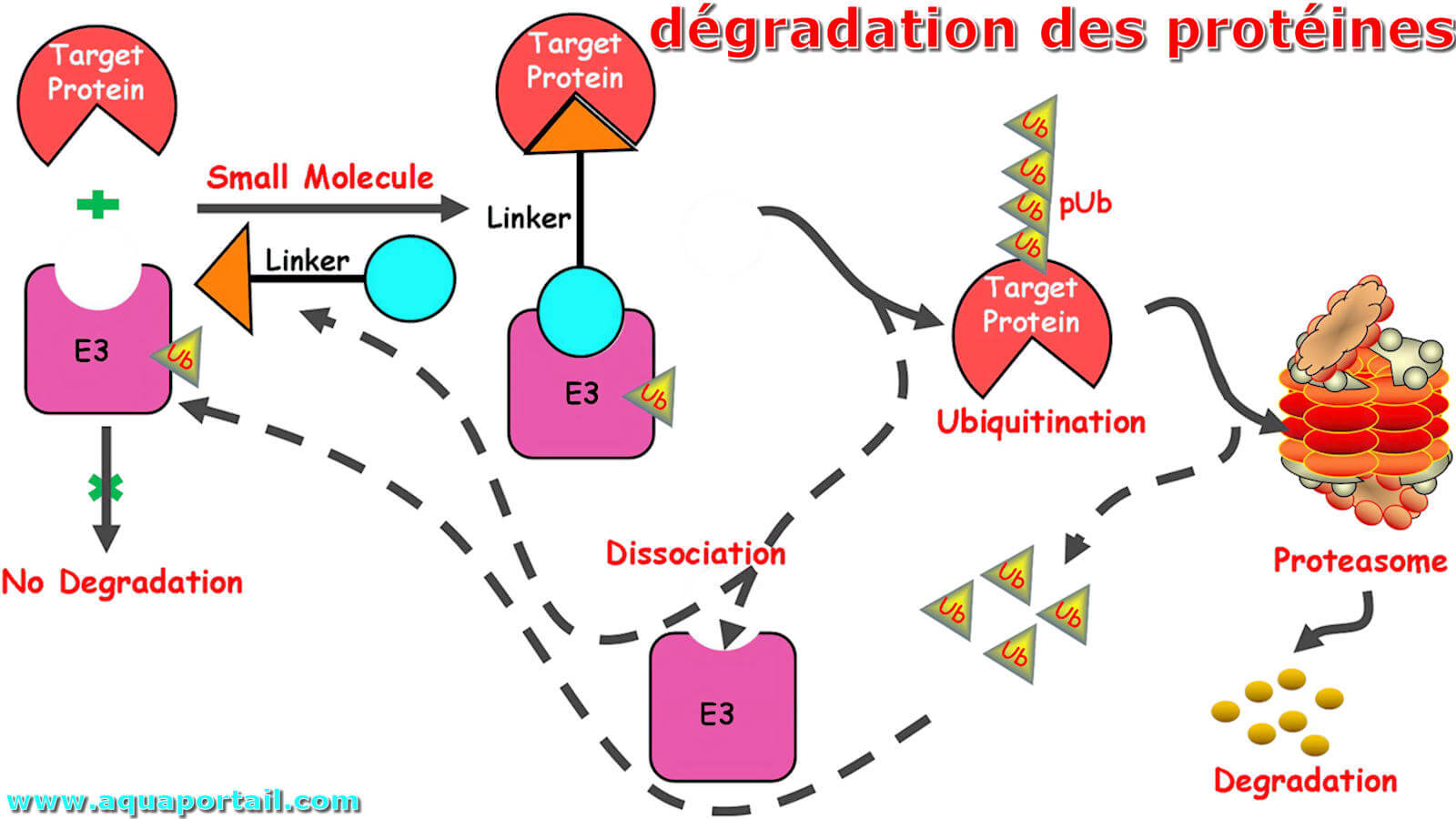
La dégradation des protéines fait partie de l'homéostasie des protéines d'une cellule. Le réseau de régulation garantit que les protéines inutiles sont...
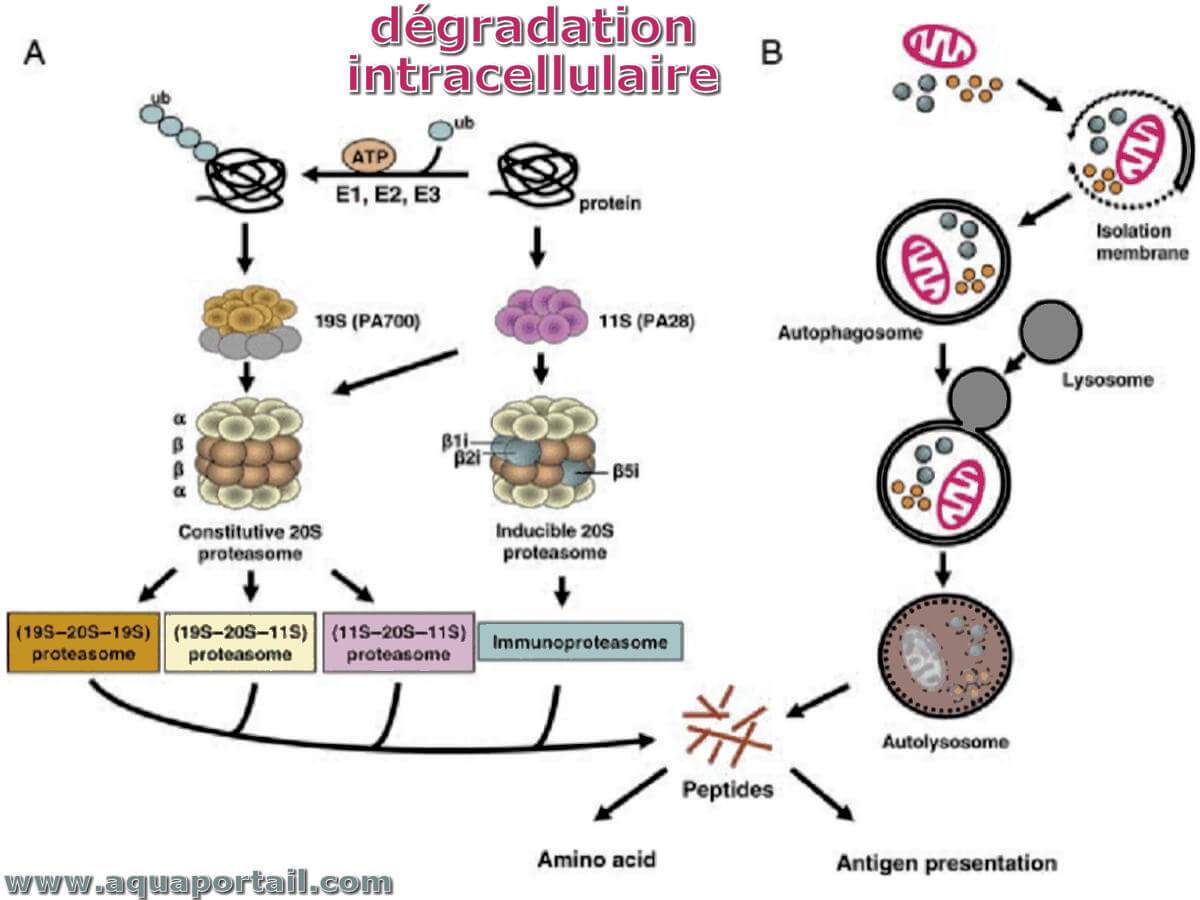
La dégradation intracellulaire est une protéolyse effectuée par un complexe multienzymatique appelé protéosome, qui agit dans le cytosol.
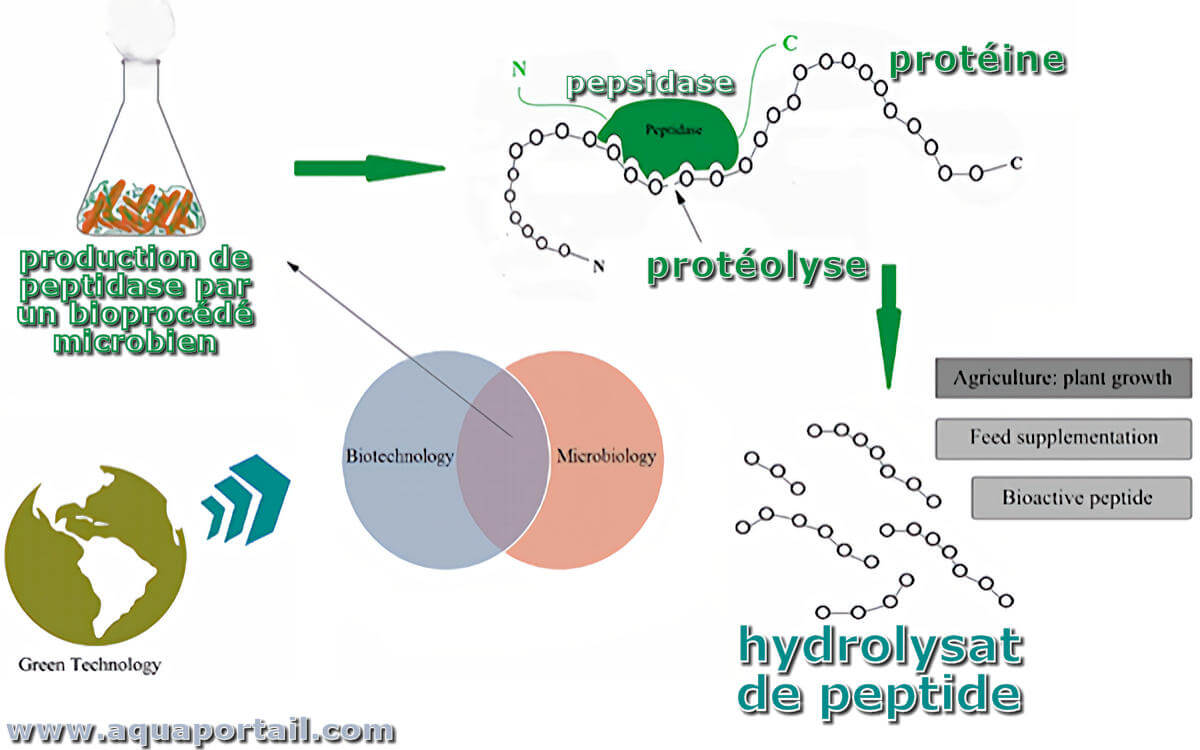
Les hydrolysats sont produits à partir de la digestion enzymatique ou de l'hydrolyse acide de micro-organismes (levures), de protéines animales (chutes...

La lutéolyse distingue et qualifie une involution du corps jaune (lutéine) d'un ovule en l'absence de fécondation.
