Ubiquitine
Définition
L'ubiquitine est une protéine de 76 acides aminés, thermostable, bien conservée au cours de l'évolution et jouant un rôle dans la dégradation des protéines. Cette protéine est très répandue chez les eucaryotes et elle se fixe à la chromatine au niveau des histones.
L'ubiquitine est liée à un complexe enzymatique qui reconnaît les protéines qui possèdent un signal de dégradation. L'ubiquitine est alors fixée sur les groupements E-amine des lysines de la protéine et cette fixation est reconnue par le protéasome.
Le système ubiquitine-protéasome :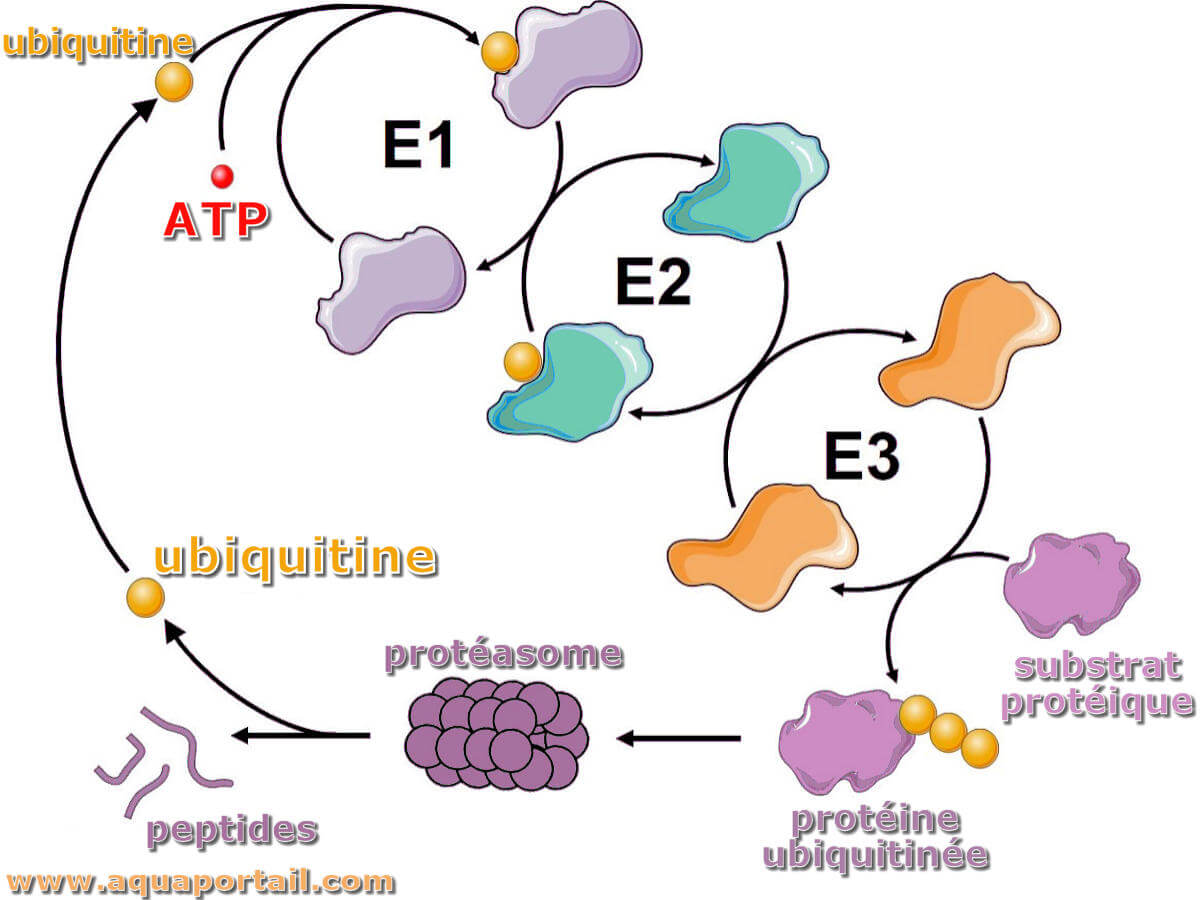
Schéma du système complexe ubiquitine et protéasome.
Explications
L'ubiquitine est une petite protéine présente dans tous les eucaryotes (la plupart des cellules eucaryotes). L'ubiquitine est composée de 76 acides aminés d'un poids moléculaire d'environ 8 500. Sa fonction principale est de marquer les protéines qui doivent être décomposées, afin qu'elles soient dégradées par le protéasome 26S.
Certains récepteurs du protéasome 26S régulent la sous-unité pour reconnaître les protéines poly-ubiquitinées liées à K48 et K11, et la sous-unité centrale 20S hydrolyse le substrat sous l'énergie de l'ATPase.
L'ubiquitine peut également marquer les protéines transmembranaires et participer au transport des vésicules protéiques. Les chaînes d'ubiquitine atypiques jouent un rôle important dans la signalisation cellulaire, l'endocytose, la réparation des dommages à l'ADN et la régulation de la voie NF-kB. Elle est hautement conservée chez les eucaryotes et la similitude entre l'ubiquitine humaine et celle de levure est de 96 %.
Système ubiquitine-protéasome
Le système ubiquitine-protéasome (SUP) est une voie hautement complexe, temporellement contrôlée et conservée qui joue un rôle majeur dans une myriade de fonctions cellulaires. De la différenciation cellulaire à la mort cellulaire, le système ubiquitine un rôle important dans la détermination du devenir des cellules et des protéines. Il est important de comprendre le système ubiquitine, car des divergences au sein de la voie indiquent généralement la pathogenèse de nombreuses maladies.
Pour comprendre le système ubiquitine-protéasome, ne commençons pas par le début, mais par la fin. Le but du système ubiquitine-protéasome est de conjuguer une molécule d'ubiquitine à une protéine destinée à la dégradation. Pourquoi est-ce si important ? Les voies ubiquitine-protéasome inadaptées et les protéines qui ne sont pas suffisamment dégradées (en particulier celles qui sont mutées, mal repliées ou surexprimées) sont les étiologies de base de la fonction cellulaire préjudiciable. La voie ubiquitine-protéasome est un processus en trois étapes qui se termine par la conjugaison de l'ubiquitine à une protéine. L'ubiquitine marque une protéine soit en tant que molécule unique via mono-ubiquitination, soit en tant que chaîne oligomérisée (oligomère) via poly-ubiquitination. L'ubiquitine a plusieurs lysines différentes, ou points de liaison, où elle peut se marquer à une protéine pour indiquer la dégradation : M1, K6, K11, 27, K33, K48, K63. L'endroit où la molécule d'ubiquitine adhère spécifiquement déterminera comment cette protéine est dégradée. Cela peut être protéasomal ou lysosomal.
Comment la ou les molécules d'ubiquitine adhèrent-elles à la protéine destinée ? C'est là que le processus en trois étapes dépendant de l'ATP et sa compréhension deviennent partie intégrante. Cette voie en trois étapes a un autre nom qui explique les jalons de chaque étape, la voie E1-E2-E3.
Étapes E1, E2, E3
L'étape d'initiation, E1, est connue sous le nom d'étape d'activation. Une enzyme d'activation, telle que l'UBE1 (enzyme d'activation de l'ubiquitine E1), active l'ubiquitine et déclenche une cascade d'activité enzymatique/substrat. C'est le réveil du système ubiquitine-protéasome, alertant l'ubiquitine que le moment est venu de se dégrader.
L'étape intermédiaire, E2, est connue sous le nom d'étape de conjugaison. Une enzyme de conjugaison, telle que l'UBE2D2 (enzyme de conjugaison de l'ubiquitine E2 D2), saisit la molécule d'ubiquitine et crée un intermédiaire conjugué E2-Ubiquitine. C'est le passeur du système ubiquitine-protéasome, s'apprêtant à franchir le seuil pour faire passer l'ubiquitine à l'étape finale.
L'étape finale, E3, est connue sous le nom d'étape de ligase. Une ligase, telle que MurRF1 (muscle-specific RING-finger protein 1), prend la molécule d'ubiquitine de l'intermédiaire Ub-E2 et complète la voie en conjuguant l'ubiquitine au substrat cible. C'est l'ancre du système ubiquitine-protéasome, transmettant et reliant finalement l'ubiquitine à la protéine.
Il existe de nombreuses enzymes E1, E2 et E3 différentes. Des enzymes problématiques dans l'un de ces domaines peuvent entraîner un dysfonctionnement du système ubiquitine-protéasome. Les enzymes déficitaires peuvent être une cause de facteurs épigénétiques ou environnementaux. L'étude de chaque partie de la voie et de ses enzymes individuelles est une tâche active de nombreux laboratoires et industries axés sur la thérapie.
Synonymes, antonymes
Voir tous les synonymes pour "ubiquitine".0 synonyme (sens proche) pour "ubiquitine".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à UBIQUITINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot UBIQUITINE est dans la page 1 des mots en U du lexique du dictionnaire.
Mots en U à proximité
ubidécarénone ubiquinone ubiquiste ubiquitaireubiquitination ubiquitineUFP UICN uliginaire uligineux ultra-violet
En rapport avec "ubiquitine"
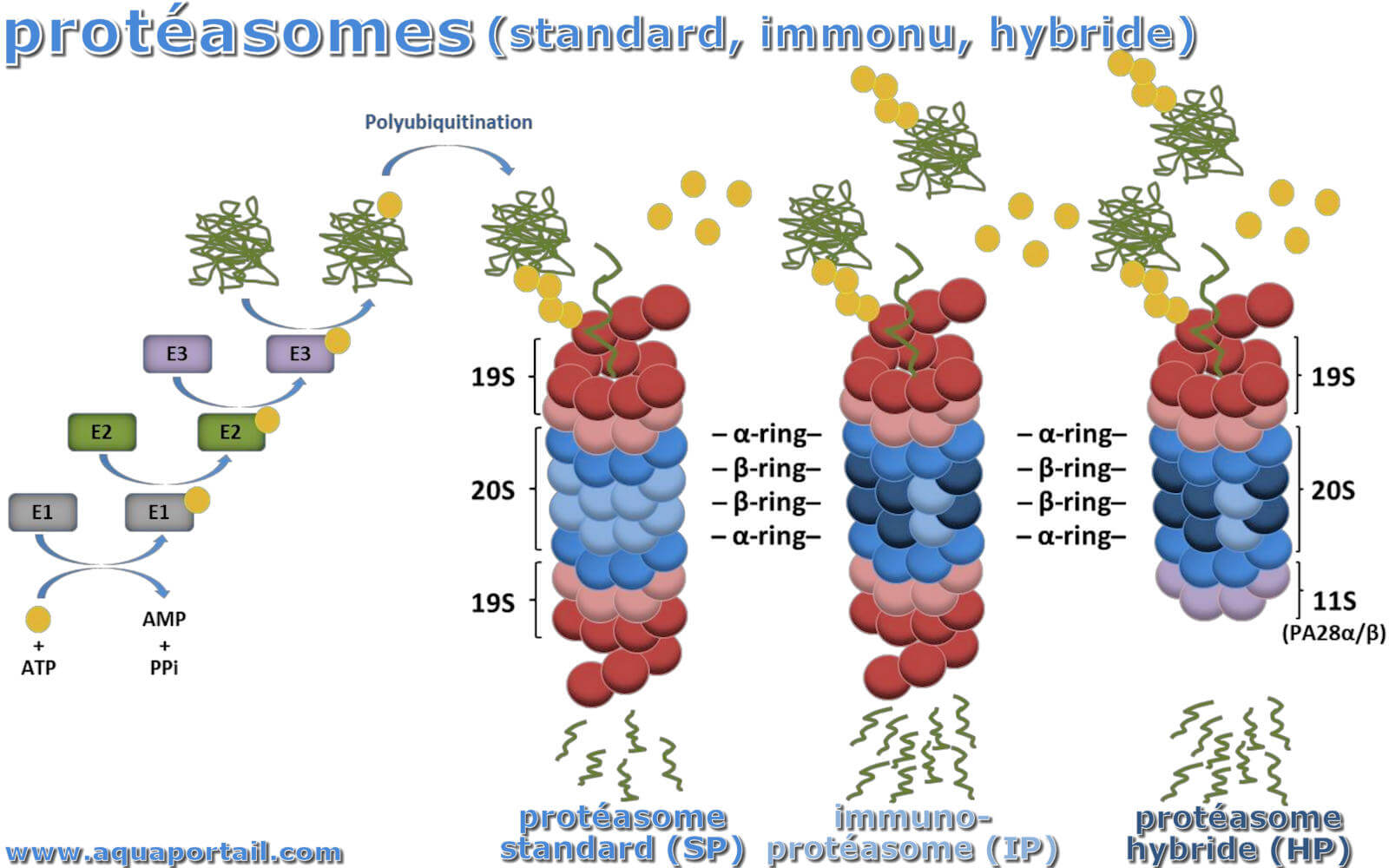
Le protéasome est un complexe de protéase hautement organisé situé dans le cytosol ainsi que dans le noyau des cellules eucaryotes.
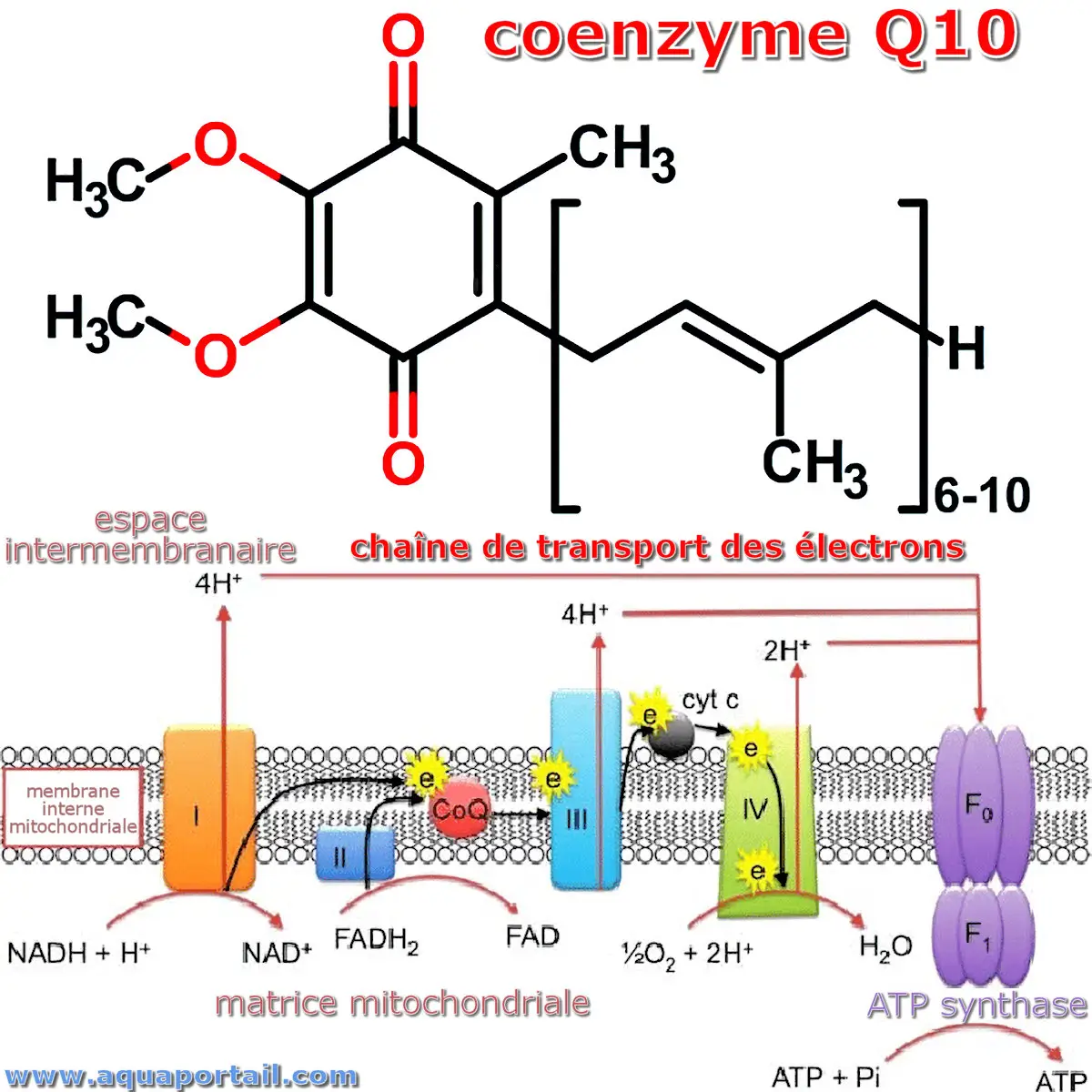
Une ubiquinone, ou coenzyme Q10, désigne une classe de transporteurs non protéiques d'une chaîne de transport des électrons.

Une personne ubiquitaire ou un être ubiquiste paraît exister dans plusieurs lieux à la fois, ou qui se trouve bien partout, qui est partout à la fois.
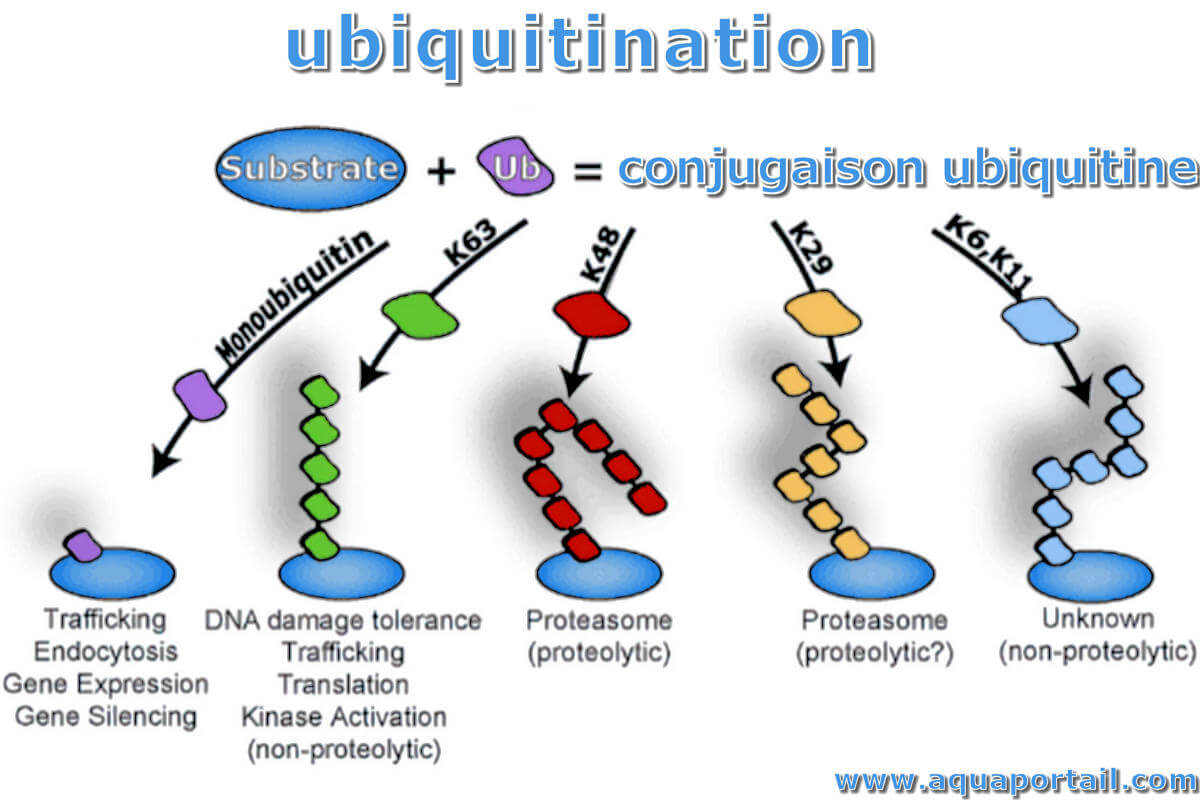
L'ubiquitination fait référence au processus dans lequel les molécules d'ubiquitine (une sorte de protéine de faible poids moléculaire) classent les protéines...
