Une protéine
Une protéine est un polymère complexe naturel composé d'acides aminés unis par des liaisons peptidiques. Cette grosse molécule est formée à partir du code génétique (ADN) de chaque individu.
Une protéine est un composé organique contenant essentiellement du carbone, de l'hydrogène, de l'oxygène et de l'azote.
La molécule de la protéine de la bactérie Nitrosomonas europaea :
Les protéines sont des biomolécules dont la structure est formée de chaînes linéaires d'acides aminés indispensables à la vie. La protéine "Rh50" de la bactérie Nitrosomonas europaea est composée de 3 unités identiques mais avec une position relative de la membrane cellulaire.
Généralités
Une protéine est un nutriment, une grosse molécule organique composée d'une chaîne de plus de 100 acides aminés qui contiennent du carbone, de l'hydrogène, de l'oxygène et de l'azote, et parfois du soufre; certaines protéines ont une structure hélicoïde, tandis que d'autres sont des feuillets bêta. La biochimie est une science qui étudie les protéines.
Chaque protéine est un polymère composé d'acides aminés de haut poids moléculaire. Voir aussi la liaison aux protéines. Les protéines sont étudiées en biochimie.
Pour une diète alimentaire avec beaucoup de protéines, voir le régime hyperprotéiné.
Les protéines issues d'un ancêtre commun sont dites homologues et constituent une "famille" avec des structures, des fonctions et des interactions potentiellement similaires. Le problème de l'identification de "vraies" familles de protéines sur la base de la conservation des séquences d'acides aminés est encore douteux car les algorithmes qui recherchent des homologies par paires peuvent manquer des relations importantes et produire de faux résultats.
Le problème de la reconstruction des relations évolutives entre les protéines et de leur classification en familles d'un point de vue topologique sont abordés par la protéomique et les autres disciplines de l'interactomique.
La disponibilité d'un grand nombre de génomes séquencés permet désormais de cartographier l'ensemble complet des relations de similarité des protéines dans un réseau d'homologie des protéines, et les familles de protéines apparaissent naturellement comme des régions denses et hautement connectées du réseau d'interactions protéiques.
Propriétés et rôles
Par leurs propriétés physico-chimiques, les protéines peuvent être classées en : protéines simples, les holoprotéines, formées uniquement par les acides aminés ou leurs dérivés; protéines conjuguées, les hétéroprotéines, formées par les acides aminés accompagnés de diverses substances; protéines dérivées, des substances formées par la dénaturation et le déroulement de ce qui précède. Il est encore distingué les protéines brutes.
Des aliments sources de protéines :
Les protéines se trouvent dans de nombreux aliments. Les sources protéiniques sont extrêmement variées.
Les protéines, notamment chaque protéine complète, sont nécessaires à la vie, en particulier pour sa fonction plastique, car elles constituent 80 % du protoplasme déshydraté d'une cellule entière, mais aussi pour ses fonctions de biorégulateur (une partie des enzymes) et de la défense immunitaire car les anticorps sont des protéines.
Une grande partie des protéines modernes avait déjà développé des structures de repliement protéique lorsque les premières lignées diversifiées sont nées de l'ancêtre commun universel (LUCA) de la vie cellulaire.
Les protéines jouent un rôle vital dans la vie et elles forment les biomolécules les plus polyvalentes et diversifiées. Elles sont essentielles pour la croissance du corps, d'un organisme.
Les protéines effectuent un nombre énorme de différentes fonctions, parmi lesquelles :
- contractiles : actine et myosine, responsable en final pour le raccourcissement du muscle pendant la contraction;
- enzymatique : la quasi-totalité des enzymes sont des catalyseurs de réactions chimiques dans les organismes vivants comme la sucrase et la pepsine;
- structurelles : ceci est la fonction la plus importante d'une protéine comme le collagène, un élément de fibres à haute résistance dans les tissus de soutien;
- homéostatique : coopérer dans le maintien du pH car elles agissent comme une solution tampon;
- immunitaire : les anticorps, responsables des actions de défense naturelle contre les infections ou les agents pathogènes;
- production de enveloppes : fibrine;
- protection ou défense : thrombine, fibrinogène;
- transduction du signal : rhodopsine.
Pratiquement tous les processus biologiques dépendent de la présence ou de l'activité de ces biomolécules protéiniques. Ces quelques exemples suffisent à donner une idée de la variété et l'importance des rôles; de nombreuses hormones interviennent dans les systèmes régulateurs de l'activité cellulaire.
Tout organisme vivant (animaux, végétaux, micro-organismes) fabrique une multitude de protéines comme la protéine de lait (caséine), les protéines présentent dans les cheveux (kératine et mélanine), la protéine allergène de chat (fel d 1), la protéine allergène d'acariens (der p 1)... Chacune d'entre-elle a un rôle bien spécifique dans l'organisme : pour le cas des cheveux, la kératine joue un rôle protecteur et la mélanine est responsable de la coloration.
Les protéines, constituées d'acides aminés, déterminent génétiquement tous les êtres vivants (sauf pour certains peptides antimicrobiens de synthèse non-ribosomique), à savoir que l'information génétique détermine en grande partie les protéines d'une cellule d'un tissu d'un organisme.
Les protéines sont synthétisées selon la séquence de codage des gènes. Par conséquent, elles sont sensibles à des facteurs ou des signaux externes. L'ensemble des protéines exprimées dans une circonstance donnée est appelée protéome.
Classification
Sur la base de la nature chimique, de la structure, de la forme et de la solubilité, la classification des protéines est :
- protéines simples : elles sont composées uniquement de résidus d'acides aminés. Lors de l'hydrolyse, ces protéines ne donnent que des acides aminés constitutifs. Elles sont en outre divisées en :
- protéines conjuguées : elles sont combinées avec une fraction non protéique. Par exemple : nucléoprotéine, phosphoprotéine, lipoprotéine, métalloprotéine, etc.
- protéines dérivées : ce sont des dérivés ou des produits dégradés de protéines simples et conjuguées. Elles peuvent être :
- protéine dérivée primaire : protéines, métaprotéines, protéines coagulées;
- protéines dérivées secondaires : protéoses ou albunoses, peptones, peptides.
Informations
Les protéines peuvent être trouvées dans une grande variété d'aliments. La combinaison la plus appropriée de sources de protéines pour chaque personne dépend de la région, de l'accessibilité, du coût économique, du type d'acides aminés et de l'équilibre nutritionnel, ainsi que du goût.
Bien que certains aliments soient riches en certains acides aminés, leur valeur dans la nutrition humaine est limitée en raison de leur faible digestibilité, de leurs facteurs antinutritionnels, de leur apport calorique élevé, de leur cholestérol ou de leur densité minérale. Il faut distinguer les protéines animales des protéines végétales.
Voir aussi acide, amine, acide aminé, graine aleurique, gluten, phaséoline, zéine. L'HSP est le sigle de protéine de choc thermique.
Est dit protéinacé ce qui est relatif aux protéines, qui ressemble à une protéine.
Voir aussi une protéine animale, une protéine végétale, les acides aminés essentiels, une source de protéine, les viandes rouges, les aliments riches en protéines.
Dans le cadre de l'ADN avec recombinaison génétique et une séquence recombinante d'ADNr, voir aussi une protéine recombinante.
Les protéines sont issues d'une biosynthèse, notamment dans les eucytes et protocytes des cellules eucaryotes et procaryotes : voir la biosynthèse des protéines, très utile en bioingénierie.
La clarifixation est une opération consistant à homogénéiser des protéines graisseuses (une crème par exemple) par leur passage dans une turbine à la partie supérieure du bol, puis à la réintroduire dans le lait. C'est la base de l'écumage.
Les protéines conjuguées ou hétéroprotéines sont des molécules ayant une part protéique (apoprotéine) et une autre non protéique inférieure (groupe prothétique). Cela les différencie des protéines simples ou des holoprotéines. Toutes sont globulaires et classées selon le groupe prothétique.
Voir aussi le coefficient d'efficacité protéique.
Pour les organismes unicellulaires, voir les protéines d'organismes unicellulaires.
Consommation excessive et insuffisance
Pour compenser les variations de la consommation de protéines tout au long de la journée, ou dans les situations d'urgence où la consommation de protéines est temporairement élevée ou faible, le corps tente d'équilibrer les niveaux de protéines en utilisant une réserve à court terme. Cependant, le corps est incapable de stocker l'excès de protéine à long terme. Les protéines sont digérées en acides aminés qui pénètrent dans le sang.
Les acides aminés en excès sont convertis par le foie en molécules utiles dans un processus appelé désamination. La désamination transforme l'azote des acides aminés en ammoniac, qui à son tour est converti par le foie en urée pendant le cycle de l'urée. L'urée est ensuite excrétée par les reins.
Une consommation excessive de protéines provoque également une augmentation de l'excrétion calcique dans l'urine, ce qui serait dû au déséquilibre du pH, ce qui exacerbe le risque de formation de calculs dans le système urinaire.
Une étude épidémiologique de 2006 n'a trouvé aucune relation entre l'apport total en protéines et la pression artérielle, bien qu'il y ait eu une relation inverse entre l'apport protéique végétal et la pression artérielle.
Lorsque le corps ne reçoit pas les quantités nécessaires de protéines, l'insuffisance protéique et la malnutrition peuvent conduire à un certain nombre de maladies, y compris le retard de développement chez les enfants, kwashiorkor, pigmentation rouge des cheveux et de la peau, foie gras, diarrhée, dermatose et diminution du nombre de lymphocytes T, ce qui augmente le risque d'infections secondaires.
La malnutrition protéique est relativement courante dans le monde entier, tant chez les adultes que chez les enfants, et compte pour environ six millions de décès par an. Dans les pays développés, cette maladie survient principalement chez les personnes âgées ou dans les hôpitaux, généralement associée à d'autres maladies.
Biochimie
La plupart des protéines sont constituées de polymères linéaires formés à partir d'un maximum de 20 acides L-α-aminés. Tous les acides aminés protéinogènes ont en commun un certain nombre de caractéristiques structurelles, y compris un carbone alpha, auquel un groupe d'aminés, un groupe acide carboxylique et une chaîne latérale variable sont chimiquement liés. Seule la proline diffère de cette structure de base.
Les chaînes latérales des acides aminés communs ont une grande variété de propriétés et de structures chimiques. C'est l'effet combiné de toutes les chaînes latérales sur une protéine qui détermine sa structure tridimensionnelle et sa réactivité chimique. Les acides aminés dans une chaîne de polypeptides sont liés par des liaisons peptidiques.
Une fois lié dans la chaîne protéique, chaque acide aminé individuel est appelé "résidu" et chaque série répétitive et chaînée d'atomes de carbone, d'azote et d'oxygène est appelée "squelette".
La liaison peptidique a deux formes de résonance qui contribuent à la formation d'une double liaison et inhibent la rotation autour de son propre axe, de sorte que les atomes de carbone alpha sont approximativement coplanaires. Les deux autres angles dièdres au niveau de la liaison peptidique déterminent la forme prise par l'épine dorsale.
La fin de la protéine avec un groupe carboxylique libre est appelée C-terminale ou carboxy-terminale, tandis que la fin avec un groupe sans amine est appelée N-terminale ou amino-terminale.
Les termes "protéine", "polypeptide" et "peptide" sont légèrement ambigus et leur signification peut se chevaucher. "protéine" est généralement utilisé pour désigner la molécule biologique complète dans sa forme tertiaire stable, tandis que "peptide" est généralement réservé aux oligomères courts d'acides aminés, qui manquent souvent d'une structure tridimensionnelle stable.
Cependant, la différence entre les deux n'est pas bien définie et correspond généralement à 20–30 résidus.
Le terme "polypeptide" peut désigner n'importe quelle chaîne linéaire d'acides aminés, quelle que soit la longueur, mais où il n'y a généralement pas de forme tertiaire.
Ferroprotéine
Une ferroprotéine est une protéine contenant ou transportant du fer dans un groupe prothétique et qui catalyse une oxydo-réduction. Les ferroprotéines, associées à un radical contenant du fer, sont des transporteurs respiratoires.
Les ferroprotéines sont des enzymes importantes de transfert d'oxygène; par exemple, nicotinamide, adénine dinucléotide, déshydrogénase, cytochrome oxydase, hémoglobine et ferrédoxine.
Le fer est essentiel au développement et à la santé du cerveau où ses propriétés redox sont utilisées pour un certain nombre de processus neurologiques. Cependant, le fer est également un facteur majeur de stress oxydatif s'il n'est pas correctement contrôlé. La distribution cérébrale du fer est très compartimentée et régulée par un certain nombre de protéines et de petites biomolécules.
Les concentrations régionales de fer dans le cerveau sont hétérogènes. La distribution régionale du fer est la plus cohérente avec l'expression de l'ARNm de la ferritine. La SEC-ICP-MS révèle les masses protéiques auxquelles le fer cytosolique est associé. Plus de 50 % du fer cytosolique est associé à la ferritine.
Le fer est essentiel au développement et à la santé du cerveau où ses propriétés redox sont utilisées pour un certain nombre de processus neurologiques. Cependant, le fer est également un facteur majeur de stress oxydatif s'il n'est pas correctement contrôlé. La distribution du fer dans le cerveau est hautement compartimentée et régulée par un certain nombre de protéines et de petites biomolécules. Ici, nous examinons l'hétérogénéité des niveaux de fer régionaux dans 10 structures anatomiques de sept cerveaux humains post-mortem sans neuropathologie apparente. Putamen contenait les niveaux les plus élevés et la plus grande variabilité de cas en cas de fer par rapport aux autres régions examinées.
La répartition du fer entre le fer cytosolique et le fer lié à la membrane était généralement constante dans chaque région, avec une proportion légèrement plus élevée (55 %) dans la phase "insoluble". L'atlas du cerveau humain donne les éléments pour examiner les modèles entre les niveaux de fer et l'expression transcriptomique des protéines régulatrices du fer et en utilisant la chromatographie d'exclusion de taille quantitative-spectrométrie de masse plasma couplée par induction pour évaluer les différences régionales dans les masses moléculaires auxquelles le fer cytosolique se lie principalement. Environ 60 % étaient associés à la ferritine, ce qui équivaut à environ 25 % du fer tissulaire total essentiellement stocké. Cette étude est la première du genre dans le tissu cérébral humain, fournissant une ressource précieuse et de nouvelles connaissances pour les biologistes du fer et les neuroscientifiques.
En rapport avec "protéine"

Une apolipoprotéine est une protéine qui contient et transporte des lipides dans le sang. Elle est une hétéroprotéine amphipathique avec un groupe prosthétique...
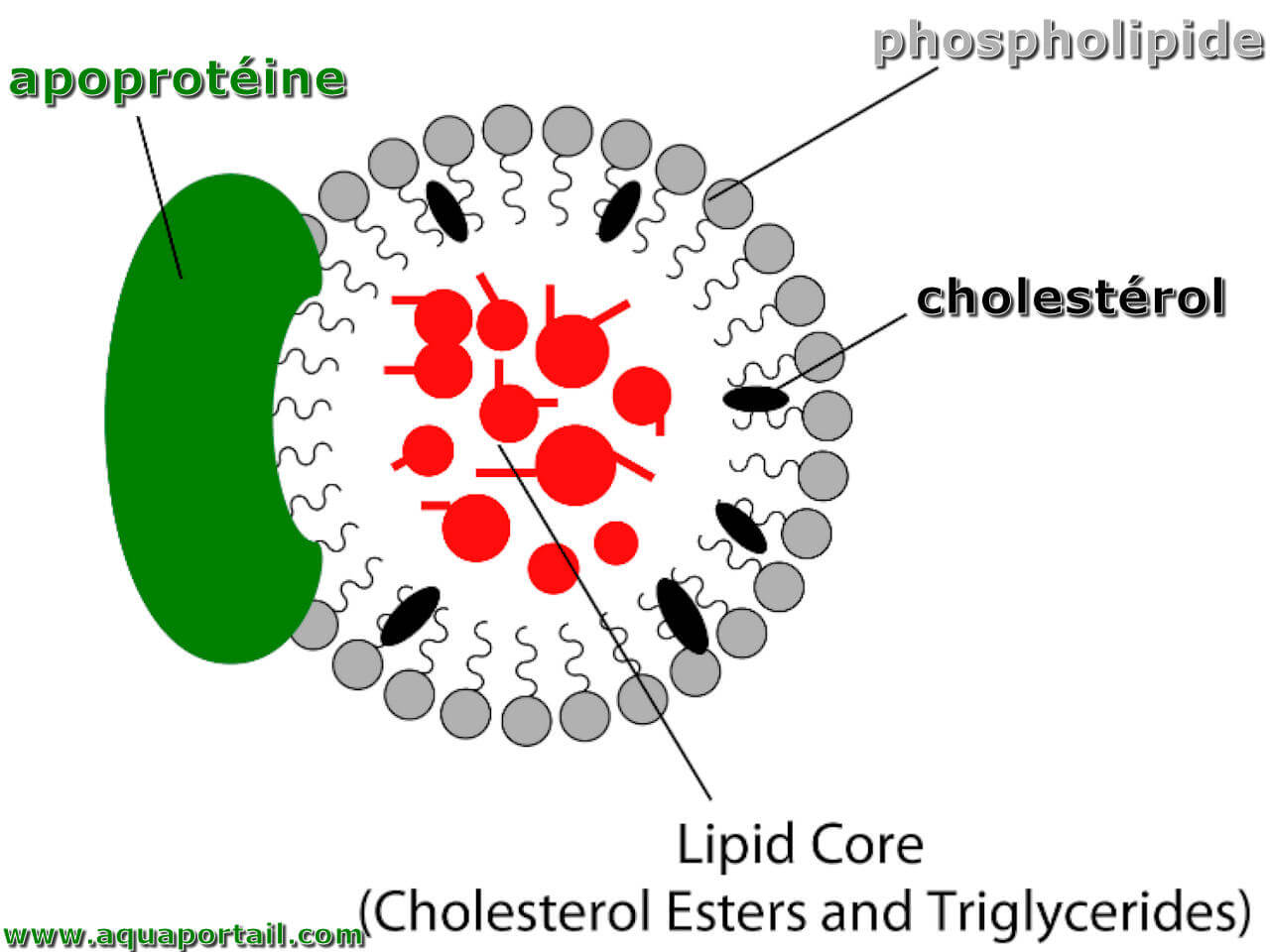
Une apoprotéine est une partie protéique d'une hétéroprotéine, associée au groupement prosthétique pour former la protéine fonctionnelle.

Une biliprotéine est une protéine dont le groupement prosthétique est une chaîne tétrapyrrolique.

La biosynthèse des protéines fait référence au processus biologique par lequel les acides aminés sont assemblés par liaison peptidique en séquences...
