Hémoglobine
Définition
L'hémoglobine est une hémoprotéine de sang avec une couleur rouge caractéristique qui transporte l'oxygène des organes respiratoires vers les tissus. Elle élimine le dioxyde de carbone des tissus aux poumons et participe également à la régulation du pH sanguin chez les vertébrés et certains invertébrés.
Structure de l'hémoglobine (une hétéroprotéine) :
L'hémoglobine est une hétéroprotéine sanguine (hémoprotéine) d'une masse moléculaire de 64 000 g/mol (64 kDa). L'hémoglobine est une protéine de structure quaternaire composée de quatre sous-unités. Cette protéine fait partie de la famille des hémoprotéines, car elle possède un groupe hème dans chaque sous-unité.
Explications
L'hémoglobine est une protéine essentielle présente dans les globules rouges du sang, jouant un rôle crucial dans le transport de l'oxygène dans l'organisme. Elle est un pigment respiratoire appartenant à la famille des métalloprotéines contenant du fer. Elle est synthétisée dans la moelle osseuse. Sa fonction principale est de transporter l'oxygène des poumons vers les tissus de l'organisme, permettant ainsi la respiration cellulaire.
L'hémoglobine (Hb) est un pigment porphyrique, caractéristique du règne animal, unique par sa possibilité de former avec la molécule d'oxygène un composé labile. La structure chimique de l'hémoglobine associe à une ferroprotoporphyrine, ou hème (qui est identique pour tous les vertébrés et de nombreux invertébrés), des protéines, les globines, qui peuvent différer d'une espèce à l'autre.
L'hémoglobine globulaire (indiquée par le symbole Hb) est une protéine globulaire dont la structure quaternaire est constituée de quatre sous-unités. Elle est soluble, de couleur rouge (c'est une chromoprotéine avec chromoplasme) et est présente dans les globules rouges des vertébrés, à l'exception de certains poissons Antarctiques.
Lorsque l'hémoglobine se lie à l'oxygène, elle est appelée oxyhémoglobine; sous la forme non liée, elle est de la désoxyhémoglobine.
La structure de l'hémoglobine :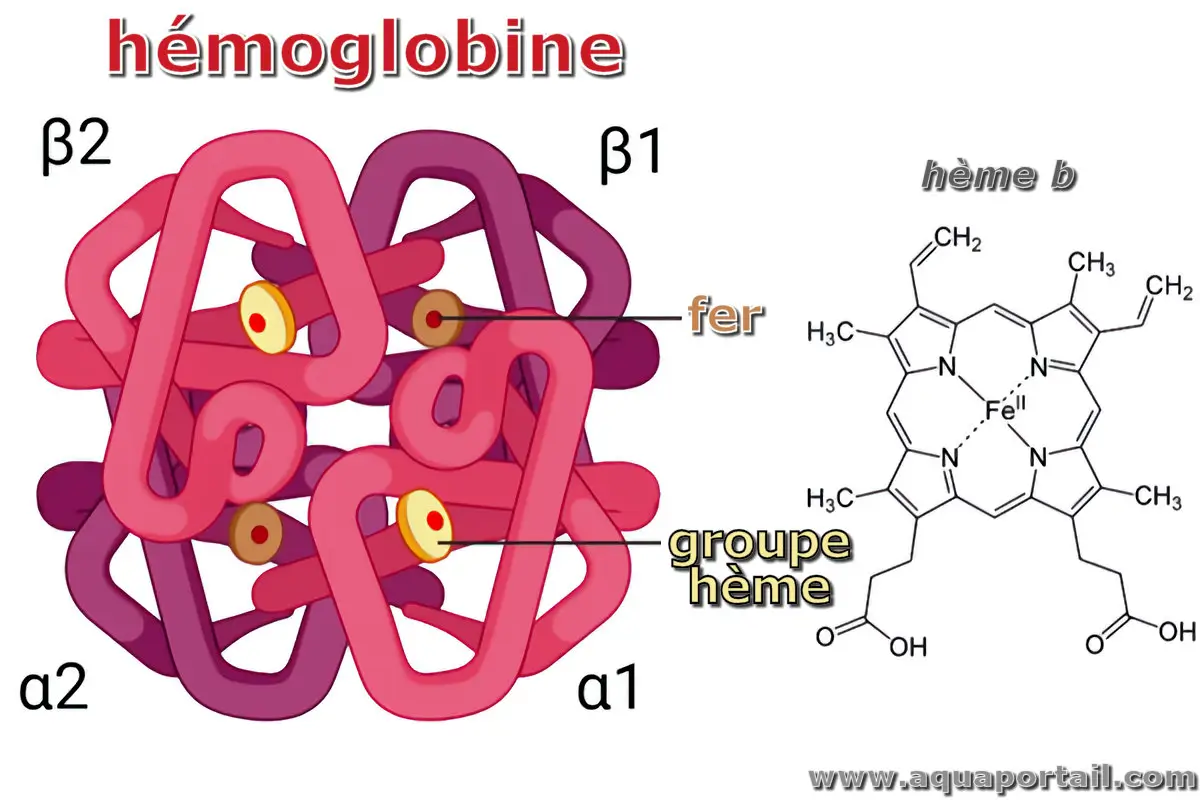
L'hémoglobine est composée de quatre molécules protéiques (chaînes de globuline) liées entre elles. Ces chaînes de globuline sont de deux types : alpha et bêta. Chez l'adulte, l'hémoglobine a une structure tétramère composée de deux chaînes alpha et de deux chaînes bêta. Chaque chaîne contient un atome de fer, qui se lie à une molécule d'oxygène.
La porphyrine contient un atome de fer, qui est normalement à l'état ferreux. Le poids moléculaire de l'hémoglobine est 64 000 à 67 200 ou un multiple de ce nombre. L'hémoglobine est de couleur violette; l'oxyhémoglobine a une couleur rouge. La carboxyhémoglobine résulte de la fixation par le pigment d'une molécule d'oxyde de carbone (CO); elle correspond à l'intoxication carbonées, qu'on tente de combattre en faisant respirer de l'oxygène pur. L'oxydation de l'ion ferreux en ion ferrique transforme l'hémoglobine en méthémoglobine, de couleur brune. On appelle enfin carbaminohémoglobione la combinaison du gaz carbonique avec l'hémoglobine.
Rôle dans le sang
L'hémoglobine est responsable du transport de l'oxygène moléculaire d'un compartiment à forte concentration d'O2 vers les tissus qui en ont besoin. Chacune de ses 4 chaînes polypeptidiques est liée de manière covalente à un groupe prothétique appelé hème; il s'agit d'une molécule de protoporphyrine qui coordonne un ion fer Fe3+, qui dépasse légèrement du plan de la molécule. L'hémoglobine est également une protéine allostérique.
L'hémoglobine est initialement synthétisée au niveau des prohyrthroblastes polychromatophiles (précurseurs des globules rouges), restant alors en forte concentration dans l'érythrocyte mature, qui aura perdu le noyau avec l'ADN. Les altérations d'origine génétique de la structure primaire de la molécule, qui altèrent sa fonction ou de son expression, qui altèrent sa quantité dans la circulation, sont appelées hémoglobinopathies (par exemple, l'anémie falciforme et la thalassémie).
Dans la respiration
L'hémoglobine (en tant que différentes molécules qui remplissent des fonctions similaires chez d'autres animaux) est une protéine indispensable car la quantité d'oxygène dissout dans l'eau est normalement trop faible pour les besoins métaboliques d'un animal de plus de 1 mm; sa présence lui permet de se libérer de la loi d'Henry et d'apporter ainsi l'oxygène nécessaire à tous les quartiers du corps à travers les globules rouges.
Les réactions d'échange gazeux sont rendues possibles par la présence d'ions fer dans chaque groupe. Ce cofacteur métallique sous sa forme Fe2+ lie l'oxygène lors du passage du sang dans les poumons et le transfère ensuite vers les tissus de la circulation périphérique. Le passage du dioxygène O2 a lieu parce que les liaisons avec l'hème sont labiles et pour d'autres facteurs détaillés dans le paragraphe suivant.
Taux d'hémoglobine normal
Pour les adultes, la valeur du taux d'hémoglobine normal devrait être comprise entre 12 et 16 g/dL chez les femmes, mais entre 13 et 17 g/dL chez les hommes. Pour les enfants, la valeur minimale de 10 g/dL peut être considérée comme normale.
Les valeurs normales d'hémoglobine varient selon le sexe et l'âge :
- hommes : 13 à 17 g/dL
- femmes : 12 à 16 g/dL
- enfants : 10 à 13 g/dL
Le taux d'hémoglobine est mesuré par une prise de sang, généralement dans le cadre d'un hémogramme ou numération formule sanguine (NFS). Cette analyse permet de détecter d'éventuelles anomalies comme l'anémie.
Si les personnes subissent une chimiothérapie, ont subi une intervention chirurgicale majeure ou une perte de sang, la valeur peut chuter considérablement et, dans ce cas, la majorité des médecins procèdent à une transfusion sanguine.
Importance biomédicale
Toutes les conditions physiologiques et cliniques associées au manque de dioxygène stimulent la production de 2,3-DPG dans les érythrocytes, ce qui entraîne une augmentation de la libération de dioxygène à partir de l'hémoglobine
L'anémie est un état clinique associé à une diminution du taux d'hémoglobine dans le sang. Cela génère un apport insuffisant de dioxygène dans les tissus. Dans l'anémie, la concentration de 2,3-DPG dans les globules rouges est élevée, ce qui augmente la libération de dioxygène.
Dans le cas d'une hypoxie, à l'état hypoxique, la concentration de 2,3-DPG dans les globules rouges est élevée en raison d'une augmentation de la glycolyse. Ceci est un exemple de l'adaptation à l'hypoxie par l'organisme.
Les personnes vivant dans les régions de haute altitude, où la concentration de dioxygène est faible, il y a une adaptation à l'altitude. le corps effectue plusieurs changements physiologiques pour s'adapter à ces conditions. Ces changements comprennent l'hyperventilation, la polycythémie et une augmentation de la production de 2,3-DPG dans les érythrocytes.
Types d'hémoglobine
À différents stades de la vie (phase embryonnaire, phase foetale et après la naissance, c'est-à-dire "phase adulte"), diverses hémoglobines sont présentes chez l'homme. Ces hémoglobines diffèrent par leur affinité pour l'oxygène. Elles se composent chacune de quatre sous-unités par paires de composition différente.
Il existe différents types d'hémoglobine :
- hémoglobine A : 95–98 % de l'hémoglobine totale chez l'adulte
- hémoglobine A2 : 2–3 %
- hémoglobine F (foetale) : 1–2 % chez l'adulte, mais majoritaire chez le foetus et le nourrisson
Historiquement, les différentes sous-unités de l'hémoglobine ont été produites par duplication de gènes du gène de la globine. Les combinaisons de ces sous-unités en tant que tétramère sont synthétisées à différents moments, en fonction du besoin en oxygène, par exemple pour obtenir de l'oxygène du sang maternel en tant que foetus dans l'utérus.
Pendant la grossesse, l'oxygène est transporté à travers le placenta jusqu'au foetus, qui l'absorbe ensuite efficacement. Ceci est garanti par le fait que les types d'hémoglobine embryonnaire et foetale ont une affinité de liaison à l'oxygène significativement plus élevée que l'hémoglobine adulte dérivée de la naissance ultérieure. En outre, l'hématocrite est grandement accru par rapport à la mère. De cette façon, suffisamment d'oxygène atteint le foetus par le cordon ombilical.
Les types sont :
- Les hémoglobines embryonnaires se forment dans la phase embryonnaire, les 8 premières semaines après la fécondation, dans les îlots sanguins du sac vitellin et portent des noms propres : Gower-1, Gower-2, Portland-1 et Portland-2.
- L'hémoglobine foetale, ou hémoglobine F (HbF), se forme principalement pendant la période foetale (à partir de la 9ème semaine après la fécondation jusqu'à la naissance). La synthèse de l'hémoglobine foetale commence dans la phase embryonnaire précédente et n'est pas arrêtée immédiatement après la naissance, mais se poursuit pendant plusieurs mois. Le lieu de formation est le foie et la rate. Il a une affinité à l'oxygène beaucoup plus élevée que l'hémoglobine adulte pour absorber l'oxygène du sang maternel. L'hémoglobine F est le type dominant chez le foetus, détectable uniquement chez les adultes en bonne santé.
- La synthèse des hémoglobines adultes, ou hémoglobine A (HbA), commence chez le foetus et remplace ensuite l'hémoglobine foetale dans les premiers mois après la naissance. Le site de production est la moelle osseuse. Chez les adultes en bonne santé, l'hémoglobine foetale n'est détectable qu'à l'état de traces. L'hémoglobine A1 représente 98 %, ne laissant que 2 % à l'hémoglobine A2.
- Les glycohémoglobines sont formées par la liaison du glucose aux groupes amines des globines. Le processus exite dans des conditions physiologiques non enzymatiques par le contact de l'hémoglobine avec le sucre dans le sang (glycation). La principale composante HbA 1 de l'hémoglobine A est convertie principalement par les intermédiaires HbA 1a et HbA 1b en HbA 1c, dont la proportion représente donc la glycémie moyenne des dernières semaines.
- La méthémoglobine (Met-Hb) est une forme d'hémoglobine désactivée et non oxygénée dans laquelle l'ion fer est au degré d'oxydation III au lieu de II. La méthémoglobine réductase (diaphorase I), une enzyme dépendante du NADH, est capable de reconvertir la méthémoglobine en hémoglobine. En règle générale, la méthémoglobine chez l'homme représente 2 % de l'hémoglobine. Une proportion plus élevée peut être soit génétique, soit due à une intoxication. Une proportion élevée de méthémoglobine entraîne un apport insuffisant d'oxygène à l'organisme.
Dégradation
Lorsque les globules rouges atteignent la fin de leur vie (environ 120 jours), ils sont dégradés dans les phagocytes mononucléés, principalement dans la rate (et dans le foie et la moelle osseuse lorsque le taux de dégradation de l'hémoglobine est élevé). Le processus de dégradation commence dans la rate et se poursuit dans le foie.
Premièrement, la portion de globine est séparée de l'hème et dégradée en acides aminés. L'hème est clivé en biliverdine via une oxygénase (hémooxygénase) dépendante du cytochrome P450, libérant du fer Fe2+ et du monoxyde de carbone.
Le fer est libéré par les macrophages dans la protéine de transport transferrine présente dans le sang. Enfin, la biliverdine réductase convertit la biliverdine verdâtre en bilirubine. Celle-ci est libérée dans le sang et couplée à l'albumine (car elle est peu soluble dans l'eau) et transportée vers le foie.
La bilirubine est doublement conjuguée à l'acide glucuronique et est ainsi rendue soluble - elle peut maintenant être libérée dans l'intestin avec la bile et excrétée par les selles. Dans l'intestin, les bactéries aident à cliver partiellement l'acide glucuronique, réduisant ainsi la bilirubine orange en urobilinogène incolore et en stéroïdes bruns. Une faible proportion de cette bilirubine réduite est reprise par l'intestin (circulation entérohépatique) et excrétée par le rein (couleur jaune de l'urine).
Diverses maladies du foie telles que l'inflammation du foie (hépatite) ou les obstructions de la vésicule biliaire (calculs biliaires) entraînent une augmentation de la concentration de bilirubine. La bilirubine est le colorant qui, lorsqu'il est stocké dans la peau, entraîne une jaunisse (jaunisse = jaunissement de la peau et du derme (sclérotique) des yeux).
Synonymes, antonymes
Voir tous les synonymes pour "hémoglobine".0 synonyme (sens proche) pour "hémoglobine".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à HÉMOGLOBINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot HEMOGLOBINE est dans la page 1 des mots en H du lexique du dictionnaire.
Mots en H à proximité
hémoculture hémocyanine hémocyte hémocytoblaste hémofiltration hémoglobinehémolymphe hémolyse hémolysine hémopexine hémoprotéine
En rapport avec "hémoglobine"

La carbohémoglobine (carbhémoglobine, carboxyhémoglobine, COHb) est une hémoglobine liée au CO₂.

La carboxyhémoglobine (COHb) est de l'hémoglobine liée à du monoxyde de carbone CO. Cette combinaison est très stable et se fait aux dépens de l'oxygène...

Une désoxyhémoglobine distingue une forme réduite de l'hémoglobine où le fer hémique n'est pas lié à l'oxygène, par opposition à l'oxyhémoglobine.

Une hémoprotéine est une métalloprotéine qui possède un groupe prosthétique hémique, lié en permanence à des liaisons covalentes et non covalentes aux chaînes...
