Allostérie
Définition
L'allostérie est le processus par lequel les macromolécules biologiques (principalement des protéines) transmettent l'effet de la liaison d'un site à un autre site fonctionnel, souvent distal, permettant la régulation de l'activité.
En biochimie, ce qui est allostérique concerne ou désigne l'altération de l'activité d'une protéine par la liaison d'une molécule effectrice à un site spécifique.
Les allostéries hétérotrope et homotrope :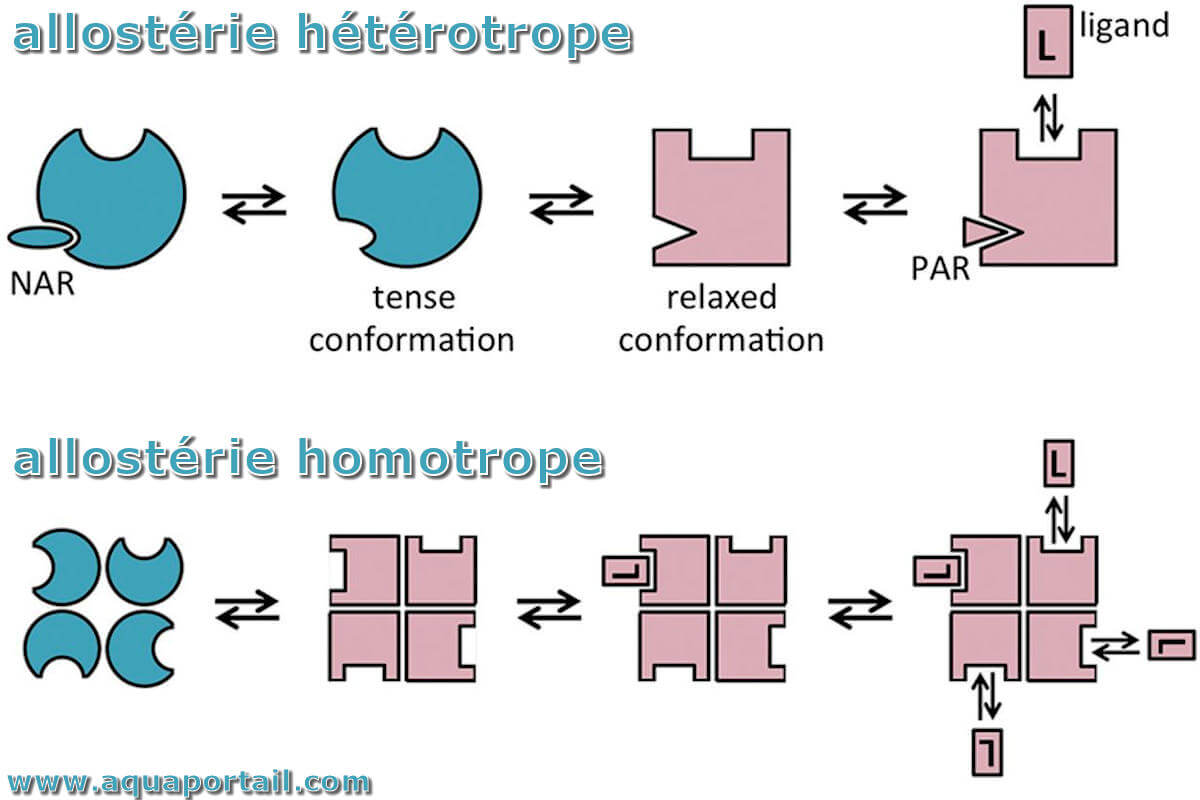
Schéma d'une allostérie hétérotrope et d'une allostérie homotrope.
Explications
Une allostérie, dans une enzyme allostérique, réside dans le phénomène d'interaction entre deux sites de liaison à deux ligands différents. La fixation d'un ligand à son site de liaison induit le changement de conformation de l'autre site de liaison donc le changement de l'affinité de l'enzyme pour l'autre ligand, même si les deux sites sont éloignés.
Ce couplage entre les sites d'une même molécule participe à la régulation du métabolisme grâce à des rétrocontrôles négatifs sur la réaction enzymatique, exercés par le produit même de cette réaction. L'allostérie est une forme de régulation de l'activité d'une enzyme ou d'une autre protéine dépendante des conditions changeantes. On peut distinguer les effets des capteurs et du feedback.
Autrement dit, l'allostérie est un mode de régulation de l'enzyme par la liaison d'une molécule à un endroit (site allostérique) modifie les conditions de liaison d'une autre molécule, à un autre endroit (site catalytique) de l'enzyme, éloigné du premier. Par exemple, la fixation de l'ATP ou du glucose sur une enzyme appelée hexokinase augmente l'affinité de l'enzyme pour l'autre ligand et favorise ainsi la phosphorylation du glucose en glucose-6-phosphate (première étape de la glycolyse).
En biochimie, la régulation d'une enzyme ou d'une autre protéine intervient en liant une molécule effectrice au site allostérique de la protéine (autre que le site actif de la protéine). Les effecteurs qui augmentent l'activité de l'enzyme sont appelés activateurs allostériques, et ceux qui diminuent cette activité sont appelés inhibiteurs allostériques.
La liaison de la molécule induit une modification de la conformation spatiale de la protéine enzymatique, de telle sorte que l'emplacement de liaison d'au moins un des réactifs impliqués dans le processus de catalyse est modifié. Dans le modèle Monod-Wyman-Changeux (MWC), les enzymes allostériques doivent avoir plusieurs propriétés :
- Elles sont multimériques, chaque monomère se lie à une molécule de ligand.
- Elles ont au moins un axe de symétrie.
- Elles existent sous deux conformations différentes : l'une appelée T (tendue), qui désigne par accord la forme ayant l'affinité la plus faible pour le substrat, et l'autre R (relâchée), avec l'affinité la plus élevée pour le substrat.
- Dans la même molécule de protéine, toutes les sous-unités adoptent la même configuration, R ou T (transition concertée). En d'autres termes, il n'y a pas d'hybride R / T dans le modèle MWC.
Allostérie hétérotrope
Dans l'allostérie hétérotrope, la liaison d'un régulateur allostérique négatif ou positif (NAR ou PAR, respectivement) réduit ou améliore la liaison du ligand principal par rapport à l'absence de tout régulateur. La séquence des événements est conforme à un cycle spontané de la protéine entre les conformations tendues et relâchées et la sélection conformationnelle par les régulateurs allostériques.
Allostérie homotrope
Dans l'allostérie homotrope, la liaison d'un ligand améliorerait la liaison d'autres ligands au même complexe multiprotéique. Dans ce scénario, le premier ligand est un régulateur allostérique positif. La séquence des événements est conforme au modèle d'allostère MWC.
Cas de l'hémoglobine
L'hémoglobine est un exemple important d'une protéine allostérique, bien qu'elle ne soit pas une enzyme, mais une molécule transporteuse. Chacune des quatre sous-unités d'hémoglobine contient un groupe prothétique appelé groupe hème, qui peut se lier à une molécule d'oxygène. La liaison de la première molécule d'oxygène augmente l'affinité de liaison pour le deuxième groupe hémique, la liaison de la seconde augmente l'affinité pour le troisième, etc. (coopération positive, effet homotrope).
Synonymes, antonymes
Voir tous les synonymes pour "allostérie".1 synonyme (sens proche) de "allostérie" :
- transmission homotrope
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ALLOSTÉRIE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ALLOSTERIE est dans la page 4 des mots en A du lexique du dictionnaire.
Mots en A à proximité
allophycocyanine allopollinisationallopolyploïde allosexualité allosexuelallostérieallostérile allotrope allotrophe allotropie allotype
En rapport avec "allostérie"

homotrope qualifie les organes orientés dans le même sens que le corps auquel ils appartiennent.

Une enzyme allostérique participe à une allostérie, c'est-à-dire avec deux sites de liaison à deux ligands différents.
Un ligand est une molécule ou anion, minéral ou organique, simple ou complexe, susceptible de former des complexes avec des cations ou métaux, au travers...

Une macromolécule est une molécule contenant un très grand nombre d'atomes, comme une protéine, un acide nucléique ou un polymère synthétique.
