Activité enzymatique
Définition
L'activité enzymatique est la quantité de substrat convertie par l'enzyme en moles par unité de temps. Elle mesure la quantité d'enzyme active présente dans un mélange à un instant donné. D'autre part, l'activité spécifique est l'activité de l'enzyme par mg d'enzyme totale.
L'activité enzymatique fait référence aux propriétés catalytiques générales d'une enzyme, et les dosages enzymatiques sont des procédures standardisées pour mesurer les quantités d'enzymes spécifiques dans un échantillon.
Les mécanismes de l'activité enzymatique :
Le mécanisme de l'activité enzymatique est simple : l'enzyme assimile un substrat, crée un complexe enzyme-substrat, puis donne des produits modifiés. Le cycle se déroule à répétition.
Explications
L'activité enzymatique est mesurée en unités qui indiquent la vitesse de réaction enzymatique catalysée par cette enzyme exprimée en micromoles de substrat transformé (ou de produit formé) par minute.
Par exemple, une unité (U) d'activité enzymatique a été définie comme la quantité d'enzyme qui a libéré 1 µmole de p-nitroaniline en 1 minute à 37 °C.
Certains herbicides sont utilisés pour bloquer l'activité enzymatique des plantes. Une minuscule molécule d'herbicide peut se fixer au site actif d'une enzyme et l'empêcher de fonctionner. Les plantes se sont adaptées en changeant un ou deux acides aminés dans leurs enzymes. Ils ajustent leur structure, peuvent continuer à travailler et l'herbicide ne peut plus limiter l'enzyme.
La bêta-glucosidase (BGL) agit sur les liaisons bêta-1,4-glucosidiques du cellobiose et des cellodextrines avec un degré de polymérisation (DP) allant de 3 à 6. Elle agit également sur des substrats chromogéniques tels que le para-nitrophényl glucopyranoside (PNPG). L'activité BGL peut être mesurée soit en utilisant du cellobiose soit du PNPG comme substrat. Le test PNPG prend en compte la vitesse de réaction initiale et l'activité enzymatique est calculée sur la base de la plage linéaire entre l'absorbance et les concentrations enzymatiques. L'activité enzymatique est exprimée en unités internationales (UI/ml).
Action enzymatique
Il existe quatre étapes d'action enzymatique :
- L'enzyme et le substrat sont dans la même zone. Certaines situations ont plus d'une molécule de substrat que l'enzyme va changer.
- L'enzyme s'accroche au substrat dans une zone spéciale appelée le site actif. La combinaison est appelée complexe enzyme/substrat. Les enzymes sont très, très spécifiques et ne s'accrochent pas à n'importe quelle molécule. Le site actif est une zone de forme spéciale de l'enzyme qui s'adapte autour du substrat. Le site actif est comme la griffe du robot sur la chaîne de montage. Il ne peut saisir qu'une ou deux parties.
- Un processus appelé catalyse intervient. La catalyse, c'est quand le substrat est changé. Il pourrait être décomposé ou combiné avec une autre molécule pour créer quelque chose de nouveau. Il rompra ou créera des liaisons chimiques. Une fois terminé, vous aurez le complexe enzyme/produits.
- L'enzyme libère le produit. Lorsque l'enzyme lâche prise, elle reprend sa forme d'origine. Il est alors prêt à travailler sur une autre molécule de substrat.
Facteurs affectant l'analyse enzymatique
L'activité enzymatique est mesurée in vitro dans des conditions qui souvent ne ressemblent pas étroitement à celles in vivo. L'objectif de la mesure de l'activité enzymatique est normalement de déterminer la quantité d'enzyme présente dans des conditions définies, de sorte que l'activité puisse être comparée d'un échantillon à un autre, et d'un laboratoire à un autre. Les conditions choisies sont généralement au pH optimal, à des concentrations de substrat "saturantes" et à une température facile à contrôler. Dans de nombreux cas, l'activité est mesurée dans le sens opposé à celui de la fonction naturelle de l'enzyme. Néanmoins, avec une étude complète des paramètres qui affectent l'activité enzymatique, il devrait être possible d'extrapoler à l'activité attendue in vivo.
Les facteurs qui affectent l'activité d'une enzyme comprennent les concentrations de substrat, le pH, la force ionique et la nature des sels présents, et la température. L'activité est mesurée comme le taux initial d'utilisation du substrat lorsqu'aucun produit n'est présent (une situation qui existe rarement in vivo). Il existe de nombreux composés qui peuvent agir comme des inhibiteurs qui répriment l'activité, ils ne doivent donc pas être présents. Le sujet des inhibiteurs d'enzymes est un sujet complexe qui ne sera pas traité ici. Cependant, il convient de noter que l'inverse, à savoir l'implication d'activateurs non substrats, doit être pris en compte avec de nombreuses enzymes, car elles peuvent être totalement inactives sans la présence d'un activateur.
Contrôle de l'activité
L'activité enzymatique peut être contrôlée dans la cellule principalement de ces cinq manières :
- Production enzymatique (au niveau de la transcription ou de la traduction) : la synthèse d'une enzyme peut être favorisée ou désavantagée en réponse à certains stimuli reçus par la cellule. Cette forme de régulation génétique s'appelle induction et inhibition enzymatiques. Par exemple, les bactéries pourraient acquérir une résistance aux antibiotiques tels que la pénicilline grâce à l'induction d'enzymes appelées bêta-lactamases, qui hydrolysent le noyau bêta-lactame de la molécule de pénicilline. Les enzymes présentes dans le foie, appelées cytochrome P450, constituent un autre exemple.les oxydases, qui sont d'une importance vitale dans le métabolisme des médicaments et des médicaments. L'induction ou l'inhibition de ces enzymes peut entraîner l'apparition d'interactions pharmacologiques.
- Compartimentation enzymatique : les enzymes peuvent être situées dans différents compartiments cellulaires, de sorte que différentes voies métaboliques peuvent avoir lieu indépendamment. Par exemple, les acides gras sont synthétisés par un ensemble d'enzymes situées dans le cytosol, dans le réticulum endoplasmique et dans l'appareil de Golgi, et ensuite, lesdits acides gras sont utilisés par un autre ensemble d'enzymes différentes comme source d'énergie dans les mitochondries. par β-oxydation.
- Inhibiteurs et activateurs enzymatiques : certaines molécules peuvent activer ou inhiber les enzymes. Par exemple, le produit final d'une voie métabolique agit généralement comme un inhibiteur de certaines des enzymes impliquées dans les premières réactions de la voie, établissant ainsi une rétroaction négative qui régule la quantité de produit final obtenue par cette voie. Ce mécanisme de rétroaction négative permet d'adapter efficacement la vitesse de synthèse des métabolites intermédiaires à la demande de la cellule, et permet de distribuer de manière économique des matériaux et de l'énergie afin d'éviter un excès ou une pénurie de produits finis. Ce contrôle enzymatique permet de maintenir un environnement relativement stable à l'intérieur des organismes vivants.
- modification enzymatique post-traductionnelle : les enzymes peuvent subir diverses modifications post-traductionnelles telles que la phosphorylation, la myristoylation et la glycosylation. Par exemple, dans la réponse à l'insuline, la phosphorylation d'une multitude d'enzymes intervient, telle que la glycogène synthase, qui aide à contrôler la synthèse ou la dégradation du glycogène et permet à la cellule de réagir aux variations des niveaux de sucre dans le sang. Un autre exemple de post-traduction est la dégradation de la chaîne polypeptidique. la chymotrypsine, protéase digestive, est synthétisée sous une forme inactive, le chimotrypsinogène, dans le pancréas et transportée dans cet état vers l'estomac, où elle sera activée. Cela empêche l'enzyme de digérer le pancréas et les autres tissus qu'elle traverse avant d'atteindre l'estomac. Ce type de précurseur inactif d'une enzyme s'appelle zymogène.
- Activation enzymatique dépendante de l'environnement : certaines enzymes peuvent être activées lorsqu'elles passent d'un environnement à des conditions différentes, telles que le passage de l'environnement réducteur du cytoplasme à l'environnement oxydant du périplasme, le passage d'un environnement à pH élevé à un autre avec un pH bas, etc. Par exemple, l'hémagglutinine du virus de la grippe est activée par un changement de conformation qui existe lorsque le pH du milieu est suffisamment acide, ce qui intervient lorsque le virus pénètre à l'intérieur de la cellule par le biais d'un lysosome.
Activité enzymatique dans des cellules individuelles
L'activité enzymatique dans une seule cellule, et même dans un seul compartiment cellulaire, est mesurée à l'aide de nos nanokits. Par rapport aux méthodes actuelles utilisant une conception structurelle compliquée ou une fonctionnalisation de surface des sondes, les nanokits ont adapté les caractéristiques des kits bien établis et ont intégré les composants du kit et le détecteur dans un nano-capillaire.
Par conséquent, cette approche fournit un dispositif spécifique pour caractériser l'activité enzymatique au niveau de la cellule unique et au niveau subcellulaire. Cette technologie "nanokit" devrait donc être recherchée pour adoption par un large éventail de groupes de recherche travaillant dans des domaines tels que la signalisation cellulaire, la biologie moléculaire/biologie cellulaire et la biochimie. La plate-forme polyvalente d'électrodes nano-capillaires ouvre la technologie "nanokit" à l'analyse d'autres espèces telles que l'ADN, l'ARN et d'autres biomolécules d'intérêt.
De plus, la technologie des nanokits a beaucoup à offrir en conjonction avec des méthodes de sonde fluorescente de pointe pour l'analyse de cellules individuelles qui ont fourni une grande partie de notre compréhension actuelle de la signalisation intracellulaire.
Le nanokit fournit des données complémentaires à un coût qui devrait étendre ce niveau d'étude à un plus large éventail de chercheurs et aborde également certains des défis techniques pour l'analyse de l'activité enzymatique à l'aide d'approches de fluorescence standard, telles que la cytotoxicité et les exigences structurelles des sondes.
Synonymes, antonymes
Voir tous les synonymes pour "activité enzymatique".1 synonyme (sens proche) de "activité enzymatique" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACTIVITÉ ENZYMATIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACTIVITE ENZYMATIQUE est dans la page 2 des mots en A du lexique du dictionnaire.
Mots en A à proximité
actique activateuractivateur biologiqueactivation d'un acide aminéactivine activité enzymatiqueactivité géologique activité ionique actophile aculé aculéolé
En rapport avec "activité enzymatique"
Ce qui est enzymatique relève des enzymes, que ce soit une réaction, une inhibition, une catalyse, une hydrolyse ou d'autres activités.
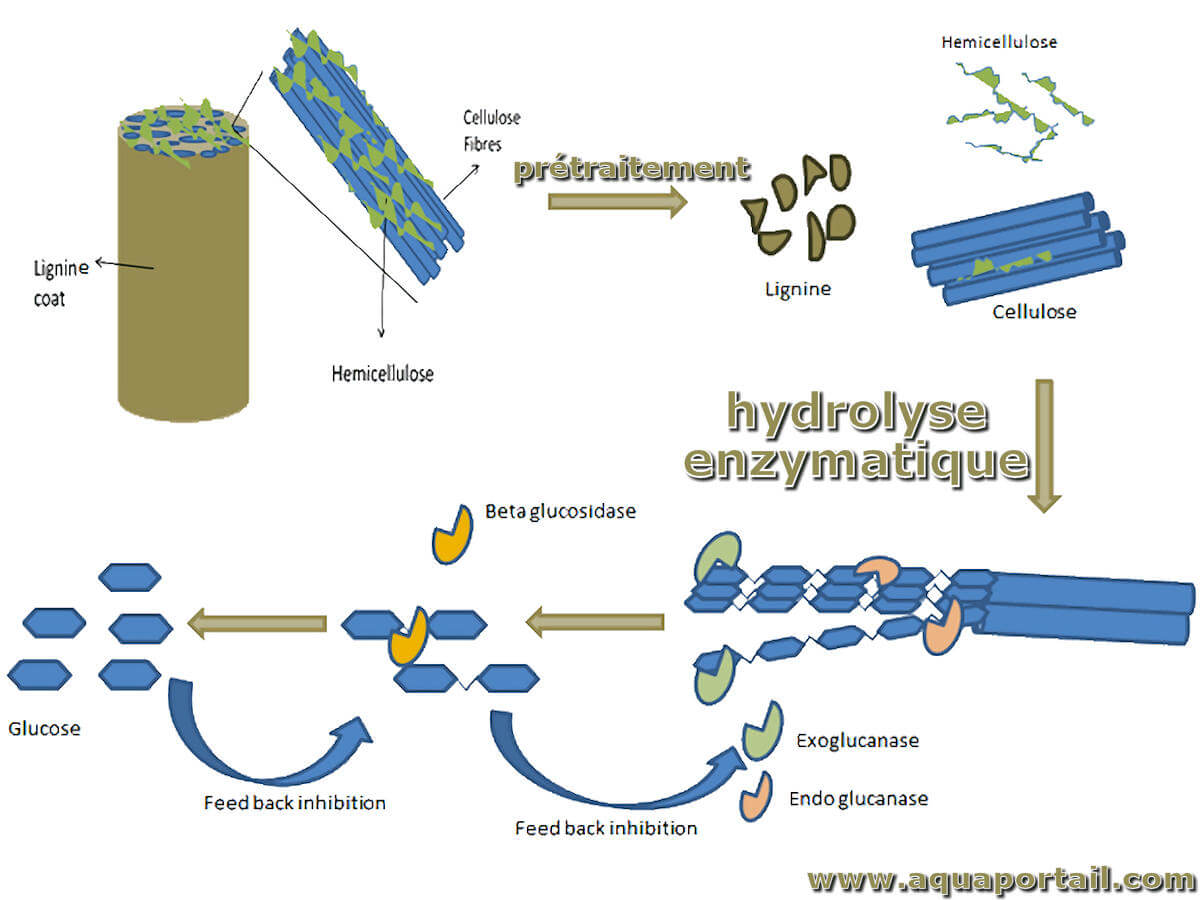
L'hydrolyse enzymatique est la dégradation d'un composé en présence d'enzymes suite à sa réaction avec l'eau.
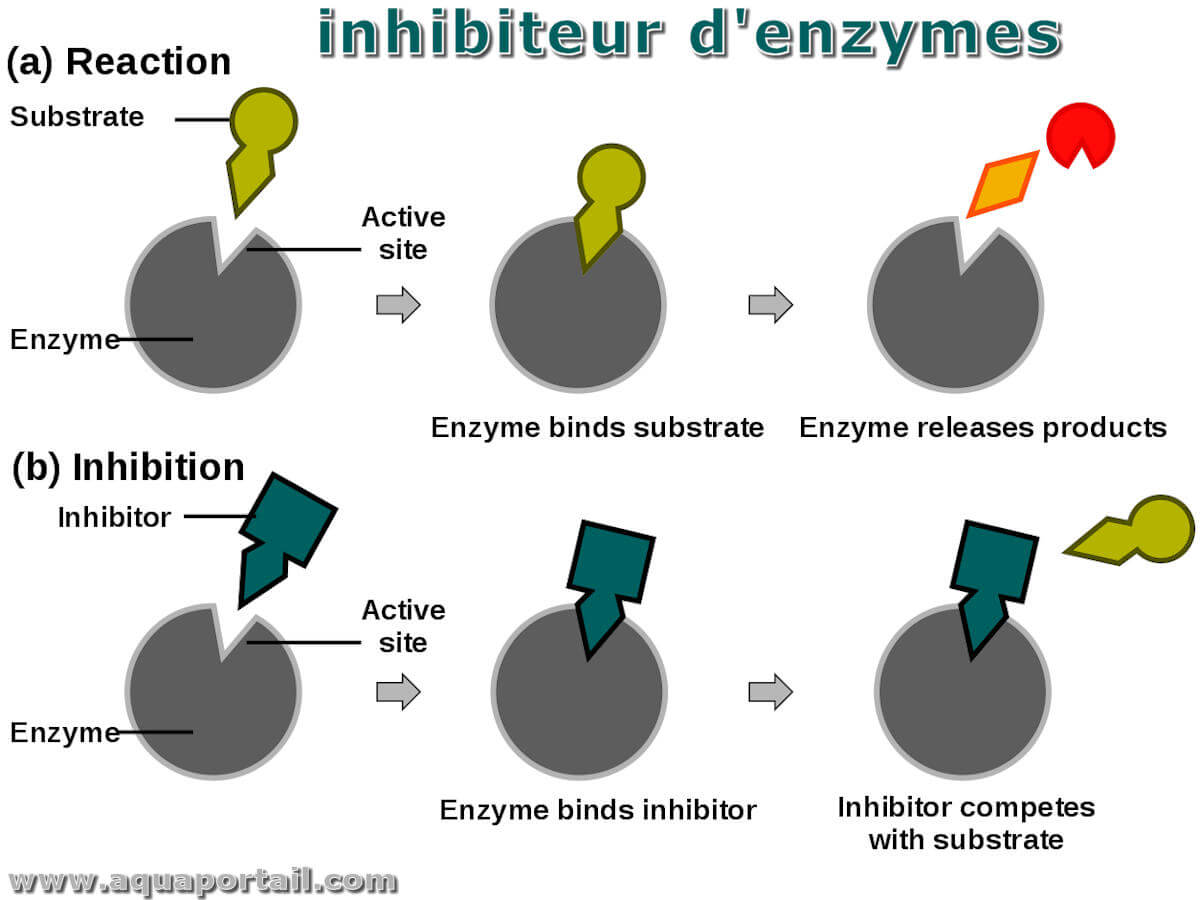
Un inhibiteur enzymatique est une molécule qui perturbe la voie de réaction normale entre une enzyme et un substrat.
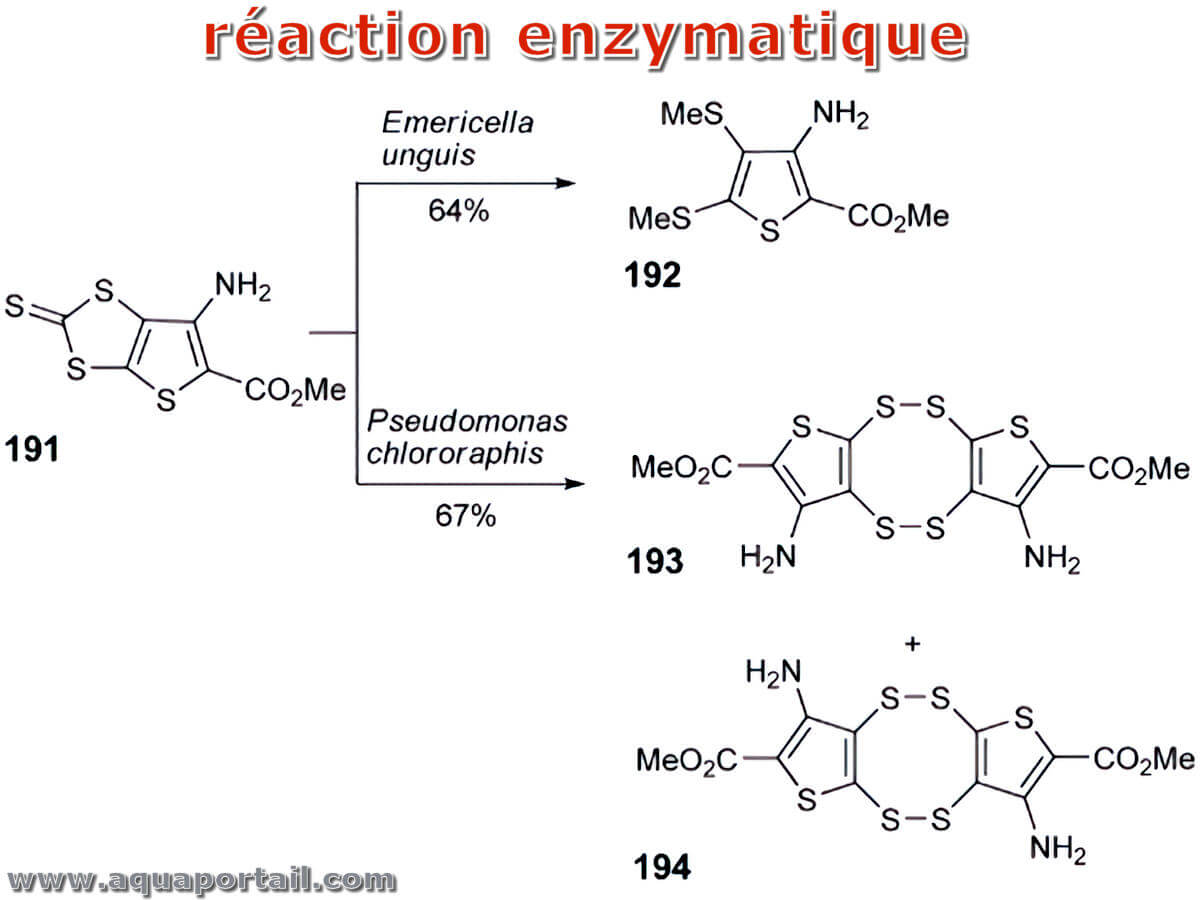
La réaction enzymatique est une réaction biochimique catalysée par des enzymes. Les réactions enzymatiques sont intrinsèques à tous les processus biologiques.
