Glycosylation
Définition
La glycosylation est un processus biochimique dans lequel un glucide est ajouté à une autre molécule. Cette molécule s'appelle l'accepteur. La molécule accepteur peut être de plusieurs types, par exemple de nature protéique ou lipidique.
Lorsque la glycosylation est effectuée sur un groupe alcool ou thiol, le processus est appelé glycosidation et la molécule résultante est appelée glycoside.
Le processus de glycosylation :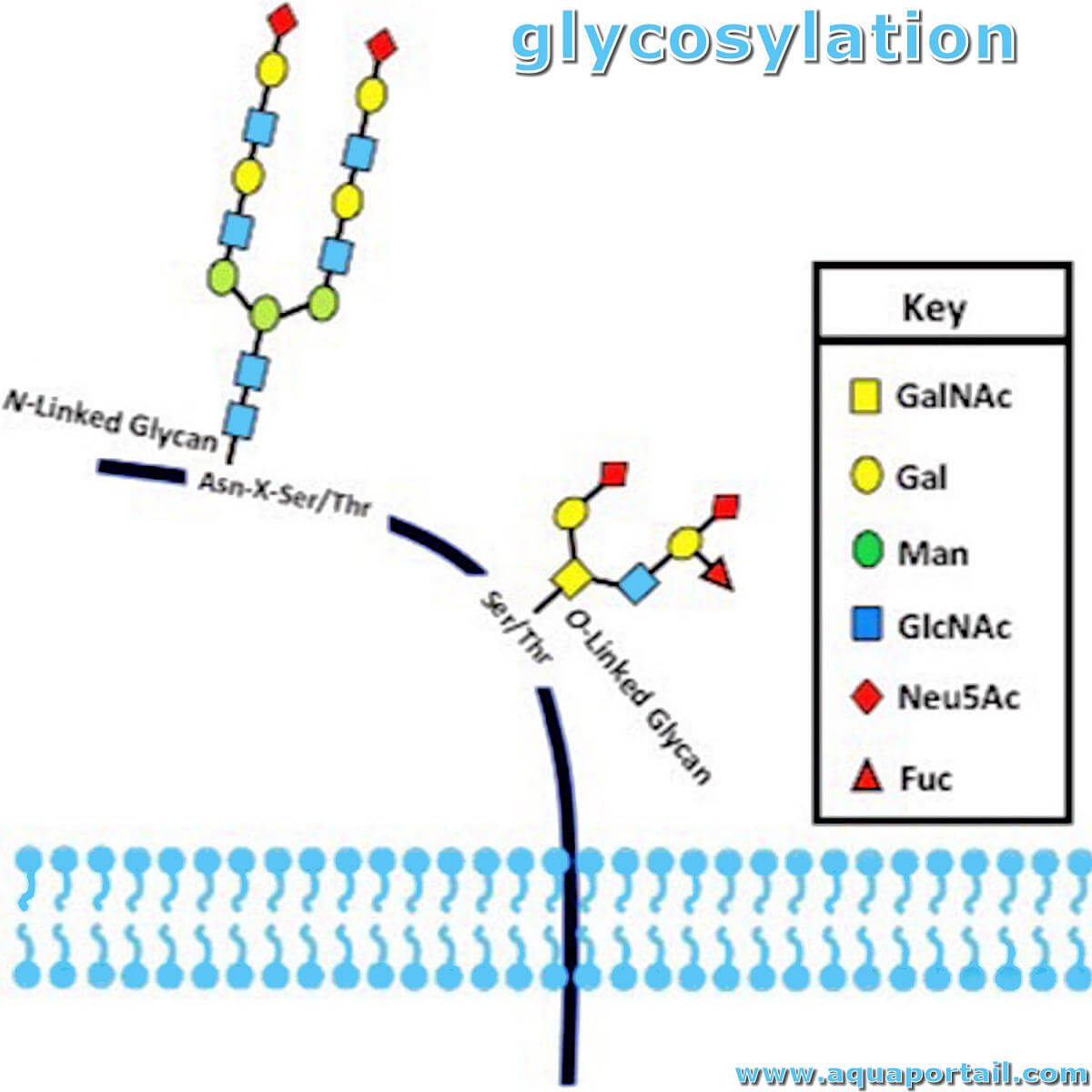
Les deux principaux types de glycosylation des protéines.
Explications
L'un des types les plus importants de glycosylation est la glycosylation de protéines, qui peut se présenter comme une modification co-transductionnelle (existe parallèlement à la synthèse de la protéine lorsque le ribosome est associé au réticulum endoplasmique) ou post-traductionnelle (existe lorsque la protéine est déjà terminée). synthèse).
La plupart des protéines stockées dans le réticulum endoplasmique rugueux subissent une glycosylation.
La glycosylation désigne l'addition de glucides sur un élément protéique. On distingue la N-glycosylation et la O-glycosylation :
- la N-glycosylation a lieu dans la lumière du réticulum endoplasmique. Un oligosaccharide, toujours le même, est transféré d'un dolichol au groupement NH, de la chaîne latérale d'une asparagine de la protéine, transfert catalysé par une oligosaccharyl transférase de la membrane du réticulum;
- la O-glycosylation a lieu dans l'appareil de Golgi. Les glucides sont ajoutés sur le groupement OH de la chaîne latérale d'une thréonine ou d'une sérine, transfert catalysé par une glycosyltransférase.
Les mucines du lait sont des protéines de poids moléculaire élevé et hautement glycosylées. Les deux tiers de la mucine du lait maternel sont liés aux membranes des globules gras du lait. La concentration de mucine dans le lait maternel varie entre 50 et 90 mg/mL. Les globules gras du lait maternel et la mucine de leurs membranes inhibent la liaison d'E. coli S-fimbriée aux cellules épithéliales humaines.
Les domaines de glycosylation
La glycosylation existe dans tous les domaines de la vie, mais dans un ordre et un nombre de glucides différents. Les modèles de glycosylation impliqués dans les processus de signalisation biologique sont très spécifiques et leur biosynthèse est une modification post-traductionnelle importante des protéines. La majorité des protéines eucaryotes sont glycosylées. Les enzymes hautement spécifiques impliquées sont appelées glycosyltransférases. Des modifications post-traductionnelles de ce type sont à l'étude en biochimie dans le contexte de la glycomique et en biologie dans le contexte de la glycobiologie. De nombreux agents infectieux intestinaux se lient aux glycosylations pour se fixer à une cellule lors de l'infection.
Des méthodes de glycosylation chimique ont également été développées pour la synthèse en laboratoire. La glycation se distingue de la glycosylation en tant que réaction chimique sans implication enzymatique entre l'amine et le sucre réducteur.
Fonctions
La glycosylation remplit des fonctions très différentes. D'une part, il augmente la stabilité de certaines protéines et protège contre la dégradation protéolytique. De nombreuses protéines ne se replient pas correctement si elles n'ont pas déjà été glycosylées - ainsi, la glycosylation peut servir la conformation protéique physiologiquement fonctionnelle. Il peut également modifier l'affinité pour les partenaires de liaison (par exemple, le récepteur de l'insuline). En plus des peptides signal, la glycosylation sert également au transport intracellulaire (ciblage des protéines) et à l'exocytose : les glycoprotéines sont transportées vers la membrane cellulaire (transport cellulaire). Les protéines non glycosylées ne peuvent pas être délivrées à la matrice extracellulaire. En outre, les saccharides servent également de composants structurels des membranes cellulaires et contribuent à l'interaction cellulaire. Une glycosylation différente des protéines de surface des érythrocytes conduit à différents groupes sanguins de nombreux mammifères. Les glycosylations peuvent également servir de lubrifiants dans la muqueuse ou le mucus.
Processus
Il y a deux principaux types de glycosylation des protéines. La fixation de fragments de sucre aux protéines est une modification post-traductionnelle qui fournit une plus grande diversité protéomique aux protéines. La glycosylation liée à N intervient à travers les résidus asparagine de la protéine, tandis que la glycosylation à liaison O intervient à travers la sérine ou la thréonine.
Synonymes, antonymes
Voir tous les synonymes pour "glycosylation".1 synonyme (sens proche) de "glycosylation" :
- glycosidation
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à GLYCOSYLATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot GLYCOSYLATION est dans la page 3 des mots en G du lexique du dictionnaire.
Mots en G à proximité
glycoprotéine glycoprotéique glycosaminoglycane glycosidase glycoside glycosylationglycosyltransférase glyoxysome glyphosate glyptogenèse GMPc
En rapport avec "glycosylation"

Une aminoglycoside est un antibiotique bactéricide (aminoside) qui agit au niveau de la sous-unité 30S des ribosomes de certaines bactéries pour contrer...
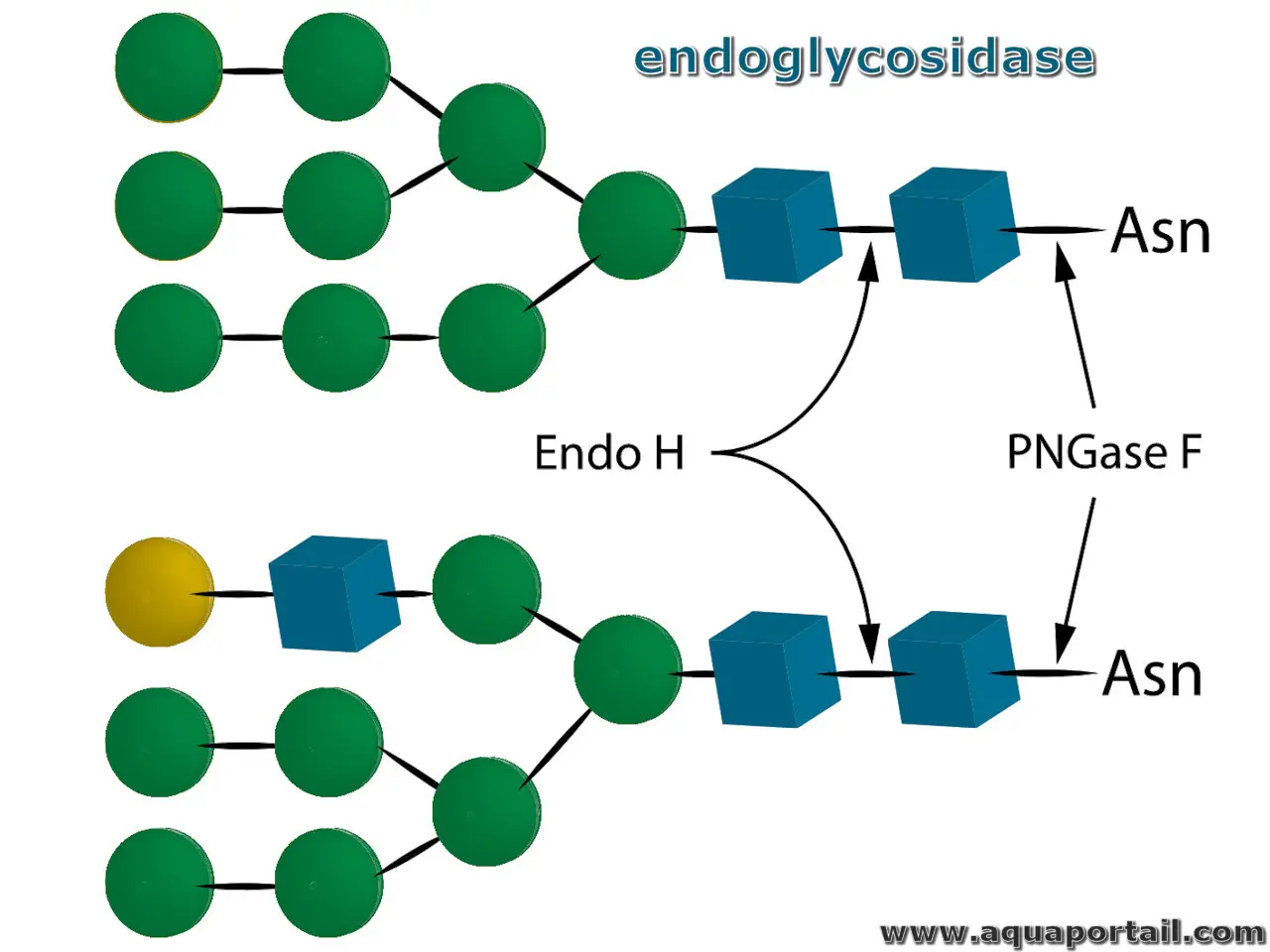
Une endoglycosidase est une enzyme qui catalyse l'hydrolyse d'une chaîne polyosidique en rompant les liaisons à l'intérieur de la chaîne.
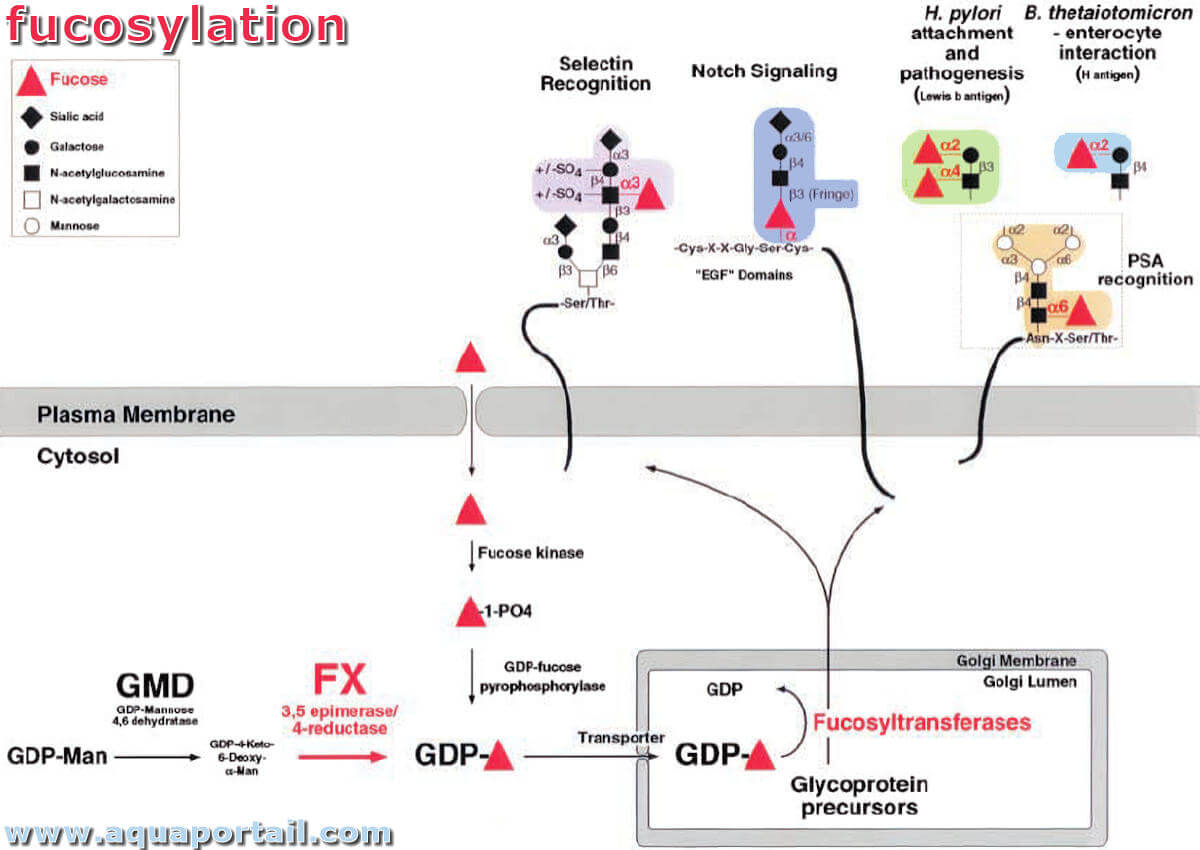
La fucosylation est l'une des modifications les plus courantes impliquant des oligosaccharides sur des glycoprotéines ou des glycolipides.
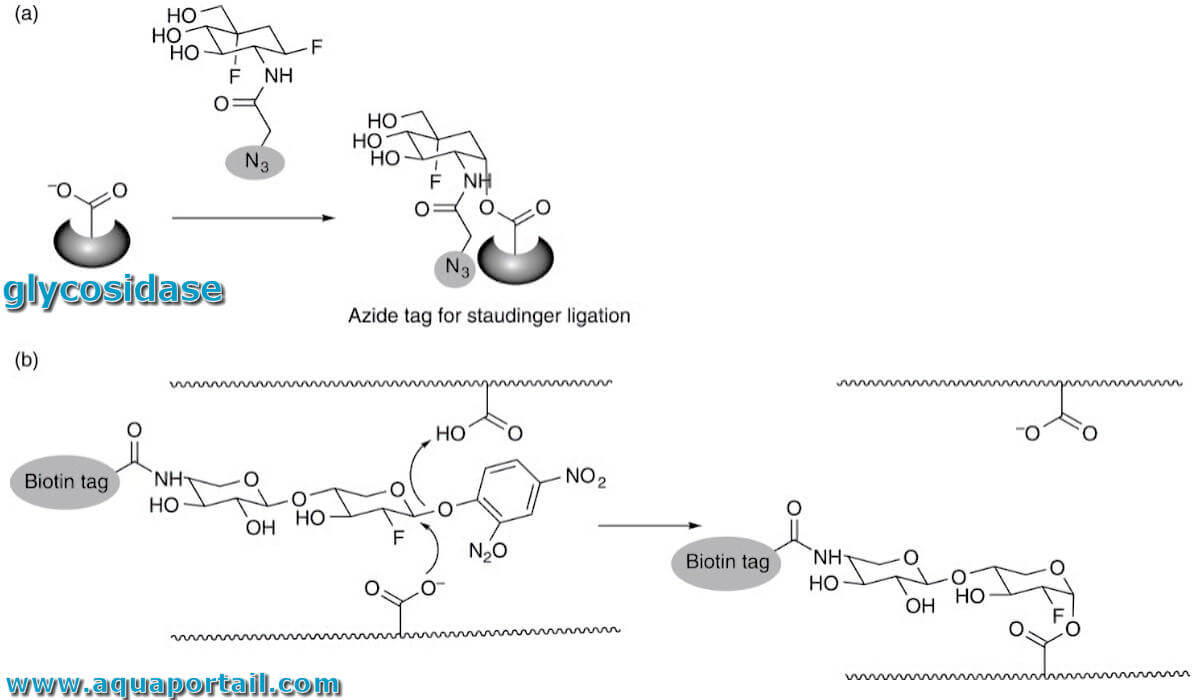
Une glycosidase est une enzyme dédiée à la dégradation des glucides complexes par clivage des liaisons glycosidiques.
