Modification post-traductionnelle
Définition
Une modification post-traductionnelle (PTM) est une modification biochimique qui intervient sur un ou plusieurs acides aminés d'une protéine après que la protéine a été traduite par un ribosome. La synthèse des protéines se produit au cours d'un processus appelé traduction.
Il existe différents types de modifications post-traductionnelles, notamment la phosphorylation, l'acétylation, la méthylation, la glycosylation, etc. Les PTM jouent un rôle important dans la biologie cellulaire, y compris la signalisation cellulaire, la structure cellulaire, la modification de l'ADN, etc.
Stratégies pour les modifications post-traductionnelles (PTM) :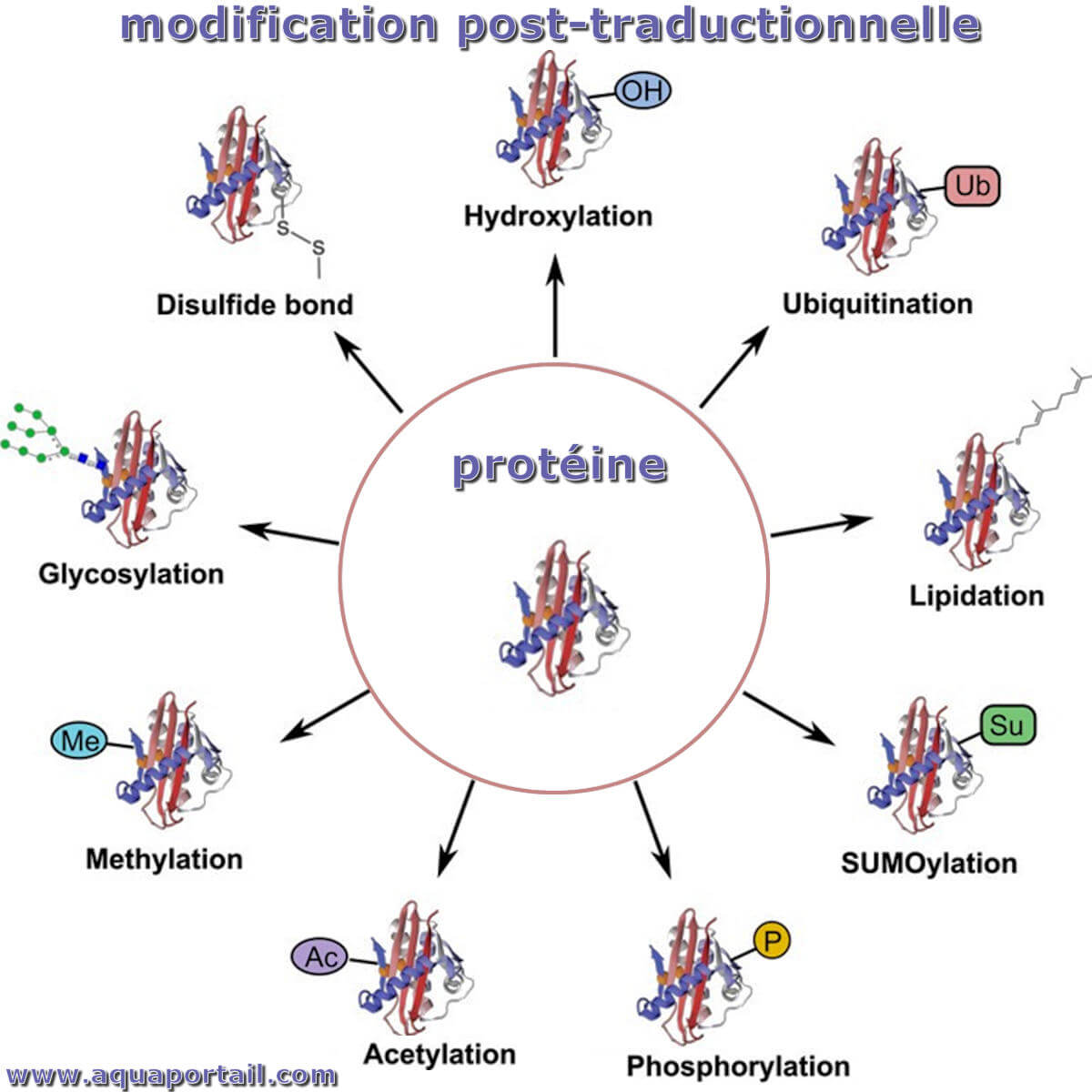
La modification post-traductionnelle (PTM) fait référence à la modification qui se produit sur une protéine après la traduction catalysée par des enzymes.
Explications
La modification post-traductionnelle (PTM) des protéines, étant l'une des dernières étapes de la biosynthèse des protéines, fait référence aux changements chimiques réversibles ou irréversibles que les protéines peuvent subir après la traduction. En d'autres termes, les PTM sont des modifications chimiques d'une chaîne polypeptidique qui se produisent après que l'ADN a été transcrit en ARN et traduit en protéine.
Ces altérations chimiques vont du clivage enzymatique de liaisons peptidiques aux additions covalentes de groupes chimiques particuliers, de lipides, de glucides ou même de protéines entières aux chaînes latérales d'acides aminés. Ces modifications chimiques d'une chaîne polypeptidique après sa biosynthèse élargissent la gamme des structures et des propriétés des acides aminés, et par conséquent, diversifient les structures et les fonctions des protéines.
Bien que l'ADN code généralement pour 20 acides aminés primaires, les protéines contiennent plus de 140 résidus différents, en raison de divers PTM. La capacité à subir une PTM est considérée comme l'un des deux mécanismes généraux élargissant la capacité de codage d'un génome à générer des protéomes hautement diversifiés et élargis (avec un autre mécanisme étant la diversification des protéines au niveau traductionnel via un épissage alternatif de leurs ARNm).
En conséquence, les protéomes sont nettement plus complexes que ce à quoi on peut s'attendre de l'analyse des génomes codants. Bien que certains PTM puissent être trouvés chez les procaryotes, ces modifications sont beaucoup plus courantes dans les cellules nucléées, qui sont généralement caractérisées par une large gamme de types et de fréquences de PTM. Certains PTM (par exemple, la phosphorylation) sont facilement réversibles par l'action d'enzymes de déconjugaison spécifiques.
L'interaction entre les enzymes de modification et de "démodification" permet un contrôle rapide et économique de la fonction des protéines. Un contrôle similaire par dégradation des protéines et synthèse de novo prendrait beaucoup plus de temps et coûterait beaucoup plus de bioénergie.
La PTM peut survenir à n'importe quel stade de la vie protéique. Certaines protéines sont modifiées peu de temps après la fin de leur traduction et avant les étapes finales de leur repliement. Ces premiers PTM pourraient affecter l'efficacité de repliement des protéines et la stabilité conformationnelle des protéines, et même déterminer le sort de la protéine naissante en la dirigeant vers des compartiments cellulaires distincts. D'autres protéines sont modifiées après leur repliement et leur localisation. Ici, les PTM peuvent activer ou inactiver les fonctions catalytiques ou autrement influencer l'activité biologique de la protéine.
Analyse
Pour l'analyse de la modification des protéines, les stratégies traditionnelles, comme le marquage radioactif et le transfert Western, peuvent être spécifiques et relativement quantitatives, mais elles nécessitent une connaissance préalable du type de modification et sont limitées par la disponibilité et la spécificité des anticorps. La spectrométrie de masse (MS) est la méthode appropriée pour l'analyse des modifications protéiques car elle peut fournir des informations universelles sur les modifications protéiques sans connaissance a priori et en localisant les sites de modification.
Il existe plusieurs stratégies pour l'identification PTM, y compris des approches ascendantes, descendantes et médianes.
Stratégie ascendante
La stratégie ascendante pour l'identification PTM est l'approche protéomique traditionnelle. Dans la stratégie ascendante, une protéine est généralement digérée avec une enzyme (comme la trypsine) en petits peptides en gel ou en solution. Ces peptides seront détectés par spectromètre de masse et la modification pourra être cartographiée dans les peptides récupérés.
La stratégie ascendante a une sensibilité plus élevée que la méthode descendante. Cependant, il existe certaines limites intrinsèques à la caractérisation des modifications protéiques pour les stratégies ascendantes. Le premier est un faible pourcentage de couverture de la séquence protéique, ce qui conduit à un statut de modification de la partie de séquence non récupérée reste inconnu.
De plus, la complexité globale de l'échantillon est augmentée en raison de l'abondance de petits composants peptidiques par digestion des protéines. De plus, la connexion entre les modifications sur des portions disparates d'une protéine peut être perdue car les peptides typiques de la digestion tryptique ne contiennent que 5 à 20 acides aminés.
Stratégie descendante
La protéomique descendante devient une stratégie puissante pour l'analyse des modifications protéiques. Pour la stratégie descendante, la protéine entière est directement analysée dans la SEP sans digestion, de sorte que les informations complètes sur l'état de modification peuvent être révélées. Il peut détecter universellement toutes les modifications existantes, y compris les PTM (c'est-à-dire la phosphorylation, la protéolyse et l'acétylation) et les variantes de séquence (c'est-à-dire les mutants, les isoformes alternativement épissées et les polymorphismes d'acides aminés) simultanément dans 1 spectre sans connaissance a priori.
Dans cette stratégie, le poids moléculaire d'une protéine intacte est d'abord mesuré et le compare à la valeur calculée sur la base de la séquence protéique prédite par l'ADN, qui peut révéler des modifications dans la séquence protéique à l'échelle mondiale.
Une forme d'intérêt spécifiquement modifiée peut être directement isolée dans le spectromètre de masse et ensuite fragmentée par MS en tandem pour une cartographie fiable des sites de modification. Bien que la stratégie descendante présente de nombreux avantages pour l'analyse de la modification des protéines, certains défis doivent encore être résolus, notamment la solubilité, la sensibilité et la limite de détection des protéines, ainsi que l'exigence d'instruments haut de gamme.
Stratégie middle-down
La protéomique moyenne-basse est récemment apparue comme une stratégie à haut débit pour définir la fréquence de coexistence PTM. L'approche intermédiaire peut être considérée comme une variante de l'approche descendante. Dans cette stratégie, les protéines sont nécessaires à la protéolyse douce pour obtenir les grands peptides généralement en utilisant AspN et GluC. Les peptides sont ensuite séquencés par spectrométrie de masse en tandem en utilisant des technologies similaires à la méthode top-down.
Par exemple, la stratégie du milieu vers le bas peut être utilisée pour l'analyse des histones, dans laquelle les protéines sont généralement digérées en peptides dans la plage de 3 à 9 kDa. Les approches middle-down préservent largement les modifications combinatoires de la queue d'histone, tout en se rapprochant de la sensibilité de l'approche bottom-up.
Synonymes, antonymes
Voir tous les synonymes pour "modification post-traductionnelle".2 synonymes (sens proche) de "modification post-traductionnelle" :
- PTM
- régulation post-traductionnelle
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à MODIFICATION POST-TRADUCTIONNELLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression MODIFICATION POST-TRADUCTIONNELLE est dans la page 4 des mots en M du lexique du dictionnaire.
Mots en M à proximité
mode abrité mode battumode d'appariementmode hydrodynamique modificationmodification post-traductionnellemodification racémique moelle moelle épinière moelle spinale moina
En rapport avec "modification post-traductionnelle"

Une acétylation est un transfert d'un groupe acétyle CH₃-CHO sur une molécule réceptrice.

L'acétylation des histones signifie la suppression de la charge positive de la molécule d'histone, ce qui affaiblit l'interaction entre les groupes phosphate...

La biosynthèse des protéines fait référence au processus biologique par lequel les acides aminés sont assemblés par liaison peptidique en séquences...
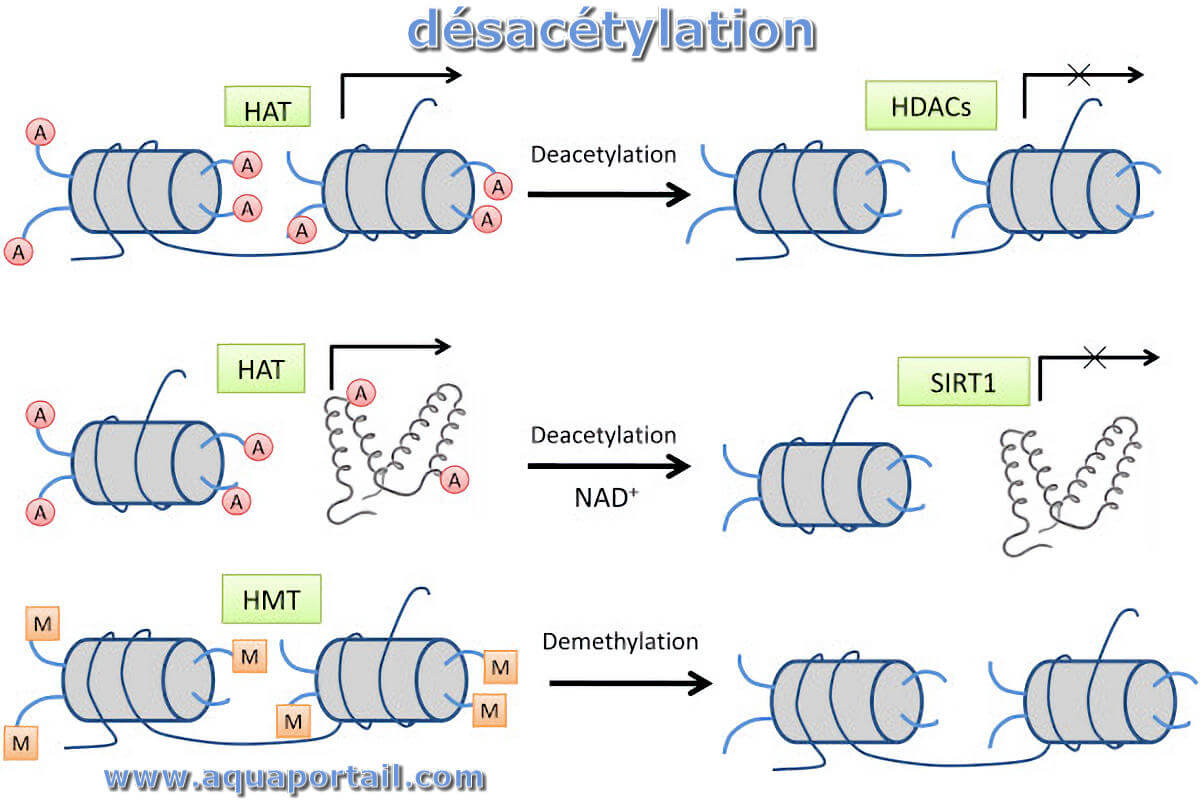
La désacétylation est le processus d'élimination des groupes acétyle de la chitine et de substitution des groupes amino réactifs (liaison simple NH₂).
