Peptide
Définition
Un peptide est une molécule comprenant au moins deux résidus d'acides aminés reliés par une liaison peptidique CO-NH, issue de la condensation déshydratante entre le groupement NH2 et le groupement carboxylique des acides aminés voisins.
Un peptide est un composé chimique organique constitué de petites chaînes (généralement jusqu'à 50) d'acides aminés liés entre eux par des liaisons peptidiques. Les peptides sont constitués par biosynthèse par le système ARNm/ARNt/ribosome.
Un tétrapeptide :
Ce peptide, avec 4 chaînes, est un tétrapeptide, donc aussi un oligopeptide.
Explications
Les peptides peuvent également être le résultat d'une dégradation de la protéine, par exemple par dégradation et digestion dans les cellules ou le tractus intestinal. Les peptides ne diffèrent des protéines que par leur taille, la protéine est un polypeptide.
Voir aussi un peptide signal, un peptide de transit, un oligopeptide, un neuropeptide, un glycopeptide, un fibrinopeptide, un cyclopeptide et un lipopeptide.
Parmi les peptidases, voir une aminopeptidase, une carboxypeptidase, une endopeptidase, une entéropeptidase, une exopeptidase, ou encore un peptidoglycane.
On parle de dipeptides, de tripeptides lorsque la chaîne ne comprend que deux ou trois résidus d'acide aminé; le terme d'oligopeptide désigne une petite chaîne d'acides aminés, un polymère ne comprenant qu'une à deux ou trois dizaines de résidus. Les chaînes d'acides aminés plus longues sont appelées des polypeptides. Le terme de protéines est réservé à ces chaînes polypeptidiques, une protéine pouvant être constituée de plusieurs chaînes réunies par des ponts disulfures.
Le terme peptide a été caractérisé par le chimiste allemand Hermann Emil Fisher. Le nom peptide était composé du grec peptos (digestion) et de la terminaison polysaccharide.
Les peptides sont nommés d'après les acides aminés dont ils sont constitués, en partant de l'extrémité N-terminale (extrémité avec le groupe amino libre); par exemple, le dipeptide est appelé carnosine (consistant en un résidu de bêta-alanine et d'histidine).
La formation de peptides catalysés par le COS et les ions métalliques dans des environnements volcaniques par des fluides hydrothermaux pourrait avoir été la première étape du processus de formation de protéines pour les premiers organismes vivants il y a environ 4 milliards d'années.
Propriétés
Les peptides dans lesquels les acides aminés individuels sont liés linéairement dans une chaîne dans un ordre défini (séquence) peuvent être considérés comme une petite protéine. Les peptides avec des acides aminés liés de façon circulaire sont appelés cyclopeptides. De plus, les peptides diffèrent principalement par leurs masses molaires. La distinction des protéines selon le nombre d'acides aminés liés est fluide; avec une chaîne de plus de 100 acides aminés liés qui se déplie en une forme particulière, la molécule est communément appelée protéine. Les peptides avec glycosylations sont appelés glycopeptides ou glycoprotéines, peptides avec des lipides comme lipopeptides ou comme lipoprotéines.
Les organismes peuvent former des peptides par traduction exclusivement à partir d'acides aminés α de la forme L, car seuls les acides aminés génétiquement codés qui sont liés à un ARNt sont disponibles pour ce processus. Il est possible que différentes créatures soient présentes dans les acides riches et les acides aminés D dans les peptides, cependant, ce sont des produits des voies métaboliques spécifiques d'une synthèse peptidique non ribosomale et non de la biosynthèse des protéines.
Les peptides remplissent un grand nombre de fonctions physiologiques et peuvent être utilisés, par exemple, comme hormones de travail, d'autres montrent des effets anti-inflammatoires ou anti-inflammatoires; il existe également des peptides antimicrobiens ayant des effets antibiotiques ou antiviraux. Dans certains cas, leur mode d'action a été bien étudié.
Le terme "peptide" a été utilisé pour la première fois en 1902 par Emil Fischer pour les matériaux de départ des produits de dégradation des protéines par la pepsine dans la peptone, vu comme des monomères construits de manière analogue à un polysaccharide.
Structure
Lorsque les acides aminés sont condensés, le groupe carboxy d'un acide aminé réagit formellement avec l'élimination de l'eau avec le groupe amino de l'autre acide aminé pour former le groupe amide acide -CO-NH-, la liaison amide nouvellement formée entre l'atome de carbone du groupe carbonyle et l'atome d'azote devient une liaison peptidique. Le groupe amino libre à une extrémité du peptide est appelé le N terminal, le groupe carboxy libre à l'autre extrémité, est appelé le C terminus.
L'extrémité N- terminale est conventionnellement écrite à gauche, l'extrémité C- terminale à droite. À l'exception de l'acide aminé C- terminal, tous les acides aminés à gauche ont la terminaison -yl dans leurs noms triviaux, seul le nom de l'acide aminé à droite ne change pas (exemple : un dipeptide composé de deux acides aminés alanine est appelé alanyl-alanine).
La liaison peptidique ne peut pas tourner librement car il existe deux structures de résonance. Cela joue un rôle important dans la structure des protéines.
Synthèse peptidique
Dans les cellules des organismes vivants, des chaînes polypeptidiques individuelles se forment sur les ribosomes, qui se déploient ensuite dans la protéine. Cette synthèse de peptides ribomosomaux est également appelée biosynthèse des protéines. C'est la biosynthèse des protéines ou synthèse des peptides ribosomaux.
En outre, il existe également dans certains organismes une synthèse de peptides non tribosomiques sur une voie purement enzymatique au moyen de synthétases de peptides non tribosomiques (NRPS). NRPS peut également incorporer des acides aminés D ou des cyclopeptides qui se forment sous forme de peptides non tribosomiques (NRP). Ces NRPS existent non seulement dans différents micro-organismes des trois domaines des bactéries, des archées et des eucaryotes, mais aussi, par exemple, dans les organismes multicellulaires de nombreux champignons et de certains mollusques.
Peptide natriurétique auriculaire
Un peptide natriurétique auriculaire est une hormone (messager chimique) qui est produite par les oreillettes (chambres supérieures) du coeur pour réguler la pression artérielle et l'équilibre hydrique (homéostasie hydrosodée) par son action sur les reins. Le nom auriculaire vient de l'origine de l'hormone dans les cellules des oreillettes cardiaques et natriurétique fait référence à son rôle dans l'excrétion du sodium dans l'urine.
Cyclopeptide
Un cyclopeptide est un peptide cyclique, un peptide en forme d'anneau et donc des lactames en même temps. Les cyclopeptides comprennent des oligopeptides et des polypeptides, dont la séquence d'acides aminés est fermée de manière covalente pour former un cycle ou plus. Comme cyclopeptides, ils ont des liaisons peptidiques entre les acides aminés, tels que la cyclosporine A.
Les cyclopeptides hétérodètes ont également des liaisons autres que de simples peptides, par exemple la bacitracine et la microcystine ont chacune une liaison isopeptidique. En plus des liaisons peptidiques de liaison cyclique entre leurs acides aminés, les cyclopeptides des amatoxines et des phallotoxines ont également un pont croisé interne entre le tryptophane et la cystéine (comme la tryptathionine). L'auréobasidine A et HUN-7293 ont également des liaisons ester.
Les peptides cycliques sont constitués de deux ou plusieurs acides aminés disposés en anneau. Par conséquent, les cyclopeptides n'ont ni acide aminé C- terminal ni acide aminé N- terminal. Tous les peptides cycliques sont donc des lactames en même temps. Les liaisons cis- peptides sont présentes dans les peptides en forme d'anneau, tandis que les liaisons trans- peptides dominent dans la plupart des protéines natives (en forme de chaîne). Les 2,5- dicétopipérazines sont les dipeptides cycliques les plus simples. Certains antibiotiques sont des cyclopeptides, par exemple la cyclosporine.
Les cyclopeptides à deux cycles sont appelés peptides bicycliques, dont les plus petits comprennent la phalloïdine et l'amanitine.
D'autres exemples de cyclopeptides sont la bacitracine, la Colistine, la Cyclotide, la dactinomycine, la daptomycine, la gramicidine S, HC-toxine, hymenistatin, la nisine, la polymyxine B, la pristinamycine, l'octréotide, la valinomycine, Viscumamid ou Yunnanin A.
En raison de la forme de l'anneau, les cyclopeptides sont souvent résistants à la protéolyse (par exemple par les exopeptidases), sont plus thermostables et moins mobiles.
Les peptides en forme de chaîne (par exemple la kératine, l'insuline, l'ocytocine), dans lesquels deux chaînes ou plus sont liées via plusieurs ponts disulfures, entrent également dans la définition des cyclopeptides hétérodétiques - ces peptides contiennent également des anneaux, mais au sens le plus étroit, ils n'en font pas partie Cyclopeptides.
Les cyclopeptides remplissent diverses fonctions dans la nature. Souvent, des cyclopeptides contenant plutôt que les L - acides aminés habituels, en partie des acides aminés D ou des acides α- hydroxy carboxyliques (cyclodepsipeptides). Les cyclodepsipeptides sont à la fois des lactames et des lactones. Certains cyclopeptides sont générés par la synthèse de peptides non tribosomiques.
Les peptides cycliques les plus simples sont les dicétopipérazines (dipeptides cycliques). Des exemples de cyclopeptides homodètes plus grands sont la caspofungine, l'octréotide et la gramicidine S, les cyclopeptides ocytocine, daptomycine et α- amanitine, cependant, sont hétérodètes. D'autres exemples de cyclopeptides sont la pénicilline, la vancomycine, l'échinocandine et la bléomycine.
Au cours de la conception d'une protéine, des protéines de fusion cycliques peuvent être générées qui, en raison du manque d'accès aux exopeptidases, ont une stabilité (et donc une demi-vie biologique plus longue) ou une activité plus élevée. Les cyclopeptides isopeptidiques peuvent être générés in vivo par l'intéine.
Synonymes, antonymes
Voir tous les synonymes pour "peptide".3 synonymes (sens proche) de "peptide" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PEPTIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PEPTIDE est dans la page 2 des mots en P du lexique du dictionnaire.
Mots en P à proximité
péponide pepsine pepsinogène pepstatine peptidase peptidepeptide de transit peptide signal peptidoglycane péramorphose perceur
En rapport avec "peptide"
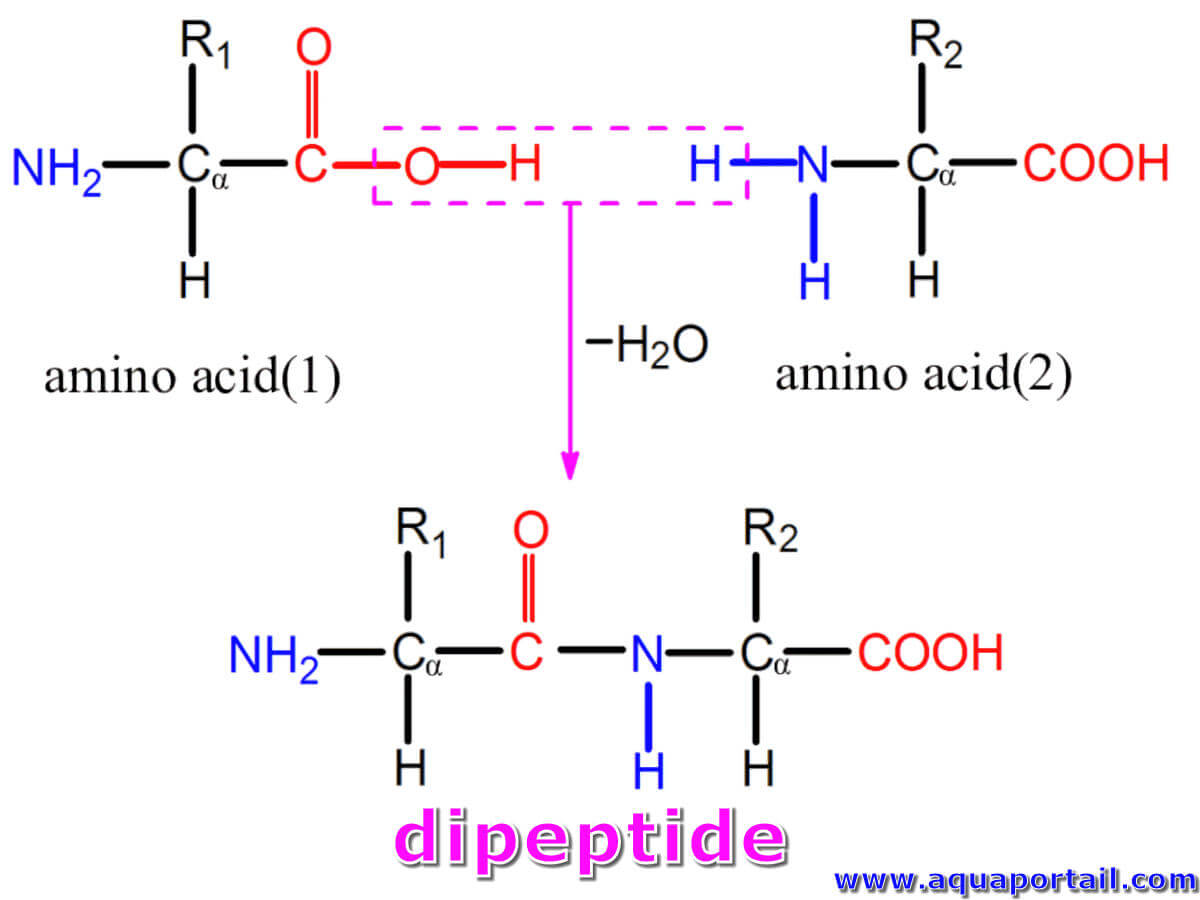
Un dipeptide est une molécule composée de deux peptides, la forme la plus simple d'un polypeptide de type oligopeptide.
facteur natriurétique auriculaire
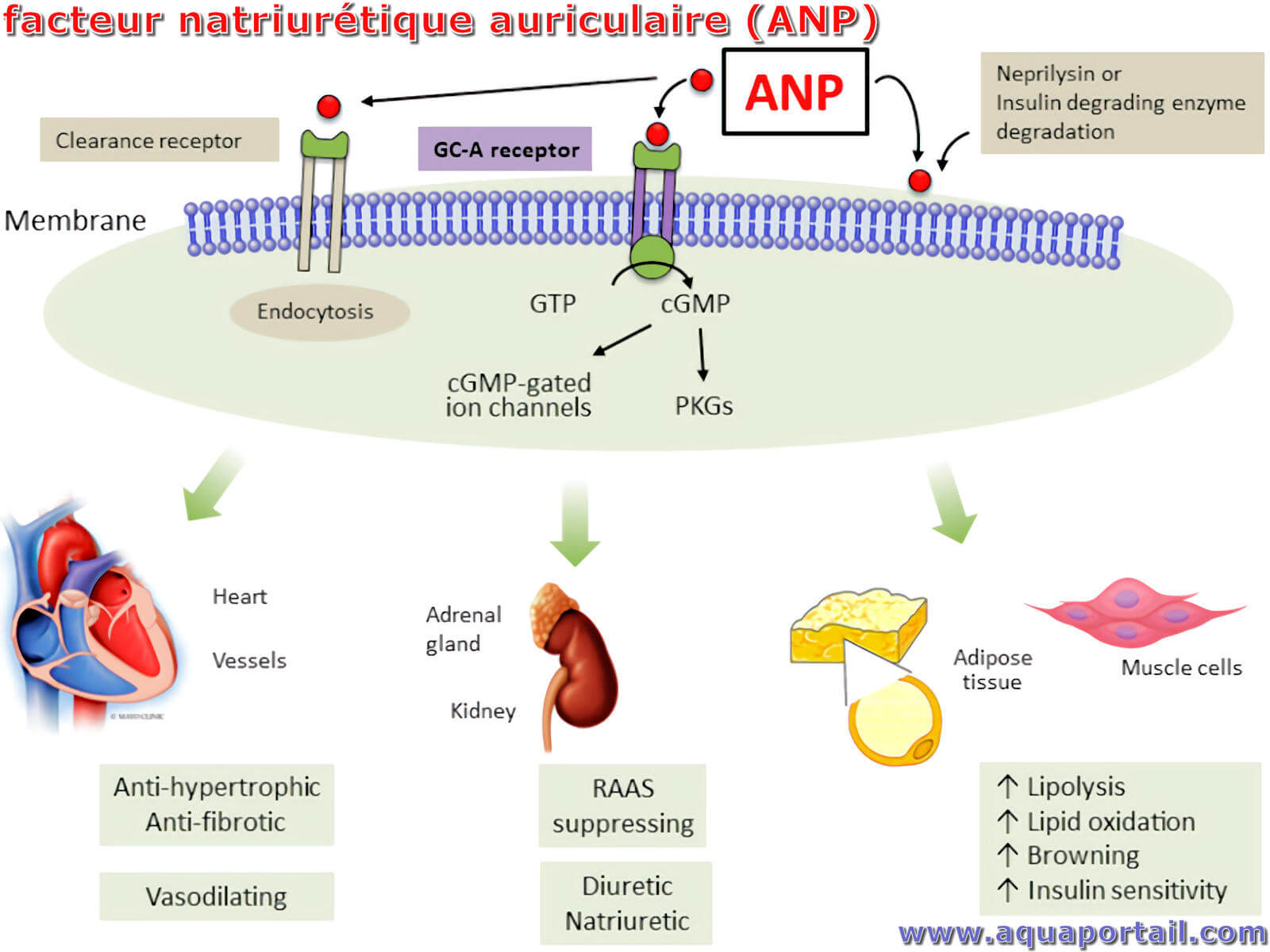
Sous les sigles FNA ou ANP, un facteur natriurétique auriculaire identifie une hormone peptidique de 28 acides aminés synthétisée par des myocytes spécialisés...
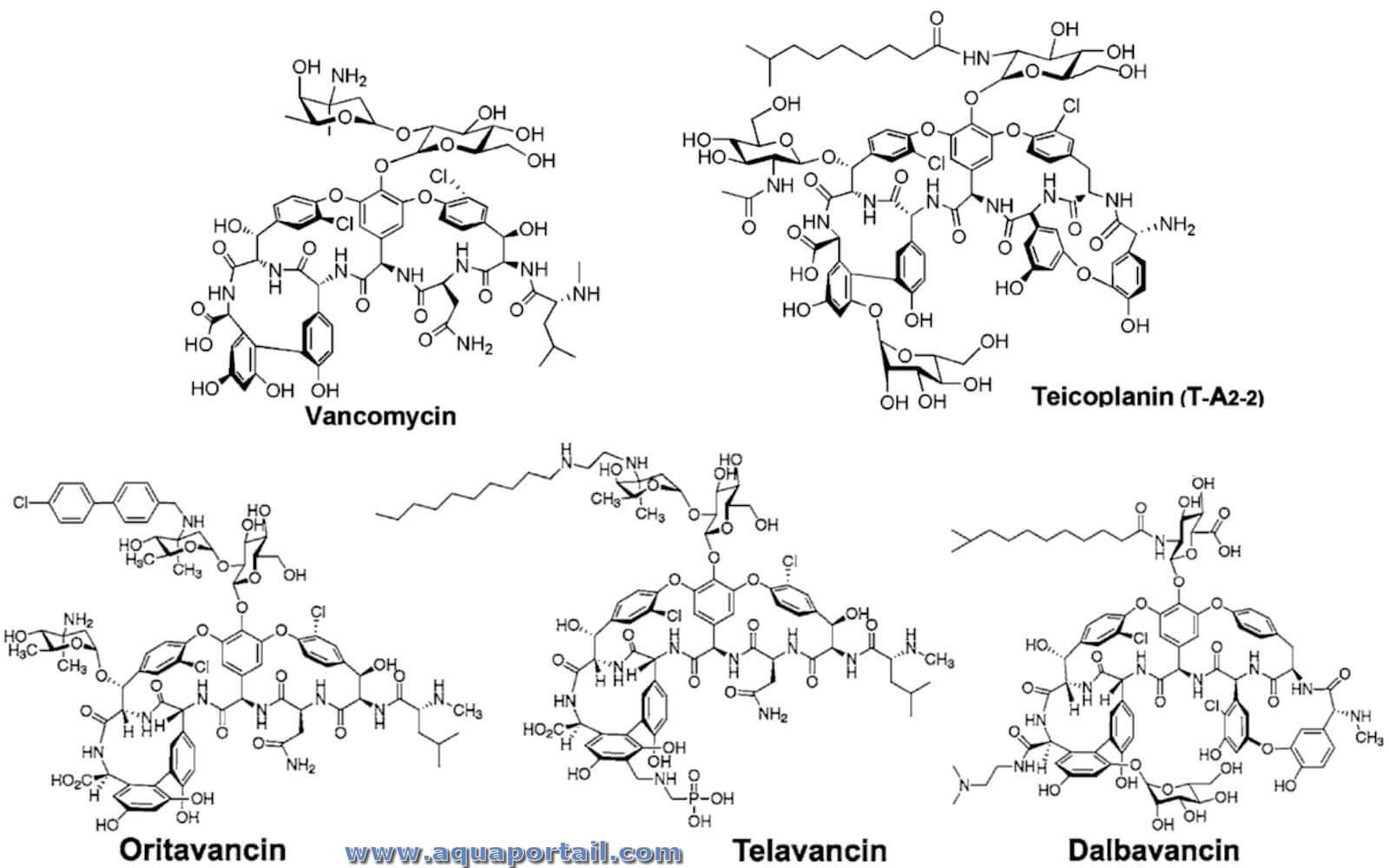
Un glycopeptide est un composé formé d'un peptide de glycoprotéine et d'une partie glucidique.
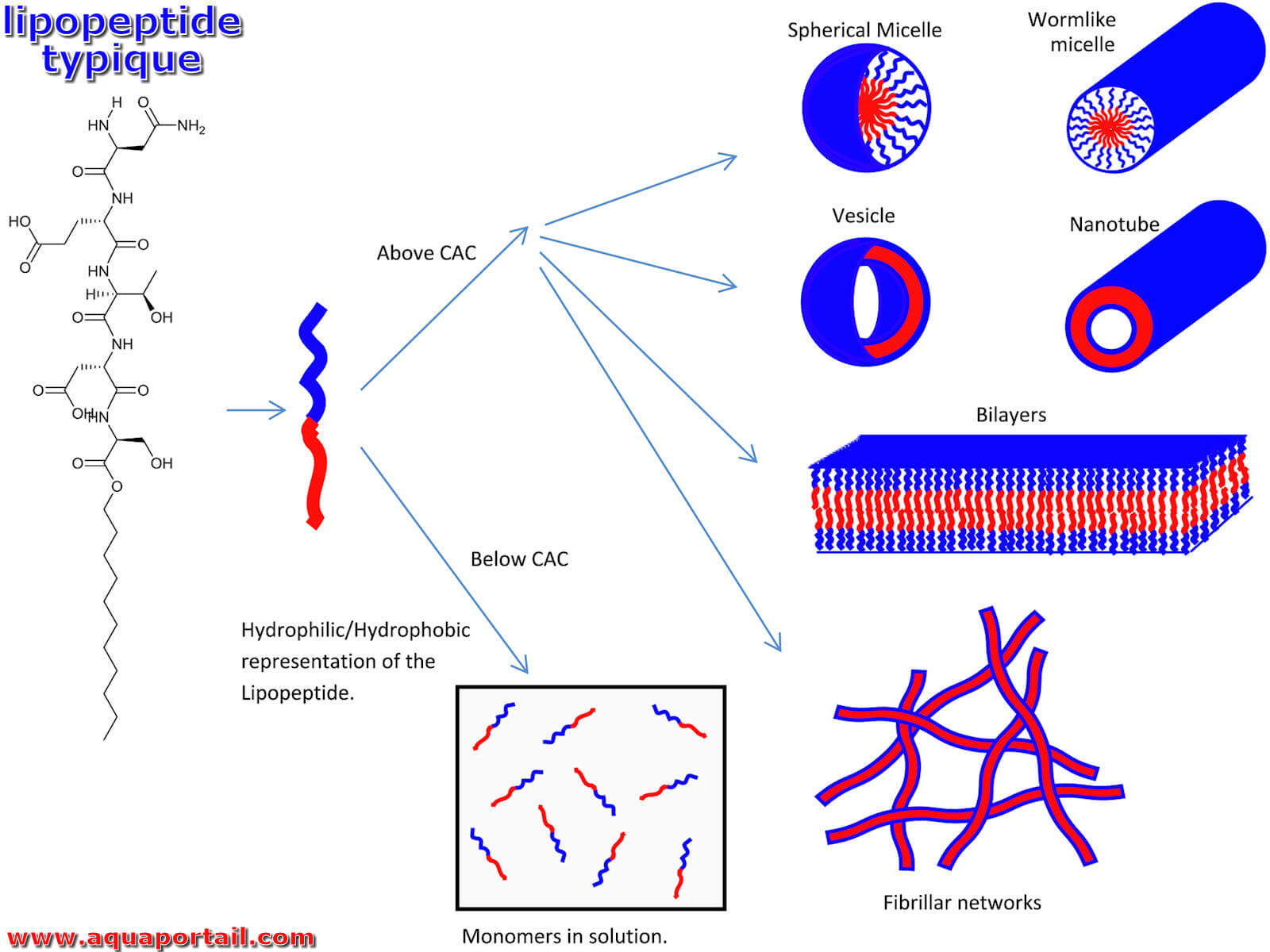
Un lipopeptide est une molécule constituée d'un lipide connecté à un peptide. Les lipopeptides sont typiques du monde bactérien, en étant capables...
