Carbonyle
Définition
Un carbonyle est un groupe fonctionnel organique avec un atome de carbone lié par une double liaison à un atome d'oxygène. Les aldéhydes, les cétones sont des groupes fonctionnels qui contiennent un carbonyle, tout comme les dérivés d'acide carboxylique.
Le groupe carbonyle est un groupe fonctionnel C=O, contenant un carbone hybride sp2 doublement lié à un oxygène. Le groupe carbonyle existe dans tout composé carbonylé.
Un composé carbonylé est une molécule contenant le groupe carbonyle. De nombreux composés aromatiques sont des composés carbonylés affectant l'odorat et le goût.
La structure d'un groupe carbonyle :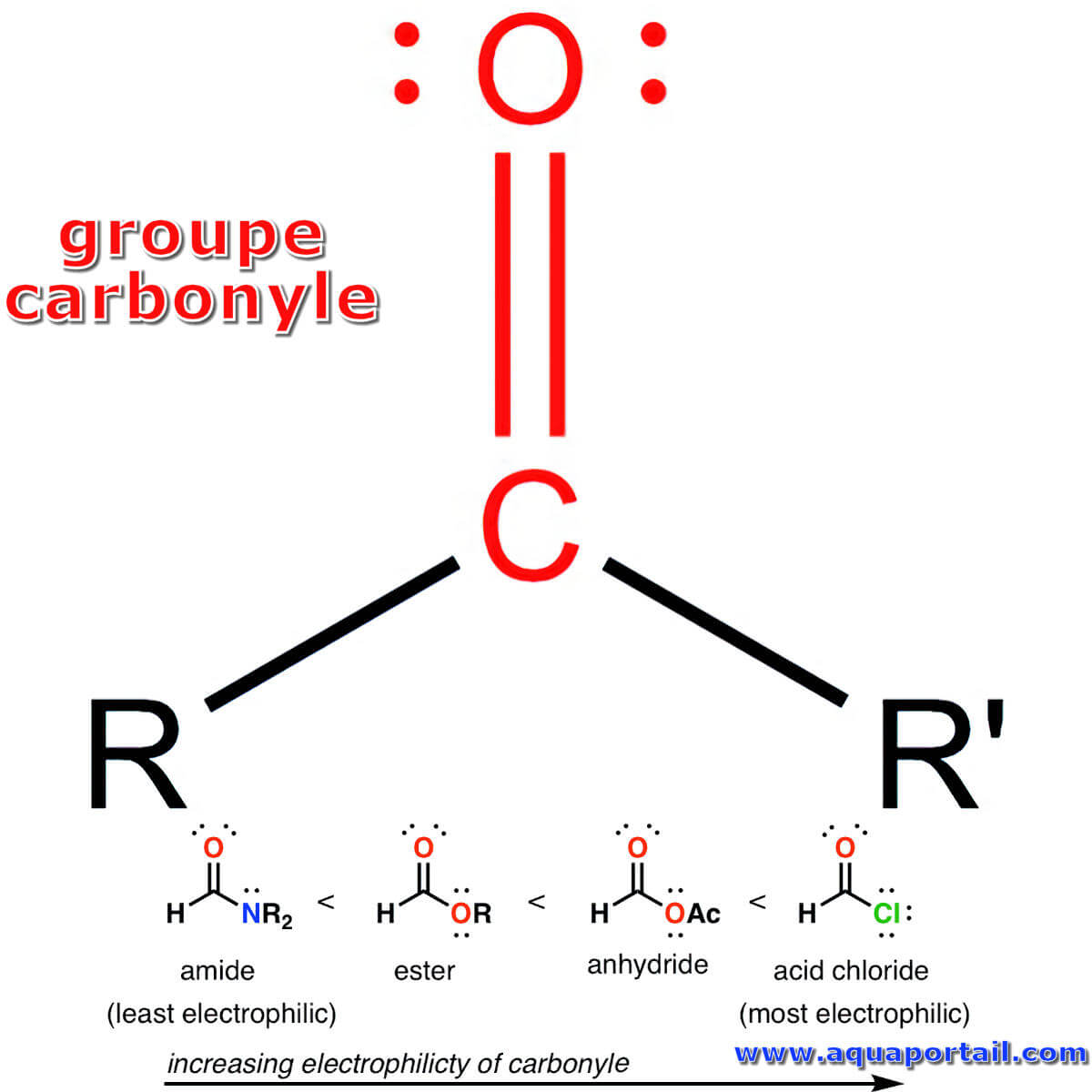
Le carbonyle est uniquement en rouge. Les deux autres liaisons issues du carbone (étiquettes R et R'dans ce cas), peuvent être n'importe quel atome. L'ensemble RCOR'forme un groupe carbonyle. L'angle d'attaque est d'environ 105 degrés, connu sous le nom de trajectoire de Burgi Dunitz.
Explications
De nombreux composés carbonylés présents dans les vins à la suite de plusieurs activités microbiennes différentes contribuent à la complexité aromatique globale.
Les composés carbonylés aliphatiques sont principalement constitués d'aldéhydes et de cétones. Il a été démontré qu'un grand nombre d'aldéhydes aliphatiques sont présents dans les boissons alcoolisées. Parmi les aldéhydes dosés quantitativement, l'acétaldéhyde est le composant majeur et constitue généralement plus de 90 % de la teneur totale en aldéhydes de la boisson. Pour cette raison, on pourrait s'attendre à ce que l'acétaldéhyde soit important pour l'arôme et soit souvent associé à une qualité améliorée.
Il a été démontré que l'acétaldéhyde (CH3COH) est un composé carbonylé abondant dans l'atmosphère qui est libéré par la combustion et la photooxydation des hydrocarbures.
L'oxydation des alcools en composés carbonylés correspondants est l'une des transformations les plus importantes de la synthèse organique. Les réactions catalytiques classiques conduisant à une telle oxydation mettent en jeu des métaux toxiques (Pd, Ir, Ru, Mo...) et des solvants et/ou oxydants dangereux. Certaines voies vertes ont été développées en utilisant des catalyseurs moins toxiques et/ou des solvants et oxydants plus respectueux de l'environnement.
Les principales sources de composés carbonylés sont la combustion incomplète de nombreuses substances organiques, bien que d'autres aldéhydes puissent également être produits par réaction de l'ozone avec des COV insaturés. Les composés carbonylés peuvent également être préparés par la réaction d'un réactif nucléophile tel qu'un organolithien ou réactif de Grignard avec le formamide (Bouveault) ou avec un orthoester.
Les composés carbonylés réagissent avec les composés phosphorés appelés ylures pour donner des alcènes. Cette réaction, découverte par Georg Wittig, s'appelle la réaction de Wittig. Elle fournit un moyen de synthétiser des alcènes à partir de composés carbonylés. Le terme ylure fait référence à une molécule dans laquelle une structure contribuant à un hybride de résonance a des charges positives et négatives sur les atomes liés, et les deux atomes ont un octet complet.
Chimie d'un carbonyle
Le carbone carbonyle est un excellent électrophile en raison de la polarisation de la liaison C=O vers l'oxygène hautement électronégatif. Il existe une corrélation directe entre le pKa et la capacité de groupe de départ. Plus la base est faible, meilleur est le groupe partant. Une base plus forte ne sera jamais déplacée d'un carbonyle par une base plus faible. L'hydroxyde est un groupe partant terrible dans des conditions basiques car l'acide carboxylique se déprotonera facilement pour donner O-. Le groupe partant devrait donc être O2-, qui, étant dibasique, est un très mauvais groupe partant.
Les groupes fonctionnels attracteurs d'électrons augmentent la réactivité des carbonyles adjacents avec les nucléophiles (c'est-à-dire les rendent plus électrophiles). Les donneurs de Pi diminuent la réactivité des carbonyles adjacents avec les nucléophiles (c'est-à-dire les rendent moins électrophiles).
Tout comme les aromatiques et les alcènes, les carbonyles peuvent accepter des électrons dans leur système Pi à partir d'atomes avec des paires isolées disponibles. Un électrophile plus riche en électrons est un électrophile moins riche. Comme pour la substitution aromatique électrophile, la capacité de don de pi a un impact beaucoup plus important que l'effet sigma-accepteur légèrement désactivant des groupes fonctionnels N et O électronégatifs. Les substituants du groupe A (Pi-donneurs) ralentissent l'attaque nucléophile au niveau du carbone carbonyle proportionnellement à leur capacité de donner. Les substituants du groupe B ont un effet intermédiaire, tandis que les substituants du groupe C activent fortement le carbone carbonyle vers l'attaque.
Les dérivés d'acide carboxylique protonent toujours sur le carbonyle en premier. Avec les amides, par exemple, il est tentant de protoner l'azote en premier, puisque c'est le groupe qui finira par partir. Cependant, le fait que la seule paire d'azote donne dans le carbonyle signifie que la forme de résonance de droite (avec le carbonyle anionique) est plus basique de Lewis. Une idée : protonez d'abord l'oxygène du carbonyle, puis ajoutez le nucléophile au carbone du carbonyle.
L'augmentation du volume stérique autour d'un carbonyle ralentit la réaction avec les nucléophiles. Plus le groupe est volumineux, plus la réaction sera lente. La raison en est que le nucléophile réagit avec le pi* du carbonyle et que le nuage d'électrons des groupes volumineux empêche l'attaque nucléophile. Une diminution similaire de la réactivité intervient en augmentant l'encombrement stérique autour de l'halogénure d'alkyle primaire dans une réaction SN2 (substitution nucléophile bimoléculaire).
Composés aldéhydiques
Les composés carbonylés contenant des groupes fonctionnels aldéhydiques sont omniprésents dans notre environnement en tant que composants de produits naturels et de produits de pollution. De plus, un certain nombre de composés chimiquement divers caractérisés par la présence du groupe aldéhyde apparaissent de manière endogène en tant qu'intermédiaires dans les voies métaboliques ou cataboliques et sont produits au cours de la biotransformation d'agents thérapeutiques.
Dans le contexte des aldéhydes générés de manière endogène, un spectre d'aldéhydes réactifs est produit à la suite de la peroxydation des lipides de la membrane cellulaire pendant les périodes de stress oxydatif prononcé. Il apparaît que ces aldéhydes diffèrent significativement par leur structure chimique, certains étant de structure cyclique, comme c'est le cas pour le 3,4-dihydroxyphénylacétaldéhyde qui est généré de manière endogène lors du catabolisme de la dopamine.
L'acétaldéhyde est un exemple d'aldéhyde aliphatique à chaîne courte produit de manière endogène lors de l'oxydation de l'éthanol, tandis que l'acroléine est un aldéhyde insaturé à trois carbones présent dans notre environnement ou produit de manière endogène en tant que produit de la peroxydation lipidique.
Le citral est un aldéhyde insaturé à chaîne ramifiée présent dans les plantes et le 4-hydroxynonénal (4-HNE) est représentatif des alcénals insaturés hydroxylés à longue chaîne produits de manière endogène à la suite de la peroxydation des lipides cellulaires.
Il est à noter que tous ces composés présentent une réactivité chimique importante due au groupement carbonyle et, dans certains cas, la présence d'une configuration à double liaison conjuguée qui augmente significativement l'électrophilie et la réactivité de la molécule.
Réactions du groupe carbonyle
La fonction carbonyle peut subir de nombreuses réactions. Généralement, les réactifs nucléophiles sont attirés par l'atome de carbone. Les réactifs électrophiles sont attirés par l'atome d'oxygène.
Souvent, les acides réagissent avec l'atome d'oxygène du carbonyle pour stabiliser la charge négative partielle qui y est présente.
Lorsqu'un nucléophile réagit avec le carbone dans le groupe fonctionnel carbonyle, il n'y a souvent pas de groupe partant. Au lieu de cela, les électrons de la double liaison (liaison pi) poussent jusqu'à l'atome d'oxygène. C'est ce qu'on appelle une réaction d'addition nucléophile.
Les réactions exactes qui interviennent dépendront des autres groupes R attachés au carbone carbonyle. Plus le groupe R est grand, plus l'encombrement stérique ralentira ou empêchera une réaction. Par exemple, il y a plus d'encombrement stérique dans une cétone que dans un aldéhyde.
Le groupe R présent affectera également la polarité de la liaison. La polarité influencera également la réactivité de la molécule.
De nombreuses réactions nommées impliquent un groupe carbonyle. En voici quelques-unes :
- Réaction Aldol : la réaction Aldol crée des liaisons carbone-carbone;
- réaction de Grignard : forme un alcool secondaire ou tertiaire à partir d'une réaction avec une cétone ou un aldéhyde;
- Couplage Nozaki-Hiyama : couple un aldéhyde à un composé contenant un halogénure. Les sels de chrome catalysent la réaction;
- Réaction de Wittig : un aldéhyde ou une cétone réagit avec un ylure pour former un alcène.
Catalyseurs biphasiques
Les composés carbonylés, en tant que substrat ou produit dans les réactions d'aldol, sont solubles dans les solvants organiques conventionnels tels que le DMSO, le DMF et le CHCl3. La (S)-proline est presque insoluble dans ces solvants, alors qu'elle est soluble dans les liquides ioniques. Les catalyseurs biphasiques tirent parti de ces caractéristiques de solubilité. Ainsi, après la fin d'une réaction dans un liquide ionique, le produit peut être extrait à l'aide d'un solvant non miscible contre le liquide ionique.
Composé carbonylé ferrique
Les composés de fer carbonyle (composés carbonylés ferriques) continuent d'être un domaine largement étudié de la chimie organométallique. Les composés carbonylés simples sont des réactifs peu coûteux et polyvalents. La chimie des composés carbonylés du fer publiés entre 1983 et 1993 indique que les molécules ne contiennent pas de ligands hydrocarbonés.
Certaines transformations stoechiométriques et catalytiques de molécules organiques dans lesquelles la nature du composé de fer n'est pas connue sont peu développées. Un fer carbonyle ne contenant pas d'hydrocarbure réagit avec un substrat organique pour donner un composé de fer carbonyle ne contenant pas d'hydrocarbure.
Synonymes, antonymes
Voir tous les synonymes pour "carbonyle".2 synonymes (sens proche) de "carbonyle" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CARBONYLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CARBONYLE est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
carbone organique dissous carbone organique total carbonifère carbonisation carbonylation carbonylecarboxamide carboxyhémoglobine carboxylase carboxylation carboxyle
En rapport avec "carbonyle"

L'a-actinine, ou alpha-actinine (α-actinine), est une protéine fibrillaire qui permet à l'actine de se lier aux stries Z des sarcomères des fibres musculaires...

Le système A-number est l'équivalent des systèmes L-number et C-number destinés à apporter une classification numérique aux cichlidés nains de la sous-famille...

L'Aalénien est le premier étage de l'échelle stratigraphique du Jurassique moyen de l'ère Mésozoïque.

L'abaca est une fibre foliaire, composée de longues cellules minces qui font partie de la structure de support de la feuille.
