Acide carboxylique
Définition
Les acides carboxyliques sont des composés organiques qui portent un ou plusieurs groupes carboxyles (−COOH) et présentent donc un caractère acide plus ou moins prononcé. Les sels d'acides carboxyliques sont appelés carboxylates
Les composés dans lesquels le groupe OH du groupe carboxyle par un autre groupe, pour −OR, −NH2 ou −Cl, sont appelés dérivés d'acide carboxylique.
L'acide carboxylique :
La structure générale des acides carboxyliques à fonction carboxyle marquée en bleu (monocarboxylique). Le radical R représente soit un atome d'hydrogène, soit un groupe organyle.
Explications
Les dérivés d'acide carboxylique comprennent également les trois exemples mentionnés : les esters d'acide carboxylique, les amides d'acide carboxylique et les halogénures d'acide carboxylique.
Nomenclature
Pour la désignation systématique des acides carboxyliques, le mot composant "-acide" est ajouté au nom du squelette de base. De nombreux acides carboxyliques portent également des noms non systématiques (noms triviaux), qui se terminent également par "acide".
Des exemples de désignations d'acides carboxyliques ayant le squelette d'un alcane sont l'acide méthanoïque (acide formique), l'acide éthanoïque (acide acétique) et l'acide butyrique (acide butyrique). Le nom trivial caractérise l'acide carboxylique respectif principalement après un événement typique.
Classification
Selon la structure chimique du radical R auquel est lié le groupe -COOH, on distingue les acides carboxyliques aliphatiques, aromatiques et hétérocycliques. Les acides carboxyliques aliphatiques peuvent être subdivisés en acides alcanoïques, acides alcénoïques et acides alcanoïques.
Les acides alcanoïques sont également appelés acides carboxyliques saturés. Les acides alcénoïques, c'est-à-dire les acides carboxyliques ayant au moins une double liaison dans le radical (par exemple l'acide acrylique) et les acides alcyniques ayant au moins une triple liaison dans le radical, sont appelés acides carboxyliques insaturés.
De plus, les acides carboxyliques peuvent être différenciés en fonction du nombre de groupes carboxy présents. Les acides monocarboxyliques ont un groupe carboxy, alors que les acides dicarboxyliques (par exemple l'acide oxalique) et les acides tricarboxyliques (par exemple l'acide citrique) contiennent trois groupes carboxy.
De plus, il existe des groupes d'acides carboxyliques qui, en plus du groupe carboxyle, portent d'autres groupes fonctionnels, tels que les acides cétocarboxyliques, les acides hydroxycarboxyliques (par exemple l'acide lactique) et les acides aminés (en réalité : les acides aminocarboxyliques).
Du point de vue de la structure chimique, les acides gras ne constituent pas un groupe particulier d'acides carboxyliques, car ils sont généralement des acides monocarboxyliques aliphatiques, saturés ou insaturés, généralement non ramifiés, souvent entre 12 et 22, parfois avec seulement 4, comme dans le beurre. atomes de carbone. Ils y sont estérifiés avec du glycérol, appelé triglycérides, dans les graisses animales et végétales (voir, par exemple, les matières grasses du lait).
Des découvertes récentes ont montré que les lipides lipidiques des membranes cellulaires et des acides carboxyliques à chaîne plus courte et ramifiée permettent de résumer tous les acides carboxyliques contenant des groupes organyle (en forme de chaîne).
Un autre groupe d'acides carboxyliques désignés après l'événement est constitué par les acides résiniques présents dans les résines naturelles.
Du point de vue de la structure chimique, le "acide métalcarboniqe" n'appartient pas au groupe des acides carboxyliques. Par exemple, des complexes métalliques avec des ligands carboxyles sont utilisés comme intermédiaires dans des réactions (catalysées) avec du monoxyde de carbone (CO) et du dioxyde de carbone (CO2), telles que dans la réaction de décalage gaz-eau.
Caractéristiques
Les propriétés chimiques des acides carboxyliques sans groupes fonctionnels supplémentaires dans la chaîne alkyle sont déterminées uniquement par le groupe carboxyle. L'atome d'oxygène du groupe carbonyle (C=O) a un effet attracteur d'électrons relativement important, de sorte que la liaison entre l'hydrogène et l'atome d'oxygène du groupe hydroxyle est fortement polarisée. Ceci favorise la libération des ions H+ du groupe carboxyle.
De plus, le caractère acide des acides carboxyliques est une conséquence de la stabilisation mésomère de l'anion carboxylate. Il favorise la forme déprotonée de l'acide carboxylique et donc la stabilité de l'anion. Semblable à la stabilisation du benzène par mésomérie, l'électron délocalisé est souvent indiqué par la notation suivante (dans l'exemple, R représente le groupe méthyle CH3).
Les propriétés physiques des acides carboxyliques (force de l'acide, point d'ébullition ou point de fusion, solubilité dans l'eau) sont essentiellement déterminées par la nature de la chaîne alkyle et des substituants éventuels présents dans le groupe alkyle.
L'acidité d'un acide carboxylique est d'autant plus prononcée que la chaîne alkyle est courte. Un substituant supplémentaire présent sur l'atome alpha-C avec un effet inducteur attirant les électrons (effet -I) augmente considérablement la force de l'acide. Le groupe carboxyle reçoit une charge partielle plus positive, ce qui peut mieux équilibrer la charge négative de l'anion et ainsi stabiliser l'anion.
Un exemple de ceci est le trichloroacétate plus stable par rapport à l'acétate. Une mesure de l'acidité d'un acide carboxylique est la constante d'acide ou la valeur de pKs.
Les acides carboxyliques à chaîne courte avec jusqu'à six atomes de carbone sont des liquides incolores, piquants (acide formique) ou désagréables (acide butyrique) avec des points d'ébullition relativement élevés. Les acides carboxyliques ont un caractère polaire à travers le groupe carboxyle, ce qui entraîne une bonne solubilité dans l'eau, qui diminue avec l'augmentation de la longueur de la chaîne alkyle.
L'arrangement spatial bien possible de deux groupes carboxyle favorise la formation de liaisons hydrogène intermoléculaires et conduit ainsi à un acide carboxylique dimère. La double masse des particules dans l'espace vapeur au-dessus du liquide peut expliquer les points d'ébullition relativement élevés des acides carboxyliques.
Au fur et à mesure que la longueur de la chaîne augmente, le caractère lipophile des acides carboxyliques augmente et le caractère hydrophile diminue. Ceci s'applique également aux sels d'acides carboxyliques.
Cependant, en plus de la chaîne alkyle lipophile, avec éventuellement plus de six atomes de carbone, les sels ont également un groupe hydrophile dans la même molécule que le groupe carboxylate. Les sels de sodium et de potassium des acides carboxyliques à longue chaîne sont donc des substances amphiphiles. Ils ont les propriétés des tensioactifs et sont utilisés comme savons et graisses de base.
Synonymes, antonymes
Voir tous les synonymes pour "acide carboxylique".0 synonyme (sens proche) pour "acide carboxylique".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACIDE CARBOXYLIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE CARBOXYLIQUE est dans la page 1 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide biliaire acide borique acide butanedioïque acide butyrique acide carbonique acide carboxyliqueacide cérébronique acide chlorhydrique acide cholique acide chromique acide citrique
En rapport avec "acide carboxylique"
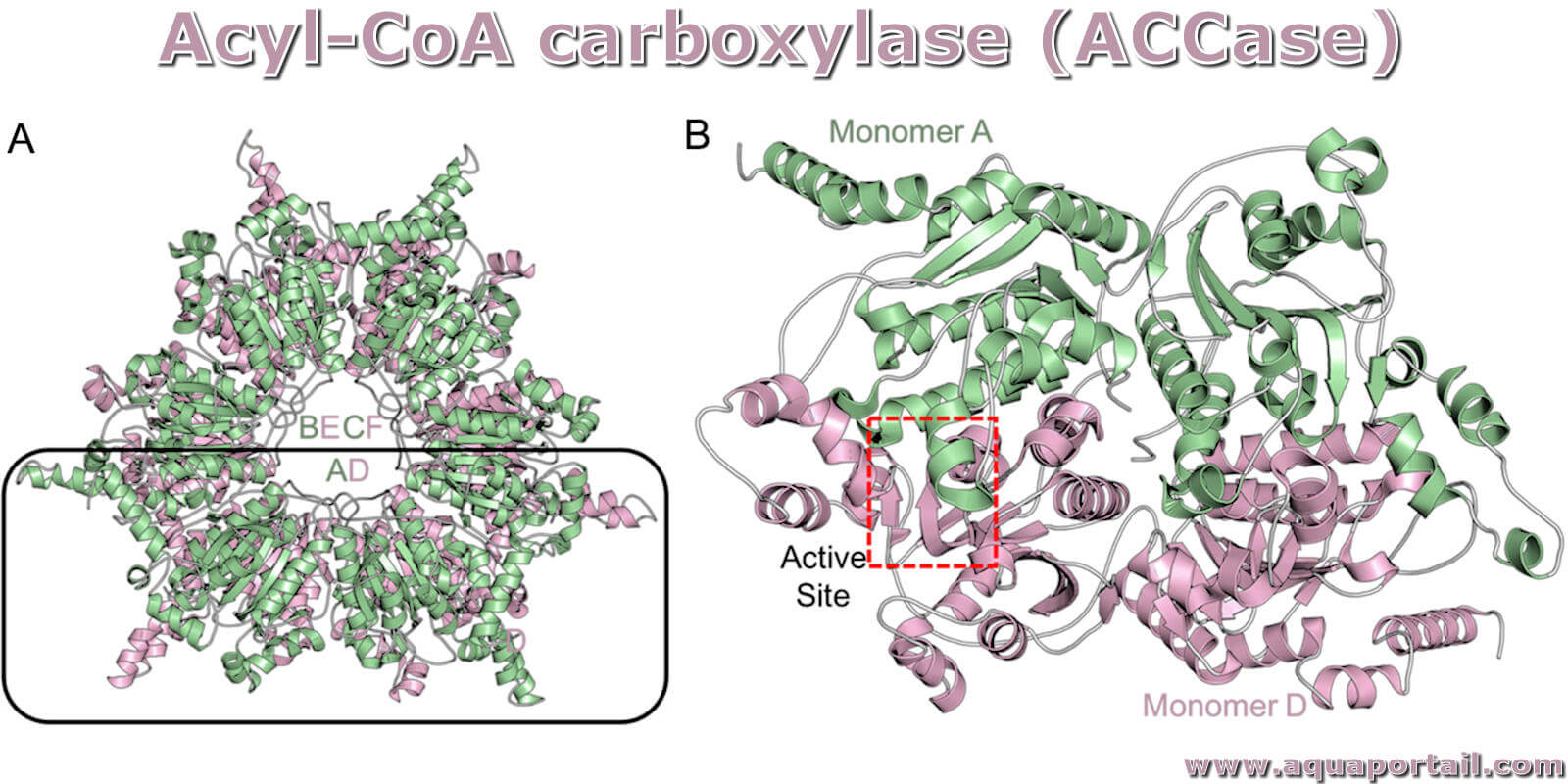
Une carboxylase est une enzyme qui catalyse la fixation du CO₂, un acide, sur un composé organique par carboxylation.
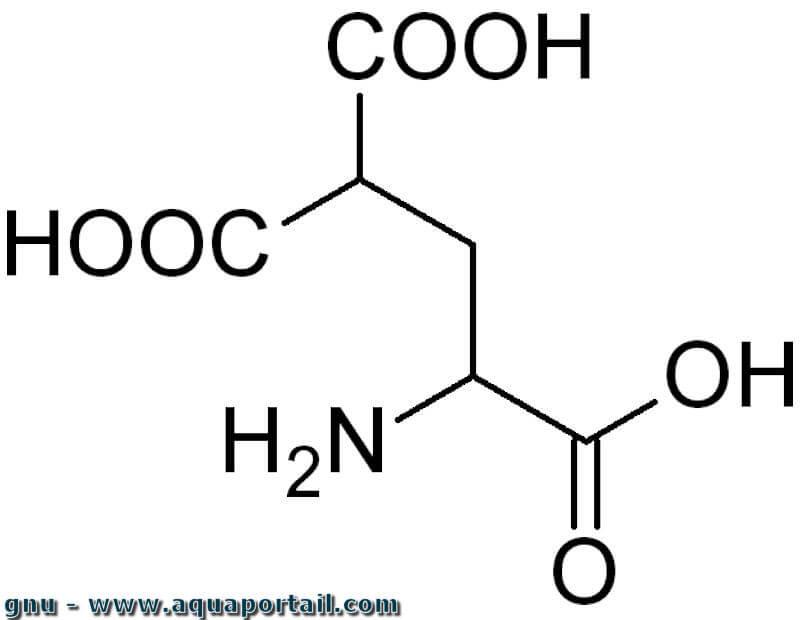
La carboxylation en chimie est une réaction chimique dans laquelle un groupe acide carboxylique est introduit dans un substrat.
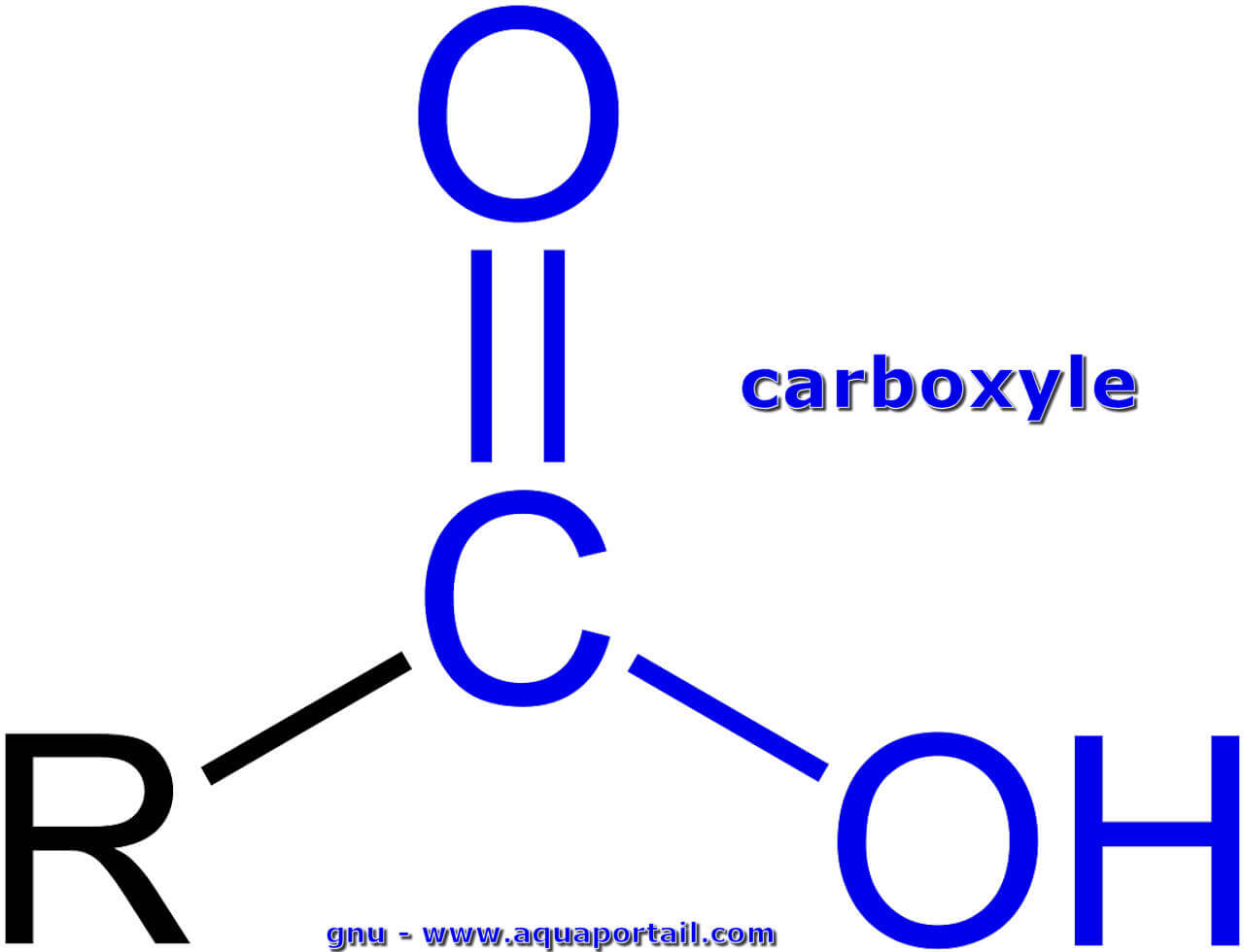
Le groupe carboxyle est le groupe fonctionnel -COOH des acides carboxyliques. Un carboxyle dérive formellement de la combinaison des deux éléments groupe...

Une décarboxylase est une enzyme qui catalyse une réaction de décarboxylation, c'est-à-dire le détachement d'une molécule de CO₂ qui conduit à l'élimination...
