Liaison triple
Définition
Une liaison triple correspond au partage de trois paires d'électrons, soit un total de six électrons. Les atomes se combinent afin de compléter leur couche de valence, également appelée couche électronique externe, dans le but d'atteindre un état de stabilité chimique. Ce type de liaison est formé par une forte attraction électrostatique entre les électrons participant à la liaison et les noyaux des deux atomes impliqués. Les liaisons triples sont particulièrement fréquentes dans les alcynes.
Principes de liaison triple :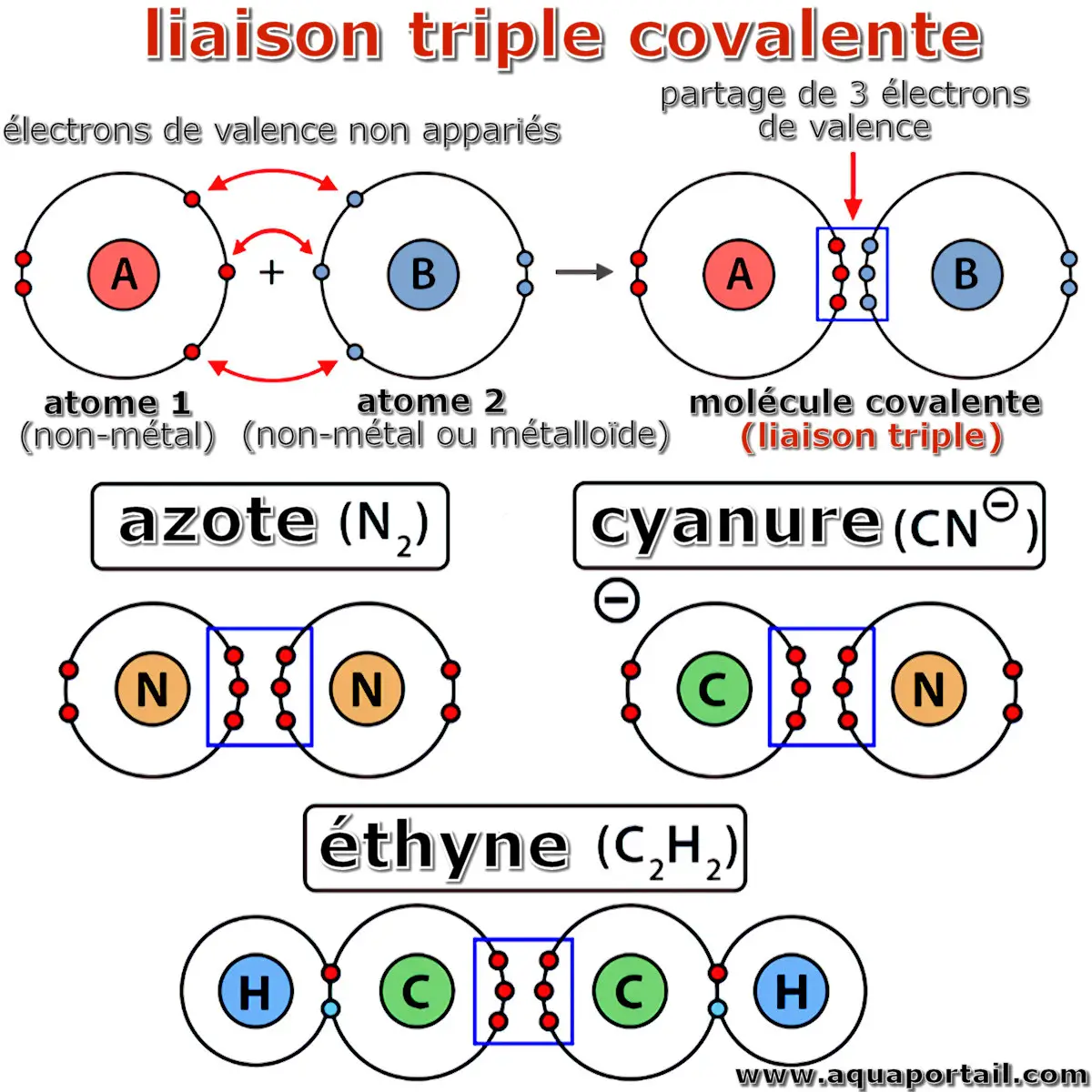
Une liaison triple covalente naît entre deux non-métaux ou un non-métal et un métalloïde. La liaison est de faible longueur, constituée de trois paires d'électrons (soit 6 e-). Ce type de liaison covalente reste instable mais est plus robuste qu'une liaison simple ou double.
Explications
Une liaison covalente représente un type de liaison chimique où les atomes d'une molécule partagent des électrons. Une liaison covalente triple se caractérise par le partage de six électrons provenant d'électrons de valence initialement non appariés.
Quelques exemples de liaisons triples sont l'azote (N2), le cyanure (CN-) et l'éthyne (C2H2).
Exemples
La molécule de diazote (N2) constitue un exemple typique d'une liaison covalente triple. Cette molécule est composée de deux atomes d'azote (N). Chaque atome d'azote dispose de cinq électrons sur sa couche externe et nécessite trois électrons supplémentaires pour compléter son octet. Ainsi, trois électrons de chaque atome d'azote sont partagés, ce qui conduit à une liaison covalente triple impliquant six électrons. Cette configuration confère à la molécule une grande stabilité.
L'anion cyanure (CN-) est une autre entité chimique présentant une liaison covalente triple. Cet anion comporte un atome de carbone (C) et un atome d'azote (N). Le carbone possède quatre électrons dans sa couche externe et a besoin de quatre électrons supplémentaires pour compléter son octet, tandis que l'azote en possède cinq et en requiert trois supplémentaires pour atteindre la stabilité. Pour satisfaire ces exigences, les deux atomes partagent trois électrons chacun, formant ainsi une liaison covalente triple impliquant six électrons partagés. La présence d'un électron excédentaire sur le carbone confère à cet ensemble son caractère anionique.
L'éthyne (C2H2) fournit un exemple concret parmi les alcynes, contenant deux atomes de carbone (C) et deux atomes d'hydrogène (H). Chaque atome de carbone possède quatre électrons sur sa couche externe et nécessite quatre électrons supplémentaires pour achever son octet, tandis que chaque hydrogène dispose d'un seul électron et a besoin d'un autre pour compléter son orbite. Chaque atome d'hydrogène forme une liaison simple avec un atome de carbone. Une fois ces liaisons C-H établies, les deux atomes de carbone conservent encore trois électrons non appariés chacun. Ils partagent alors ces électrons entre eux, générant une triple liaison covalente entre eux, composée ainsi de six électrons partagés. Cette configuration confère à l'éthyne sa structure caractéristiques des alcynes.
Synonymes, antonymes
Voir tous les synonymes pour "liaison triple".3 synonymes (sens proche) de "liaison triple" :
2 antonymes (sens contraire) :
Les mots ou les expressions apparentés à LIAISON TRIPLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression LIAISON TRIPLE est dans la page 2 des mots en L du lexique du dictionnaire.
Mots en L à proximité
liaison génétique liaison génomique liaison ionique liaison peptidique liaison simple liaison tripleliane liant liber liche lichen
En rapport avec "liaison triple"

Une liaison chimique est une attraction entre deux ou plusieurs atomes ou ions qui forment un composé chimique.
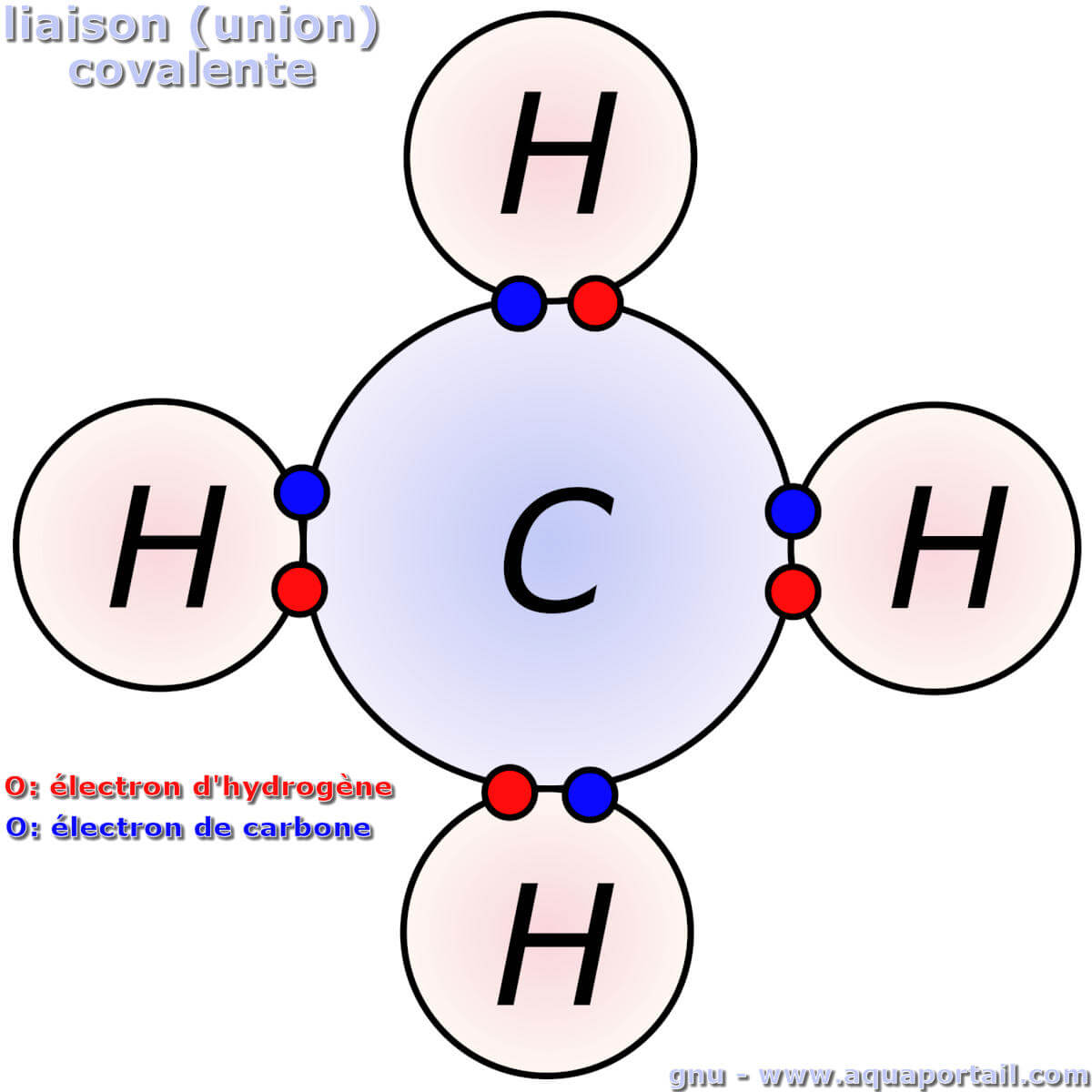
Une liaison covalente est l'union de deux atomes non métalliques par le partage d'électrons dans une molécule.
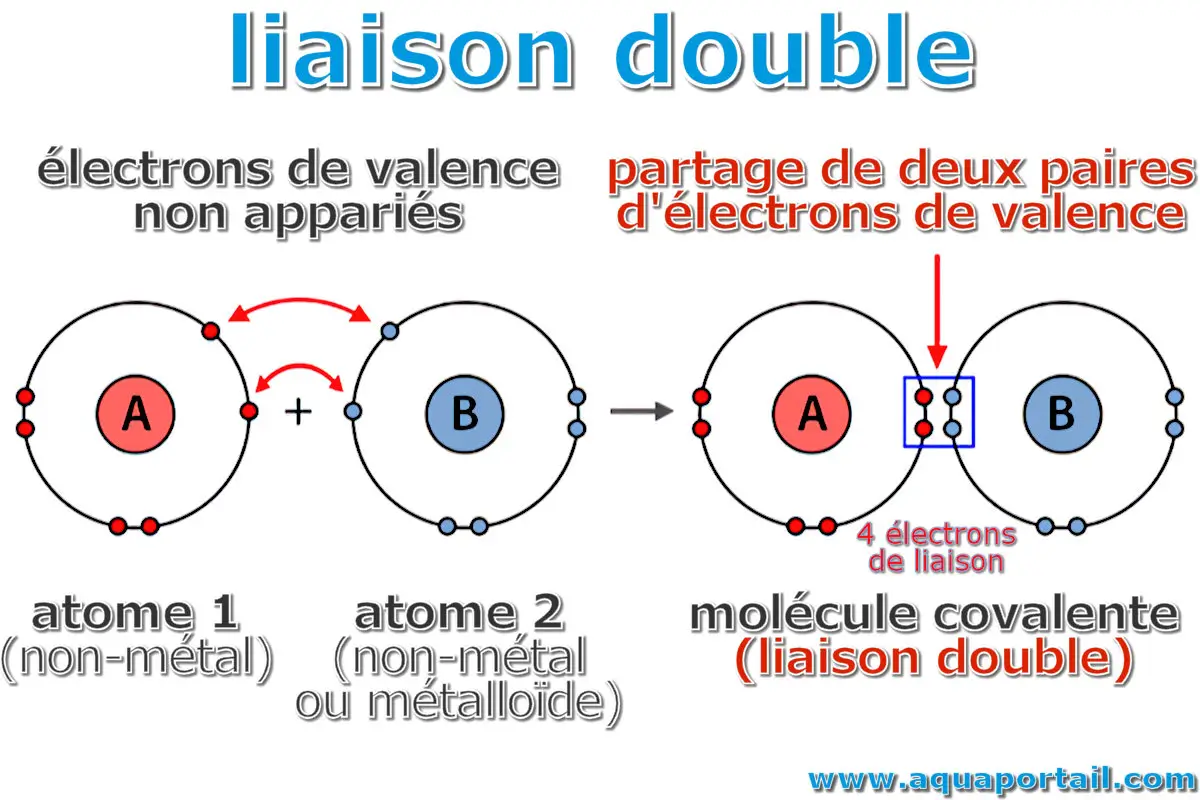
Une liaison double est une liaison chimique dans laquelle deux paires d'électrons sont partagées entre deux atomes d'une molécule covalente.

La liaison simple est la liaison ionique la plus simple avec des éléments métalliques et non métalliques dans la substance.
