Liaison covalente
Définition
Une liaison covalente est l'union de deux atomes non métalliques par le partage d'électrons dans une molécule. Cette liaison chimique forme des paires d'électrons communes et partagées par les deux atomes.
La liaison covalente du méthane CH4 :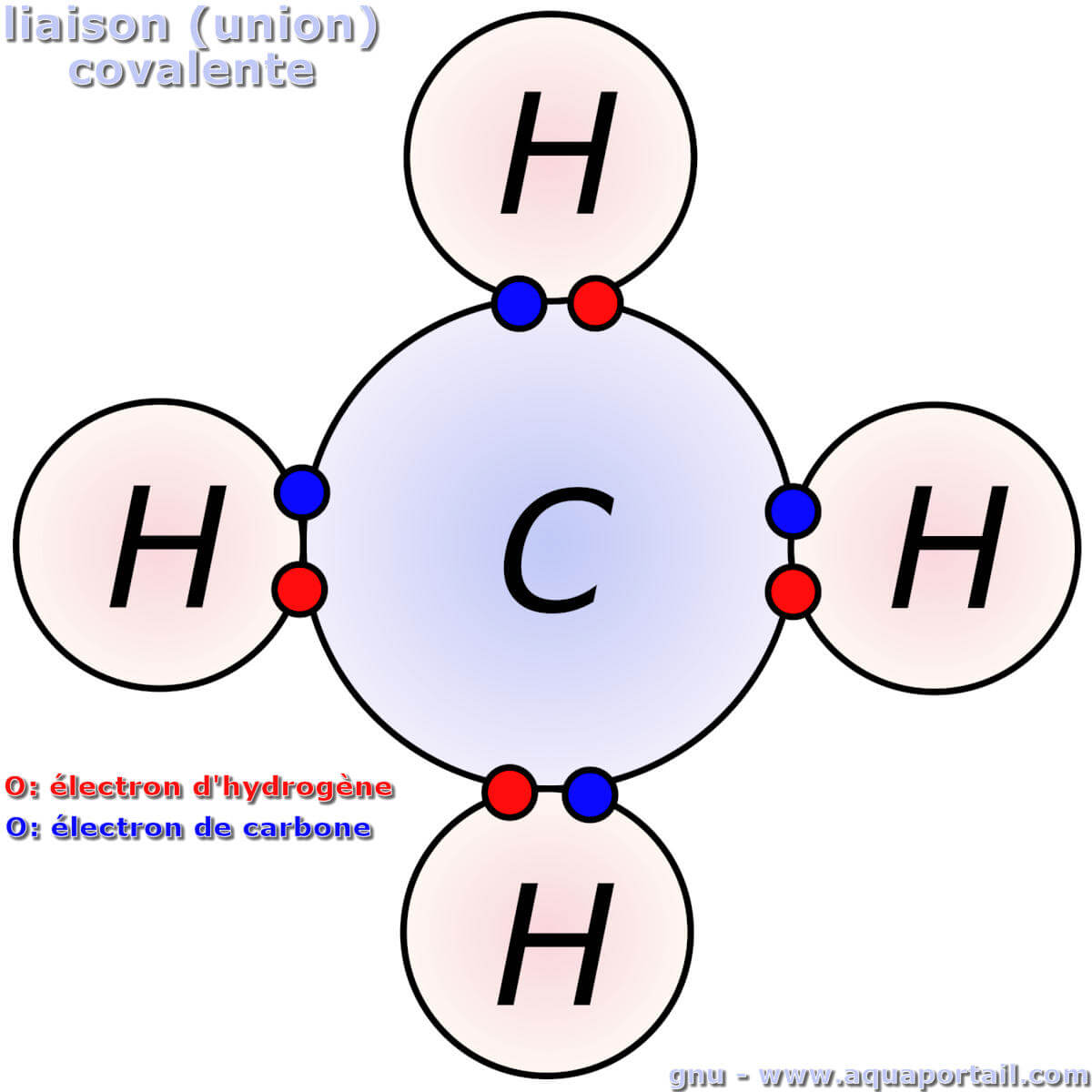
La liaison covalente est implicite dans la structure de Lewis, indiquant les électrons partagés entre les atomes. Les premiers concepts d'union covalente sont issus de ce type d'image des molécules de carbone et d'hydrogène.
Explications
Les liaisons covalentes sont le mode de liaison chimique le plus important en chimie organique. Leur formation résulte du partage d'électrons par des atomes. Les atomes se lient en covalence à d'autres atomes afin d'obtenir une plus grande stabilité.
Il existe principalement deux formes de liaisons auxquelles un atome peut participer : la liaison covalente et la liaison ionique. La liaison covalente implique le partage d'électrons entre deux ou plusieurs atomes. Les liaisons ioniques se forment lorsque deux ou plusieurs ions s'unissent et sont maintenus ensemble par des différences de charge.
La liaison est obligatoirement du type ionique avec les atomes métalliques.
La liaison covalente polaire donnant de l'eau :
L'eau H2O est formée grâce à une liaison covalente polaire entre un atome d'oxygène et deux atomes d'hydrogène. La formulation de la structure de Lewis est respectée.
Les liaisons covalentes impliquent le partage d'électrons entre atomes. Elles sont classées en liaisons covalentes apolaires et polaires selon leurs différences d'électronégativité. Les liaisons covalentes apolaires présentent un partage égal en raison d'électronégativités similaires, tandis que les liaisons covalentes polaires présentent un partage inégal, ce qui entraîne des charges partielles.
Par exemple, dans l'eau (H₂O), la forte électronégativité de l'oxygène entraîne une charge partielle négative, tandis que les atomes d'hydrogène acquièrent des charges partielles positives. La compréhension de ces concepts est essentielle pour comprendre les interactions et les propriétés moléculaires en chimie.
Liaisons covalentes du cyanure d'hydrogène :
Le cyanure d'hydrogène contient une liaison simple entre H et C et une liaison triple entre C et N.
lire plus de détails pour la liaison covalente...
Synonymes, antonymes
Voir tous les synonymes pour "liaison covalente".7 synonymes (sens proche) de "liaison covalente" :
- liaison atomique
- liaison chimique
- liaison double
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à LIAISON COVALENTE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression LIAISON COVALENTE est dans la page 2 des mots en L du lexique du dictionnaire.
Mots en L à proximité
levure de boulanger lézard liaison aromatique liaison aux protéines liaison chimique liaison covalenteliaison de van der Waals liaison disulfure liaison double liaison génétique liaison génomique
En rapport avec "liaison covalente"

Une liaison chimique est une attraction entre deux ou plusieurs atomes ou ions qui forment un composé chimique.
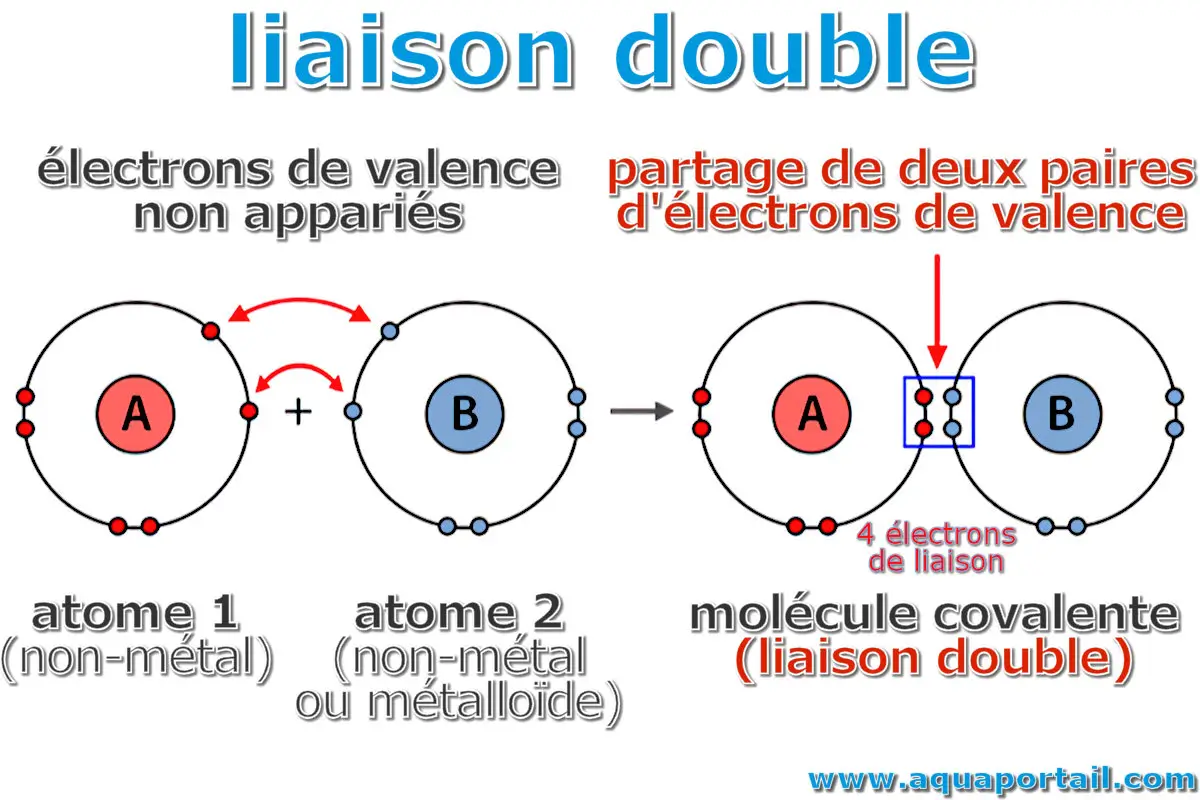
Une liaison double est une liaison chimique dans laquelle deux paires d'électrons sont partagées entre deux atomes d'une molécule covalente.

La liaison simple est la liaison ionique la plus simple avec des éléments métalliques et non métalliques dans la substance.

La structure de Lewis est une représentation simplifiée des électrons de la couche de valence impliqués dans les liaisons chimiques.
