Électronégativité
Définition
L'électronégativité est une mesure de la capacité d'un atome à attirer des électrons vers lui dans une liaison covalente. Elle est le pouvoir d'un atome, lorsqu'il est dans une molécule, d'attirer des électrons vers lui-même. La valeur électronégative est une mesure de la tendance d'un atome, qui forme une liaison chimique avec un autre atome, à attirer le nuage d'électrons collectif vers lui.
L'électronégativité dans une table périodique :
Les électronégativités de tous les éléments chimiques dans le tableau périodique. Les couleurs les plus foncées indiquent les valeurs les plus électronégatives. Dans la représentation de Linus Pauling, le francium et le césium (en bas à gauche) ont la valeur électronégative la plus faible, le fluor (en haut à droite) la plus élevée.
Explications
L'électronégativité dépendra d'un certain nombre de facteurs, notamment d'autres atomes de la molécule, du nombre d'atomes qui lui sont coordonnés et du nombre d'oxydation de l'atome. Il existe plusieurs façons de produire un ensemble de nombres qui représentent des échelles d'électronégativité. L'échelle de Pauling est peut-être la plus célèbre.
Les éléments du tableau périodique sont classés en fonction de leurs configurations électroniques. Pour cette raison, l'emplacement d'un élément dans le tableau périodique peut vous renseigner sur ses propriétés chimiques. Les éléments du même groupe (colonne) ont le même nombre d'électrons externes, tandis que les éléments de la même période (ligne) ont le même nombre de couches d'électrons.
Le numéro atomique est le nombre de protons dans le noyau d'un atome. Une liaison ionique est une liaison entre deux atomes de charges opposées, où aucun électron n'est partagé. Les liaisons covalentes impliquent une paire d'électrons, partagés entre deux atomes.
Selon Linus Pauling (et d'autres Allen, Alfred-Rochow) Mulliken-Jaffe et Sanderson), le fluor a l'électronégativité la plus élevée, tandis que le francium a l'électronégativité la plus faible.
Les facteurs qui affectent l'électronégativité sont : la charge nucléaire, le rayon atomique et le blindage (nombre de couches d'électrons). Ces trois facteurs ont un impact significatif sur la valeur d'électronégativité d'un élément.
Calcul de différence d'électronégativité
Afin de déterminer le type de liaison d'un composé, vous soustrayez les électronégativités des éléments liés. Des valeurs de différence d'électronégativité supérieures à 2,0 indiquent une liaison ionique. Les valeurs comprises entre 0,5 et 1,6 sont considérées comme des liaisons covalentes polaires. Les valeurs comprises entre 0,0 et 0,5 sont considérées comme des liaisons covalentes non polaires.
Principe
Dans les liaisons covalentes, les électrons partagés sont attirés vers l'un des atomes plus que vers l'autre. Nous utilisons le terme électronégativité pour décrire la capacité d'un atome à attirer ces électrons vers lui. L'électronégativité est influencée par le nombre de protons dans le noyau (numéro atomique) et le nombre d'électrons de valence.
Plus le nombre de protons est élevé, plus la charge positive du noyau est élevée et plus l'atome a la capacité d'attirer les électrons partagés. Cependant, cela est contrecarré par l'effet de blindage des couches d'électrons. Plus le nombre de couches d'électrons est grand et plus elles sont éloignées du noyau, moins la force d'attraction sera entre le noyau et les électrons dans la liaison covalente.
Selon Linus Pauling
L'électronégativité a été mesurée et développée pour la première fois par Linus Pauling en 1932. Il a créé l'échelle de Pauling, donnant à chaque élément une valeur qui correspond à sa capacité à attirer les électrons. Les éléments vont en valeur de 0,7 (césium et francium), le moins électronégatif, à 4,0 (fluor), le plus électronégatif.
Ce nombre est étroitement lié au numéro atomique et au rayon. Par exemple, le potassium a une valeur sur l'échelle de Pauling de 0,8, ce qui indique une électronégativité plutôt faible. Le potassium a 19 protons dans son noyau, mais il a également 4 couches d'électrons, ce qui signifie qu'il y a un grand nombre d'électrons entre le noyau et les électrons les plus externes.
Modèles et tendances sur le tableau périodique
En général, l'électronégativité augmente sur une période car le nombre de protons augmente alors que le nombre de couches électroniques reste le même. Cela signifie qu'il y a une plus grande charge qui attire les électrons partagés. D'autre part, à mesure que vous progressez dans un groupe, l'électronégativité diminue, car le nombre de couches d'électrons augmente, contrecarrant l'effet de tout nombre accru de protons.
Le gallium et le germanium font toutefois exception à cette règle. Ces éléments ont des électronégativités plus élevées que l'aluminium et le silicium, même si l'aluminium et le silicium sont supérieurs au gallium dans le germanium dans leurs groupes respectifs. En effet, le bloc D des métaux de transition a de petits rayons atomiques et leur enveloppe 3D n'est pas aussi efficace pour protéger la charge nucléaire.
Selon le type de liaison
L'électronégativité a un lien étroit avec le type de liaison que forment deux éléments. Cela donne lieu au continuum de liaison. Si les deux éléments d'une liaison ont une différence d'électronégativité de 2,0 ou plus, ils sont considérés comme ayant une liaison ionique car l'un des éléments de la liaison a une charge nucléaire suffisante pour attirer complètement les électrons dans la liaison, créant un ion positif et négatif. Un exemple courant de ce type de liaison est le sodium et le chlore qui ont une différence d'électronégativité de 2,1.
Si les atomes d'une liaison ont une différence d'électronégativité entre 0,5 et 1,6, ils sont décrits comme partageant une liaison covalente polaire. Cela signifie que les atomes de ces composés ont un partage inégal d'électrons, où la paire d'électrons est plus proche de l'un des atomes que de l'autre. Les molécules d'eau sont un exemple courant de composé avec une liaison covalente polaire.
Si les atomes d'une liaison ont une différence d'électronégativité entre 0,0 et 0,5, ils sont décrits comme partageant une liaison covalente non polaire - les électrons sont également partagés entre les atomes. Par exemple, dans le chlore gazeux diatomique, deux atomes de chlore sont liés et ont les mêmes valeurs d'électronégativité. Les électrons de la liaison covalente sont donc également partagés.
Synonymes, antonymes
Voir tous les synonymes pour "électronégativité".1 synonyme (sens proche) de "electronégativité" :
- valeur électronégative
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ÉLECTRONÉGATIVITÉ sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ELECTRONEGATIVITE est dans la page 2 des mots en E du lexique du dictionnaire.
Mots en E à proximité
électrolyte électromagnétisme électromètre électrométrie électron électronégativitéélectronographie électrophile électrophorèse électrophysiologie électroplaque
En rapport avec "électronégativité"

L'échelle de Pauling est une méthode largement utilisée pour ordonner les éléments chimiques selon leur électronégativité.
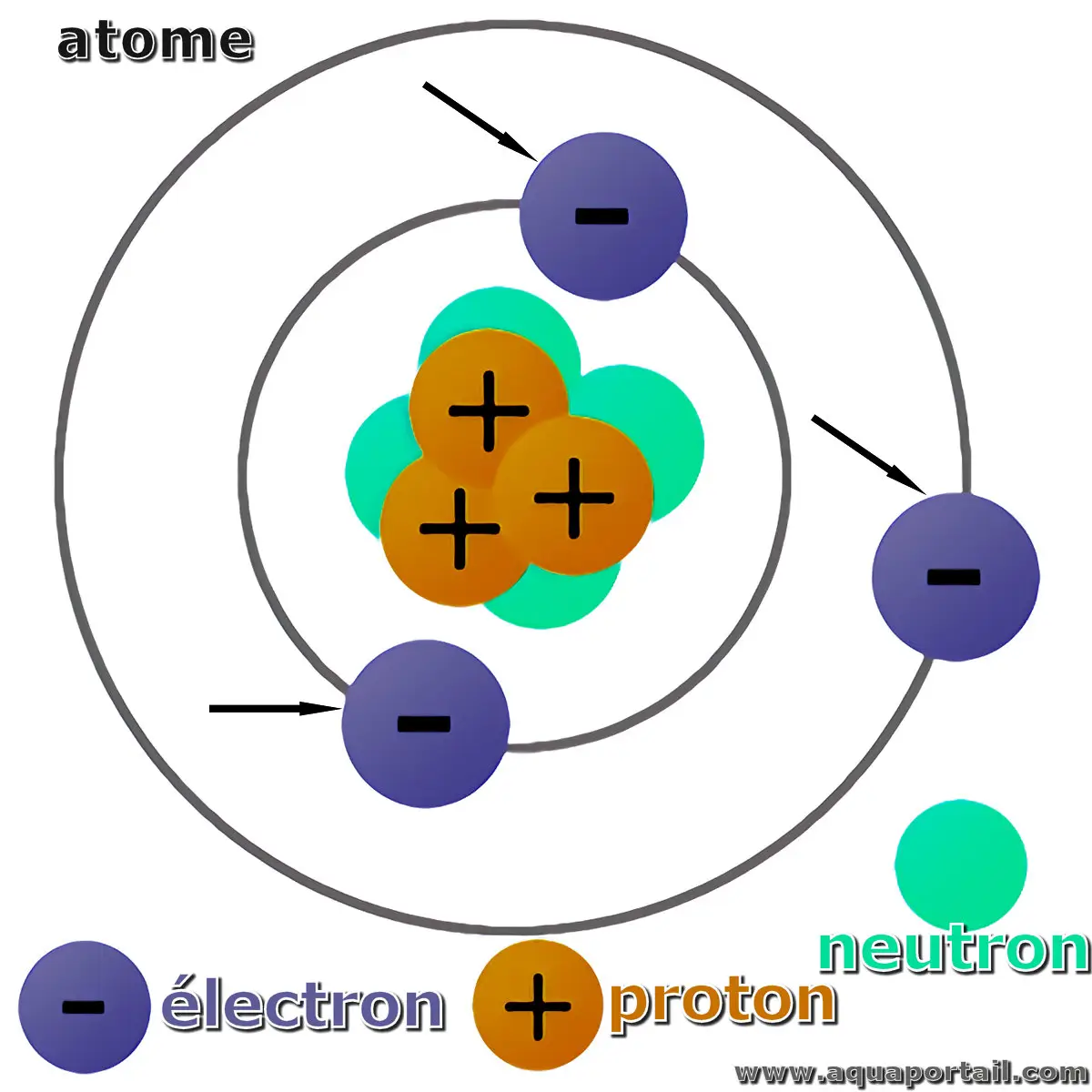
L'électron (e⁻) est une particule élémentaire chargée négativement. Les électrons liés par un atome ou un ion forment sa couche d'électrons.
Un accepteur d'électrons est une entité chimique capable de recevoir des électrons transférés d'un autre composé.
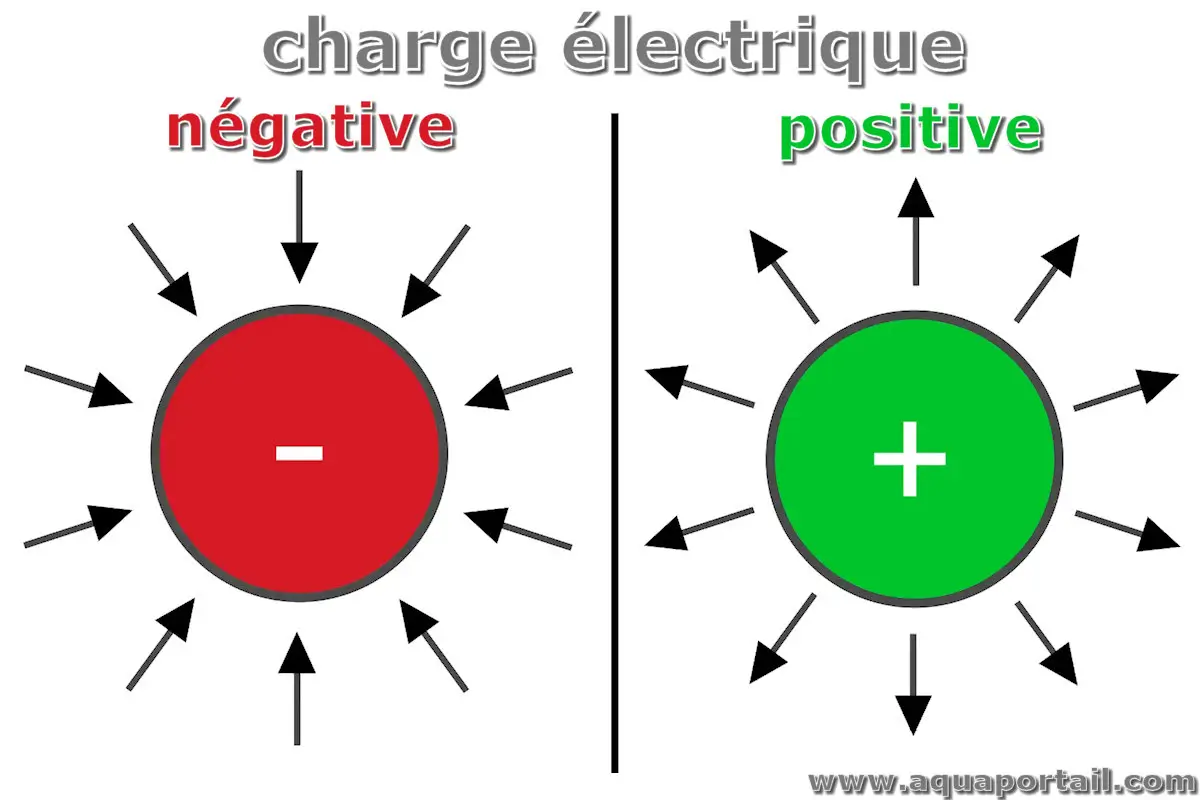
La charge électrique, qu'elle soit positive, négative ou neutre, est une propriété des objets physiques qui sont tous constitués d'atomes.
