Rayon atomique
Définition
Le rayon atomique est la distance mesurée entre le centre du noyau et les électrons de valence externes d'un atome. La valeur est mesurée en picomètres (pm, soit 1×10-12 m). Le rayon atomique est calculé en mesurant la distance entre les noyaux de deux atomes identiques liés ensemble. La moitié de cette distance est le rayon atomique.
Les rayons atomiques des éléments :
Au fur et à mesure que nous progressons dans un groupe du tableau périodique, le nombre d'électrons augmente, tout comme le nombre de couches dans lesquelles ces électrons sont organisés. Cela augmente le rayon atomique car les électrons de la couche la plus externe sont plus éloignés du noyau.
Explications
Au cours d'une période, le nombre de couches d'électrons reste le même, tandis que le nombre d'électrons augmente. Ainsi, à mesure que la charge nucléaire augmente sur une période, les protons du noyau peuvent attirer plus étroitement le plus grand nombre d'électrons en raison de l'attraction des protons positifs vers les électrons négatifs. Cela signifie que les électrons sont attirés plus près du noyau, ce qui réduit la taille du rayon atomique.
L'hélium a le plus petit rayon atomique à 31 picomètres. L'hélium est dans la période supérieure et le groupe le plus à droite, qui suit les modèles de rayon atomique sur le tableau périodique.
Le rayon atomique d'un élément particulier est une caractéristique importante car il nous aide à comprendre de nombreuses propriétés des atomes et comment ils réagissent. Le rayon atomique est la distance entre le noyau de l'atome et l'orbite électronique la plus externe, et de nombreuses tendances du tableau périodique reposent sur cette propriété en raison de sa relation avec d'autres propriétés atomiques telles que la charge nucléaire et le blindage. Parce que les frontières où les couches d'électrons se terminent sur un atome peuvent être un peu floues, la définition réelle du rayon atomique est la moitié de la distance entre les noyaux de deux atomes liés identiques. Le rayon atomique est mesuré en picomètres, soit un billionième de mètre ou 1×10-12.
Au fur et à mesure que nous progressons dans un groupe du tableau périodique, le nombre d'électrons augmente, tout comme le nombre de couches dans lesquelles ces électrons sont organisés. Cela augmente le rayon atomique car les électrons de la couche la plus externe sont plus éloignés du noyau. La taille du noyau augmente également à mesure que vous descendez dans le groupe. Ainsi, à mesure que vous descendez dans le tableau périodique, la taille du noyau et le nombre de couches augmentent, augmentant le rayon total.
Par exemple, le rayon atomique du lithium est de 152 picomètres, mais si nous progressons jusqu'au césium, son rayon atomique est de 262 picomètres. En effet, le césium a non seulement un plus grand nombre de protons, mais également 6 couches d'électrons. En raison du grand noyau et du grand nombre de couches, l'électron de valence externe est beaucoup plus éloigné, ce qui signifie que son rayon atomique est plus grand.
Les choses sont un peu différentes quand on regarde à travers les périodes, cependant. Alors que le nombre de protons et la taille du noyau augmentent toujours sur une période, le rayon atomique diminue en fait. Cela a à voir avec le nombre de couches d'électrons. Au cours d'une période, le nombre de couches d'électrons reste le même, tandis que le nombre d'électrons augmente. Ainsi, à mesure que la charge nucléaire augmente sur une période, les protons du noyau peuvent attirer plus étroitement le plus grand nombre d'électrons en raison de l'attraction des protons positifs vers les électrons négatifs. Cela signifie que les électrons sont attirés plus près du noyau, ce qui réduit la taille du rayon atomique.
Par exemple, le sodium dans la période 3 a un rayon atomique de 186 picomètres et le chlore dans la même période a un rayon atomique de 99 picomètres. En effet, le chlore a un plus grand nombre de protons et une charge nucléaire plus élevée, sans couches supplémentaires pour éloigner les électrons. Cette charge nucléaire accrue attire plus fortement les électrons vers le noyau, ce qui réduit le rayon.
Synonymes, antonymes
Voir tous les synonymes pour "rayon atomique".1 synonyme (sens proche) de "rayon atomique" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à RAYON ATOMIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression RAYON ATOMIQUE est dans la page 1 des mots en R du lexique du dictionnaire.
Mots en R à proximité
ravine ravine classique ravine éphémère ravinement rayon rayon atomiquerayon épineux rayon hydraulique rayon ionique rayon mou rayonnement ionisant
En rapport avec "rayon atomique"

Un atome est la plus petite partie d'une substance qui ne peut être décomposée chimiquement.
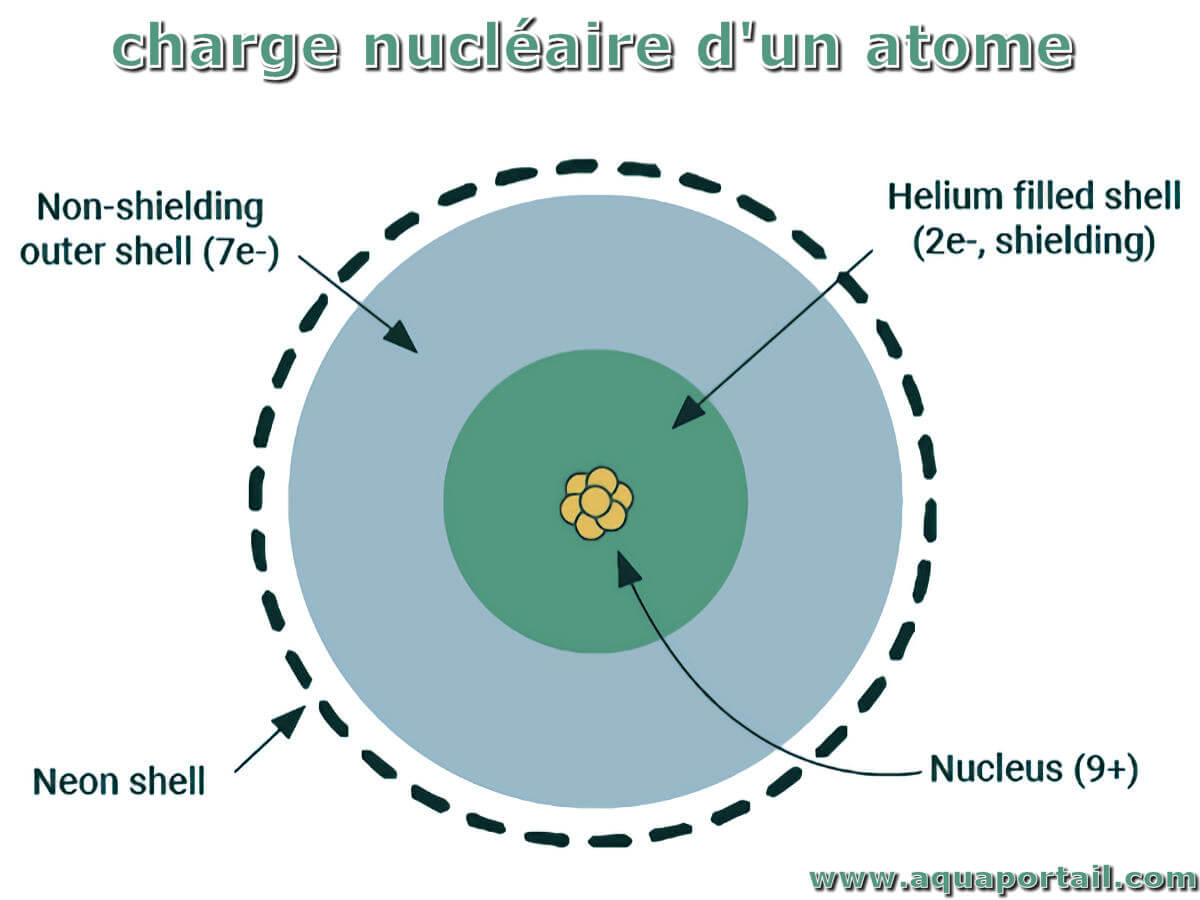
La charge nucléaire est une mesure de l'effet du nombre de protons dans le noyau et de leur capacité à attirer les électrons négatifs en orbite autour...

En physique atomique, une couche électronique, en rapport avec le niveau énergétique d'un atome, peut être considérée comme l'ensemble des orbites suivies...
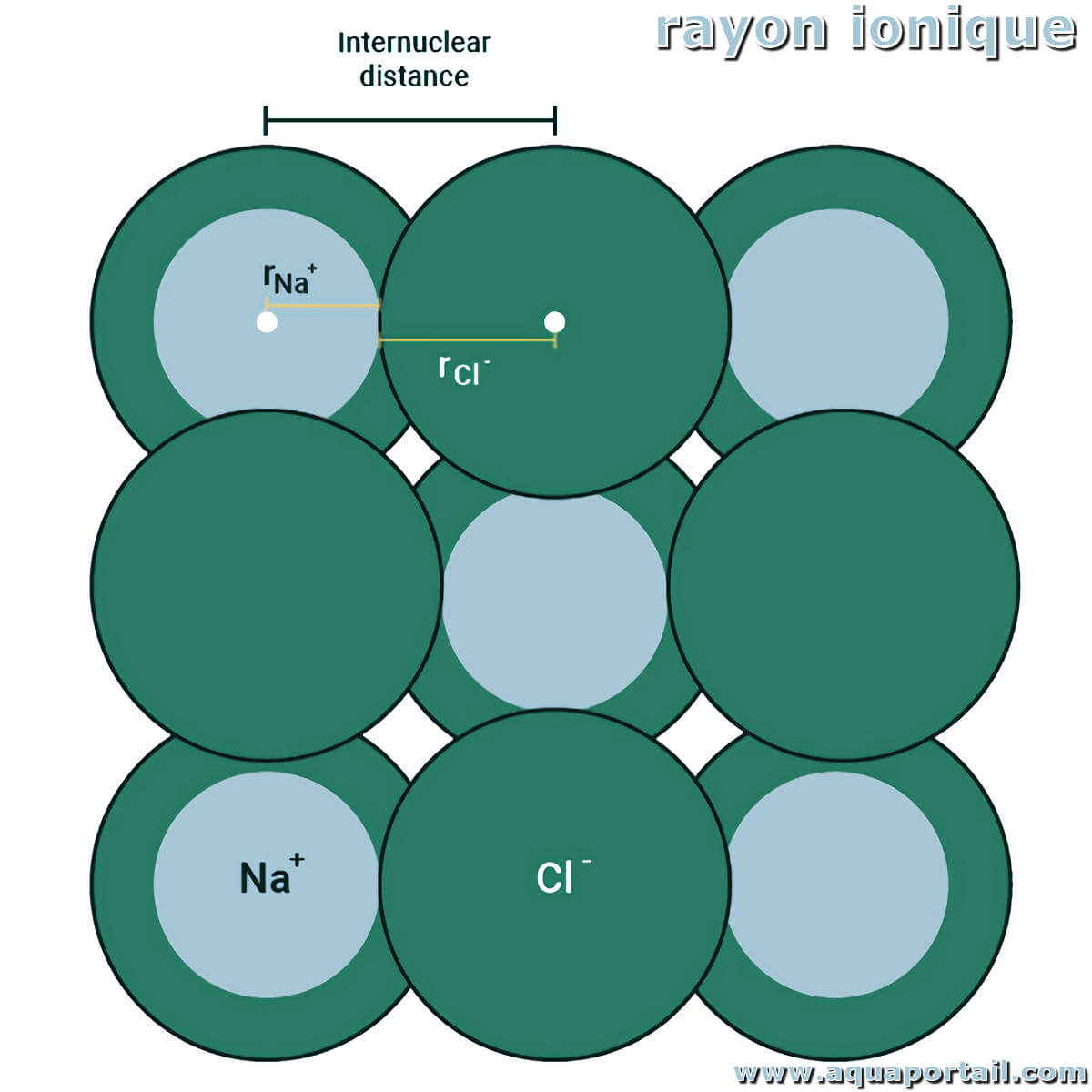
Le rayon ionique peut être défini comme la taille du rayon d'un ion monoatomique d'un atome, du noyau à l'électron de valence.
