Carbone
Définition
Le carbone, du groupe des non-métaux, est unique dans ses propriétés chimiques parce qu'il forme un nombre de composants supérieurs au nombre résultant de l'addition de tous les autres éléments en combinaison les uns avec les autres. Il est l'élément de base de toutes les molécules organiques. Voir aussi l'hydrate de carbone, le dioxyde de carbone..., et sous forme d'ion, les carbonates et les bicarbonates.
L'atome de carbone :
Le carbone est le roi des éléments de la table périodique.
Explications
Le plus grand groupe de tous les composants organique est celui constitué par le carbone et l'hydrogène. On connaît un certain nombre de formes allotropes pures du carbone : le diamant, le graphite, les fullerènes et le graphène. Le diamant est un solide cristallin incolore, transparent et le matériau le plus dur connu. Le graphite est noir et brillant mais doux. Les nano-formes, les fullerènes et le graphène, se présentent sous la forme de poudres noires ou marron foncé, semblables à de la suie.
La carbone existe sous forme de carbone organique (COD, COP) et de carbone inorganique (CID).
Utilisations
Le carbone est unique parmi les éléments dans sa capacité à former des chaînes fortement liées, scellées par des atomes d'hydrogène. Ces hydrocarbures, extraits naturellement comme combustibles fossiles (charbon, pétrole et gaz naturel), sont principalement utilisés comme combustibles. Une fraction petite mais importante est utilisée comme matière première pour les industries pétrochimiques produisant des polymères, des fibres, des peintures, des solvants et des plastiques, etc.
Le carbone impur sous forme de charbon de bois (issu du bois) et de coke (issu du charbon) est utilisé dans la fonte des métaux. Il est particulièrement important dans les industries du fer et de l'acier.
Le graphite est utilisé dans les crayons, pour faire des brosses dans les moteurs électriques et dans les revêtements de fours. Le charbon actif est utilisé pour la purification et la filtration. On le trouve dans les respirateurs et les hottes aspirantes de cuisine.
La fibre de carbone trouve de nombreuses utilisations en tant que matériau très résistant, mais léger. Il est actuellement utilisé dans les raquettes de tennis, les skis, les cannes à pêche, les fusées et les avions.
Les diamants industriels sont utilisés pour la coupe des roches et le forage. Les films diamantés sont utilisés pour protéger des surfaces telles que les lames de rasoir.
La découverte plus récente de nanotubes de carbone, d'autres fullerènes et de feuilles de graphène de faible épaisseur a révolutionné les développements matériels dans l'industrie électronique et dans la nanotechnologie en général.
Sous forme de chlorure, le tétrachlorure de carbone est un ancien composé utilisé dans les extincteurs.
Il y a 150 ans, la concentration naturelle de dioxyde de carbone dans l'atmosphère terrestre était de 280 ppm. En 2013, à la suite de la combustion de combustibles fossiles avec de l'oxygène, il y avait 390 ppm. Le dioxyde de carbone atmosphérique laisse entrer la lumière visible mais empêche certains infrarouges de s'échapper (l'effet de serre naturel). Cela maintient la Terre suffisamment chaude pour maintenir la vie. Cependant, un effet de serre accru est en cours, en raison d'une augmentation induite par l'homme du dioxyde de carbone atmosphérique. Cela affecte les êtres vivants à mesure que notre climat change.
Caractéristiques atomiques
| numéro atomique | 6 |
| masse atomique | 12,011 g.mol-1 |
| électronégativité de Pauling | 2,5 |
| masse volumique | 2,2 g.cm-3 à 20 °C |
| température de fusion | 3652 °C (sub) |
| Température d'ébullition | 4827 °C |
| rayon atomique (Van der Waals) | 0,091 nm |
| rayon ionique | 0,26 nm (-4) 0,015 (+4) |
| isotopes | 3 dont 1 radioactif |
| Configuration électronique | [ He ] 2s22p2 |
| Énergie de première ionisation | 1086,1 kJ.mol-1 |
| Énergie de deuxième ionisation | 2351,9 kJ.mol-1 |
| Énergie de troisième ionisation | 4618,8 kJ.mol-1 |
| Découverte | Le carbone était déjà connu dans l'antiquité. Il fallut néanmoins attendre le 19ème siècle pour en connaître les multiples formes (diamant, graphite, etc.). |
Rôle biologique
Le carbone est essentiel à la vie. En effet, il est capable de former une grande variété de chaînes de différentes longueurs. On pensait autrefois que les molécules de vie à base de carbone ne pouvaient être obtenues qu'à partir d'êtres vivants. On pensait qu'ils contenaient une "étincelle de vie". Cependant, en 1828, l'urée a été synthétisée à partir de réactifs inorganiques et les branches de la chimie organique et inorganique ont été réunies.
Les êtres vivants tirent presque tout leur carbone du dioxyde de carbone, soit de l'atmosphère, soit dissous dans l'eau. La photosynthèse des plantes vertes et du plancton photosynthétique utilise l'énergie du soleil pour diviser l'eau en oxygène et en hydrogène. L'oxygène est libéré dans l'atmosphère, l'eau douce et les mers, et l'hydrogène se joint au dioxyde de carbone pour produire des glucides.
Certains des glucides sont utilisés, avec l'azote, le phosphore et d'autres éléments, pour former les autres molécules monomères de la vie. Ceux-ci incluent les bases et les sucres pour l'ARN et l'ADN, et les acides aminés pour les protéines.
Les êtres vivants qui ne font pas de photosynthèse doivent dépendre de la consommation d'autres êtres vivants pour leur source de molécules de carbone. Leur système digestif décompose les glucides en monomères qu'ils peuvent utiliser pour construire leurs propres structures cellulaires. La respiration fournit l'énergie nécessaire à ces réactions. Lors de la respiration, l'oxygène rejoint les glucides pour former à nouveau du dioxyde de carbone et de l'eau. L'énergie libérée lors de cette réaction est mise à disposition des cellules.
Abondance naturelle
Le carbone se trouve dans le soleil et d'autres étoiles, formé à partir des débris d'une précédente supernova. Il est construit par fusion nucléaire dans des étoiles plus grosses. Il est trouvé sous 3 formes d'isotopes : 12C, 13C et 14C (le chiffre indique la masse atomique).
Il est présent dans l'atmosphère de nombreuses planètes, généralement sous forme de dioxyde de carbone. Sur Terre, la concentration de dioxyde de carbone dans l'atmosphère est actuellement de 390 ppm et continue d'augmenter.
Le graphite se trouve naturellement dans de nombreux endroits. Le diamant se trouve sous forme de cristaux microscopiques dans certaines météorites. Les diamants naturels se trouvent dans la kimberlite minérale, dont les sources se trouvent en Russie, au Botswana, en République Démocratique du Congo, au Canada et en Afrique du Sud.
En combinaison, le carbone se trouve dans tous les êtres vivants. On le trouve également dans les restes fossilisés sous forme d'hydrocarbures (gaz naturel, pétrole brut, schistes bitumineux, charbon, etc.) et de carbonates (craie, calcaire, dolomie, etc.).
Histoire
Le carbone se présente naturellement sous forme d'anthracite (un type de charbon), de graphite et de diamant. Historiquement, la suie ou le charbon de bois étaient plus facilement disponibles. En fin de compte, ces divers matériaux ont été reconnus comme des formes d'un même élément. Sans surprise, le diamant a posé la plus grande difficulté d'identification. Le naturaliste Giuseppe Averani et le médecin Cipriano Targioni de Florence ont été les premiers à découvrir que les diamants pouvaient être détruits par chauffage.
En 1694, ils ont concentré la lumière du soleil sur un diamant à l'aide d'une grande loupe et la gemme a finalement disparu. Pierre-Joseph Macquer et Godefroy de Villetaneuse ont répété l'expérience en 1771. Puis, en 1796, le chimiste anglais Smithson Tennant a finalement prouvé que le diamant n'était qu'une forme de carbone en montrant qu'en brûlant il ne formait que du CO2.
Synonymes, antonymes
Voir tous les synonymes pour "carbone".2 synonymes (sens proche) de "carbone" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CARBONE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CARBONE est dans la page 2 des mots en C du lexique du dictionnaire.
En rapport avec "carbone"
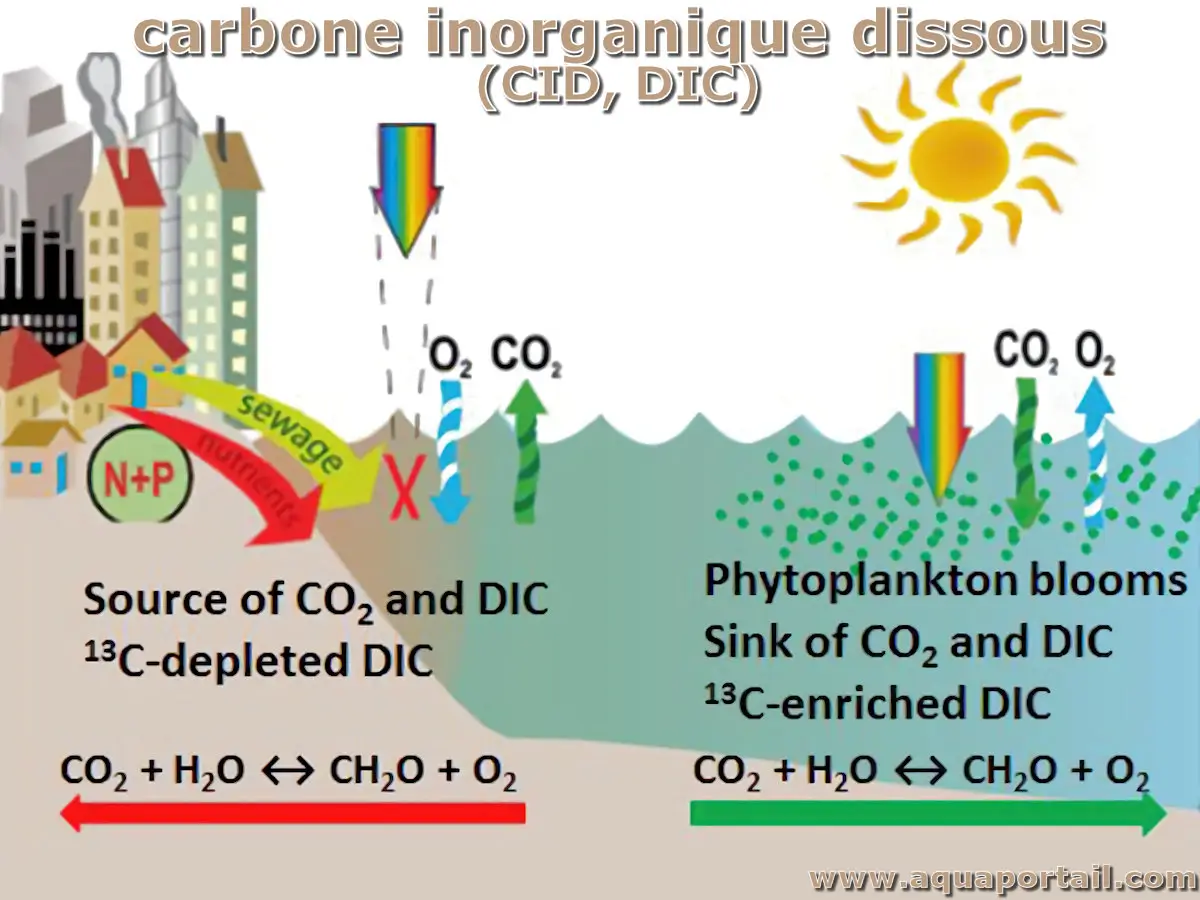
Le carbone inorganique dissous (CID) est l'ensemble du dioxyde de carbone (CO₂), des ions bicarbonate (HCO₃⁻) et des ions carbonate (CO₃²⁻) présents dans...
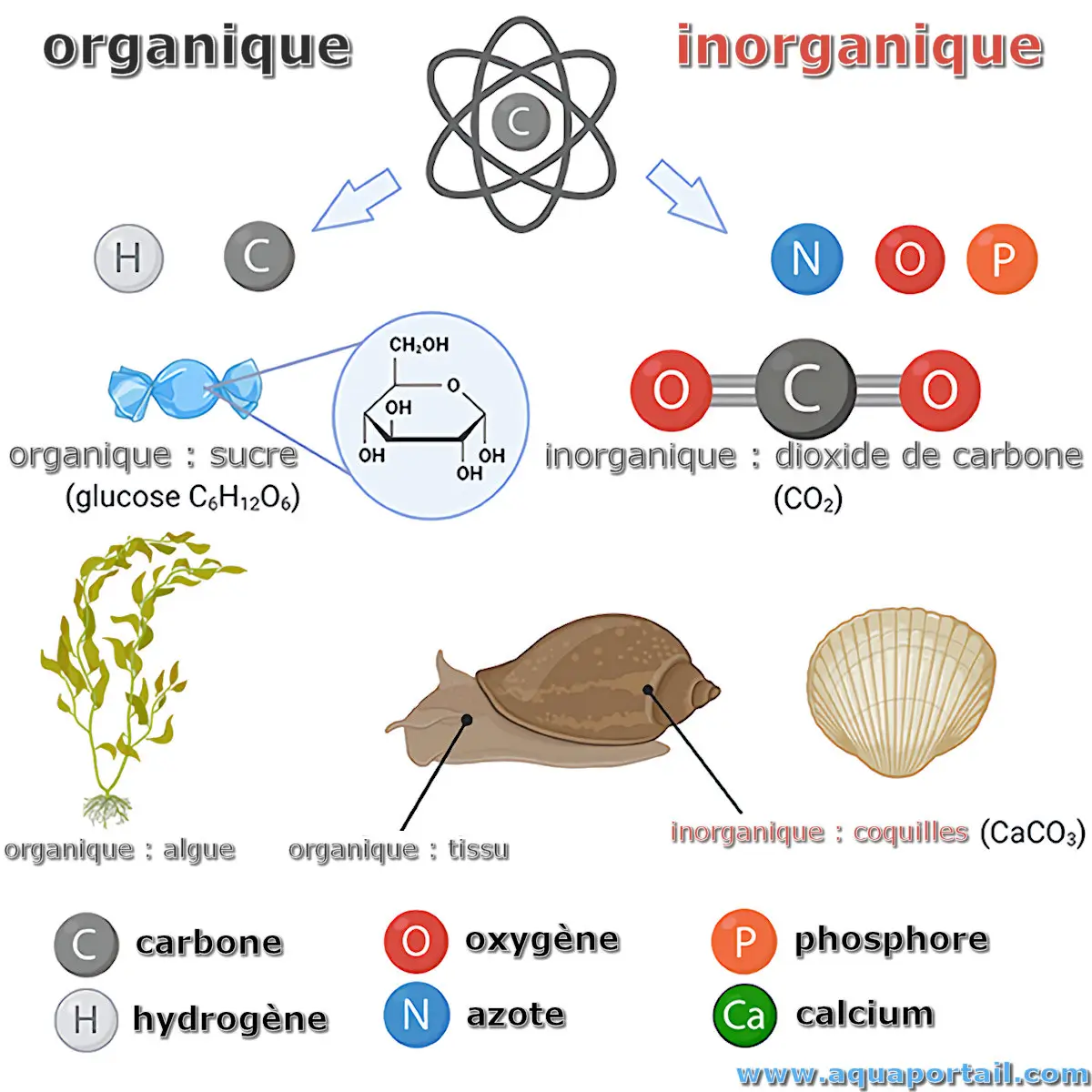
Le carbone organique est naturellement produit par tous les organismes vivants, pouvant être dissous (COD) ou particulaire (COP).
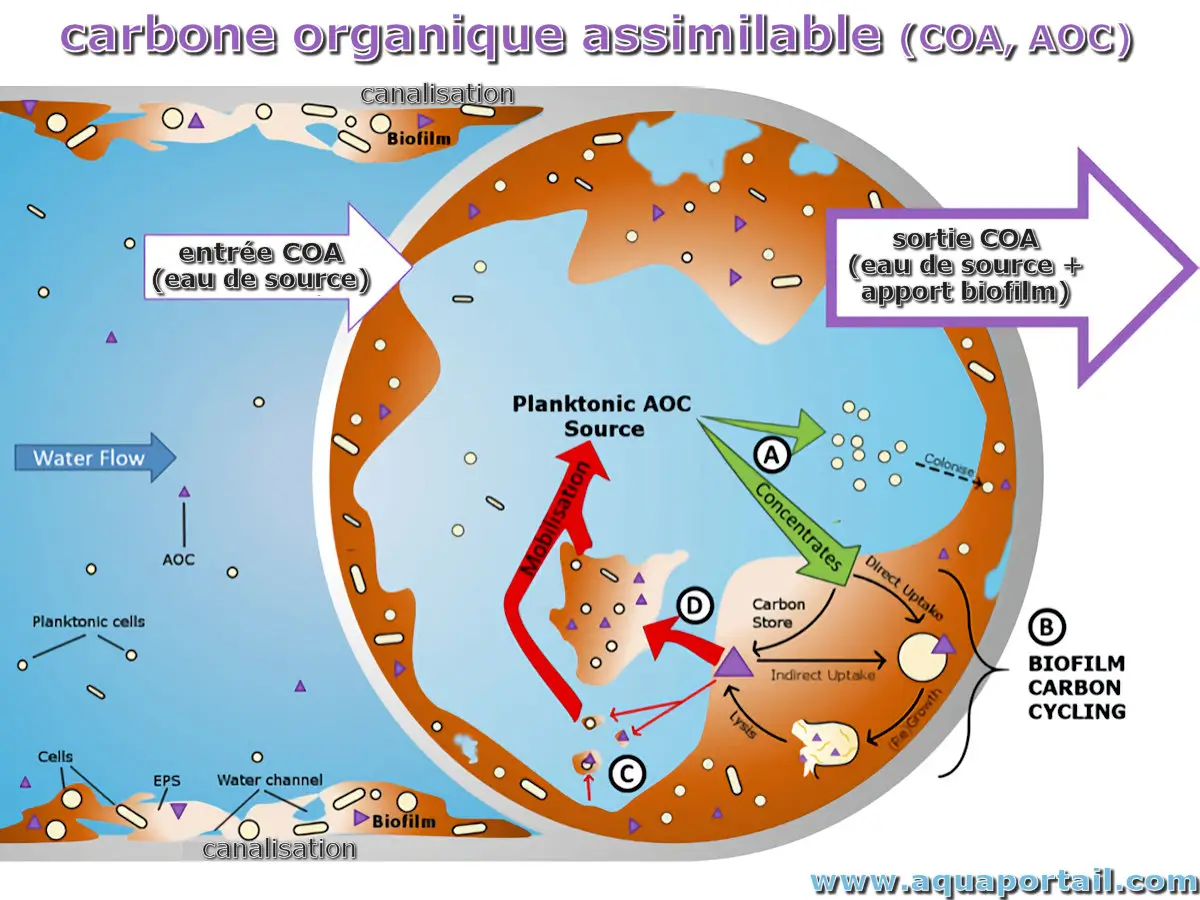
Le carbone organique assimilable (COA) est la partie du carbone organique total facilement assimilable par les micro-organismes hétérotrophes, ce qui favorise...
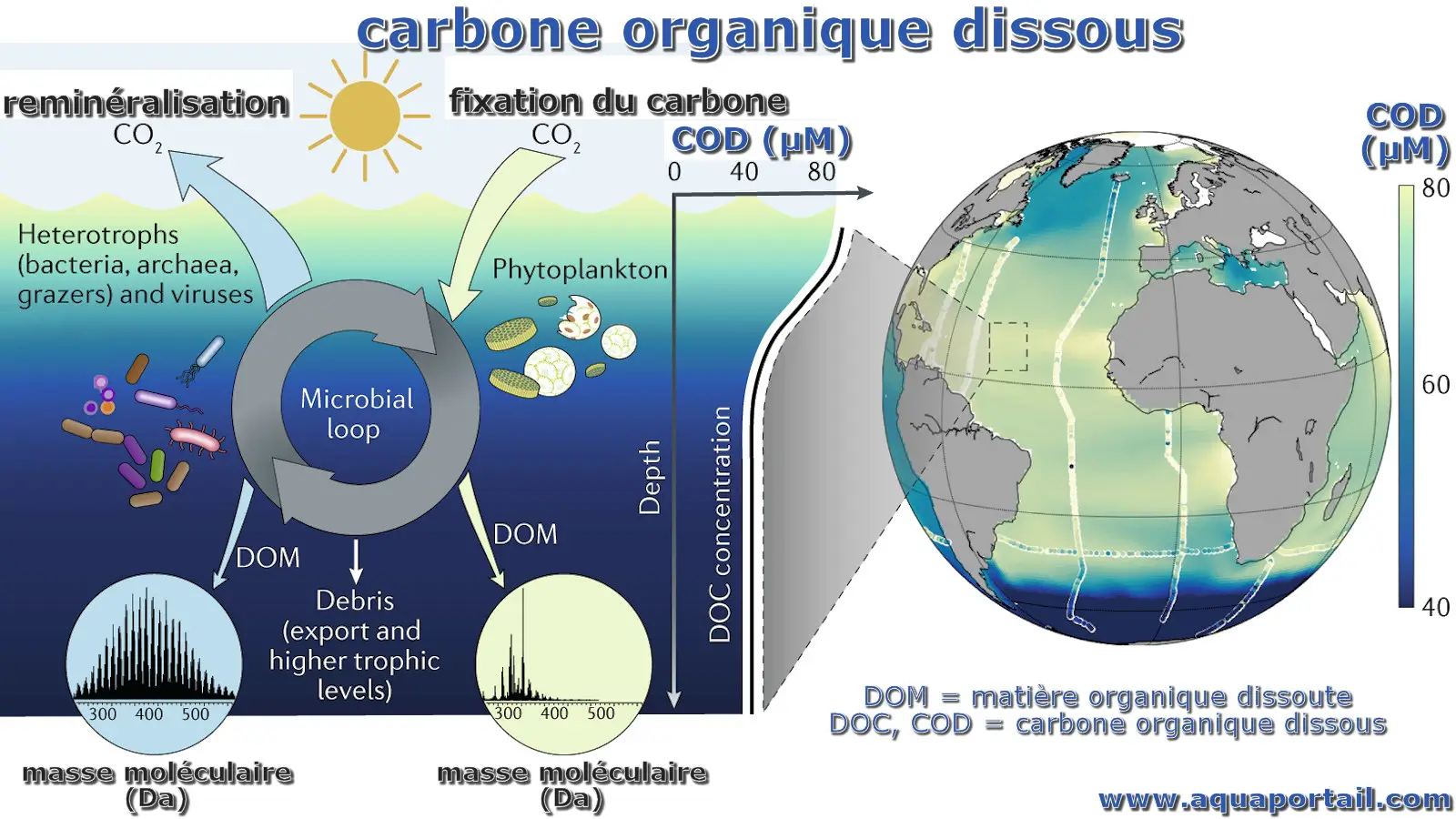
Le carbone organique dissous (COD) est la fraction de matière organique qui est en mesure de traverser un filtre, dont la taille des pores varie généralement...
