Hydrate
Définition
Un hydrate est généralement une substance chimique qui contient de l'eau. Le terme est traité de manière quelque peu différente dans différents domaines de la chimie. Contrairement aux hydrates, les anhydrides sont des composés privés d'eau. Les substances cristallines inorganiques sans eau, non hydriques, sont appelées anhydrates ou anhydre.
L'hydrate de méthane en train de brûler :
Un morceau d'hydrate de méthane brûle en produisant des flammes; l'incrustation est un réseau du clathrate.
Explications
L'hydrate le plus connu est la soude, qui est un carbonate de sodium décahydraté.
Pour le carbone, voir un hydrate de carbone; pour le soufre, voir un hydrate sulfureux.
La stabilité des hydrates est généralement déterminée par la nature des composés, leur température et l'humidité relative (si exposée à l'air).
Dans le passé, le terme hydrate désignait souvent des hydroxydes, en particulier des éléments alcalins et alcalino-terreux, par exemple l'hydrate de potassium, pouvant être obtenu chimiquement en ajoutant de l'eau au métal et induisant une certaine confusion dans la nomenclature. En termes familiers, l'utilisation demeure.
Hydrate inorganique
Les hydrates inorganiques sont des solvates, ils contiennent donc de l'eau moléculaire en cristallisation, telle que l'eau de cristallisation. Outre les cristaux contenant de l'eau de cristallisation, les complexes contenant des ligands d'eau sont également appelés hydrates. Une substance cristalline sans eau est un anhydrate.
L'eau de cristallisation dans les hydrates peut être liée à certains ions par des liaisons hydrogènes ou d'autres forces intermoléculaires, mais il est également possible qu'elle soit incorporée principalement parce que cela permet d'obtenir une structure cristalline plus favorable. Dans les hydrates cristallins, il existe certains rapports stoechiométriques entre le composé ionique et l'eau de cristallisation. Dans de nombreux cas, plusieurs hydrates avec différentes quantités d'eau de cristallisation sont possibles, de même que les modifications de carbonate de sodium avec un, deux, cinq, sept et dix équivalents d'eau de cristallisation et du carbonate de sodium sans eau.
Les hydrates sont formés par hydratation, généralement pendant la cristallisation à partir de solutions aqueuses. Les hydrates riches en eau de cristallisation peuvent être déshydratés, par exemple par chauffage, de sorte que soit d'autres hydrates contenant moins d'eau de cristallisation soient formés, soit le composé anhydre, des changements de couleur interviennent souvent en même temps, par exemple.
Les noms de hydrates (et composés hydratés) :
Selon le nombre de molécules d'eau, les composés hydratés sont appelés : anhydrate (0), hémihydrate (0,5), monohydrate (1), sesquihydrate (1,5), dihydrate (2), trihydrate (3), tétrahydrate (4), pentahydrate (5), hexahydrate (6), septahydrate (7), octahydrate (8), nonahydrate (9), décahydrate (10), undécahydrate (11), dodécahydrate (12), octadécahydrate (18)...
Pour le marquage des hydrates dans les formules empiriques, celui-ci n'est pas inséré directement dans la formule, mais est ajouté à la fin de la formule empirique sous la forme.n H2O (où n est la quantité d'eau de cristallisation qui existe par unité de formule dans le cristal). Par exemple, CaSO4. 2H2O décrit le sulfate de calcium avec deux équivalents d'eau de cristallisation, ce qui correspond au gypse. Pour nommer le nom du composé, on ajoute -xxxhydrat, où xxx est un mot-chiffre grec indiquant le nombre équivalent d'eau de cristallisation.
Le gypse est appelé sulfate de calcium dihydrate. Le gypse solidifié CaSO4. 2H2O avec deux molécules d'eau ou de ciment durci par molécule de sulfate de calcium sont des exemples techniques d'hydrates.
La chimie analytique utilise souvent des hydrates car les cristaux formés sont stables, contrairement aux sels anhydres qui absorbent facilement l'humidité de l'air. Les hydrates couramment utilisés sont : le sel de Mohr, sulfate d'ammonium et de fer (II) hexahydraté et l'acide oxalique dihydraté. Dans certains cas, l'eau peut former des clathrates (hydrate de méthane).
Hydrate organique
En chimie organique, les composés hydratés sont appelés hydrates. Ce ne sont généralement pas des composés contenant de l'eau moléculaire, mais ceux dans lesquels de l'eau a été ajoutée chimiquement à un composé par une réaction d'addition. Des exemples en sont les diols géminés ou les hydrates d'aldéhyde, qui sont des aldéhydes hydratés.
La plupart des hydrates d'aldéhyde sont instables, à l'exception de l'hydrate de chloral, le formol. Les triols géminaux (acides orthocarboxyliques = acides carboxyliques hydratés), tout comme l'acide orthocarbonique (tétrahydroxyméthane), ne sont stables que sous la forme de leurs esters.
Il existe également des composés organiques stables contenant de l'eau d'hydratation, par exemple, le (R) -cystéine · chlorhydrate · monohydrate [ L- cystéine · chlorhydrate · monohydrate; CAS-No. 7048–04–6], qui est fabriqué à l'échelle industrielle.
Hydrates de gaz
Dans les hydrates de gaz, contrairement aux substances contenant de l'eau de cristallisation, non pas l'eau de la substance, mais un composé autrement gazeux tel que le méthane, le sulfure d'hydrogène ou le dioxyde de carbone est emprisonné dans la glace. Cela forme un clathrate, un composé d'inclusion sans grandes attractions physiques entre la glace et le gaz. L'hydrate de gaz le plus connu est l'hydrate de méthane.
Outre les hydrates de sel, il existe également des hydrates de méthane et des "alliages" entre de la glace ou de l'eau très froide (autour du gel) et des gaz (hydrates de gaz). Des hydrates de méthane peuvent se former spontanément si le gaz naturel est stocké ou transporté avec de l'eau sous haute pression à des températures pas trop élevées. Cette combinaison de matériaux intervient, par exemple, dans les pipelines de transport des plates-formes de production offshore à la côte. Parce que l'hydrate de méthane est un solide, il peut obstruer ces lignes de transport. Pour prévenir la formation d'hydrates, un agent qui lie l'eau est toujours ajouté lors du transport de gaz naturel non nettoyé. Le glycol est un agent largement utilisé, le méthanol est utilisé si la formation d'hydrate a déjà eu lieu. Au point de réception, l'eau du glycol est bouillie et le glycol pur est renvoyé pour être réutilisé.
On soupçonne qu'il y a des dépôts d'hydrates au fond des océans, mais cela n'a pas encore été démontré. La désintégration spontanée d'un tel gisement en eau et gaz pourrait alors expliquer des épaves par ailleurs inexplicables, telles que celles survenues dans le triangle des Bermudes.
Glucides
Bien que les glucides contiennent des hydrates dans le nom, ils ne font pas partie des hydrates.
Les molécules ont été classées comme hydrates pour des raisons historiques. Le glucose, C6H12O6, était à l'origine considéré comme du C6(H2O)6 et décrit comme un glucide, mais il s'agit d'une mauvaise description de sa structure telle qu'elle est connue aujourd'hui. Le méthanol est souvent passé sous la forme "méthyl hydrate", à tort écrit comme CH2OH2, bien que la formule correcte soit CH3-OH.
Applications des hydrates
Généralement, dans la construction et dans les matériaux réfractaires, les liants inorganiques sont souvent privés d'eau pendant le traitement. Par exemple, dans les produits à base de ciment et de gypse, la chaleur est appliquée aux matières premières. Une fois que l'eau est ajoutée au site où elle est construite, la poudre est réhydratée et est capable de former des liens avec d'autres substances présentes. Nous passons donc de la poudre à la pâte qui va former un "bloc de béton". Une eau qui n'est pas un liant chimique ou convertie en hydrates peut toujours être libérée sous forme de vapeur, en raison notamment de la chaleur d'hydratation, en particulier dans les produits en ciment, qui subissent une réaction chimique exothermique avec l'eau.
En général, plus les produits à base de ciment sont conservés à l'état humide immédiatement après leur installation, mieux c'est. Plus les produits à base de ciment sont maintenus humides, plus l'eau convertie en hydrates est importante, évitant ainsi l'évaporation due à la chaleur d'hydratation et à d'autres influences environnementales. Le séchage prématuré pose de nombreux problèmes concrets, tels que la fissuration et le retrait.
Afin d'éviter un séchage prématuré, il est important pour tous les autres produits de construction à base de ciment, en particulier les produits anti-éclaboussures et à base de mortier, pour lesquels des fissures plus douces peuvent entraîner un rejet. L'eau liée chimiquement est utilisée pour les réactions endothermiques lorsqu'elle est exposée à la chaleur du feu. La température de l'incendie dans un bâtiment peut atteindre 1 100 °C, en fonction du combustible présent et de la disponibilité en oxygène, mais les hydrates maintiennent la température de l'objet aux environs de 100 °C jusqu'à ce que toute l'eau soit coupée. Par conséquent, plus les hydrates sont forts, plus la résistance au feu est longue. C'est ce qui confère aux matériaux "anciens", tels que le plâtre, le béton ou le plâtre, une résistance au feu.
La durée de la résistance au feu est importante pour de nombreux produits PFP de haute technologie, tels que les peintures endothermiques et intumescentes, les matériaux de revêtement et les carreaux, tels que ceux utilisés en physique spatiale pour la rentrée des véhicules.
Synonymes, antonymes
Voir tous les synonymes pour "hydrate".0 synonyme (sens proche) pour "hydrate".
2 antonymes (sens contraire) :
Les mots ou les expressions apparentés à HYDRATE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot HYDRATE est dans la page 3 des mots en H du lexique du dictionnaire.
Mots en H à proximité
hydnophore hydractinie hydraire hydrante hydratation hydratehydrate de carbone hydrate de chloral hydraulique hydrazine hydre
En rapport avec "hydrate"

Une substance anhydre, en particulier un composé cristallin, ne contient pas d'eau, au contraire d'un hydrate.

La chaux éteinte est de la chaux hydratée Ca(OH)₂ (hydroxyde de calcium). Sous la forme d'une poudre blanche ou pâte, elle est obtenue en ajoutant de l'eau...
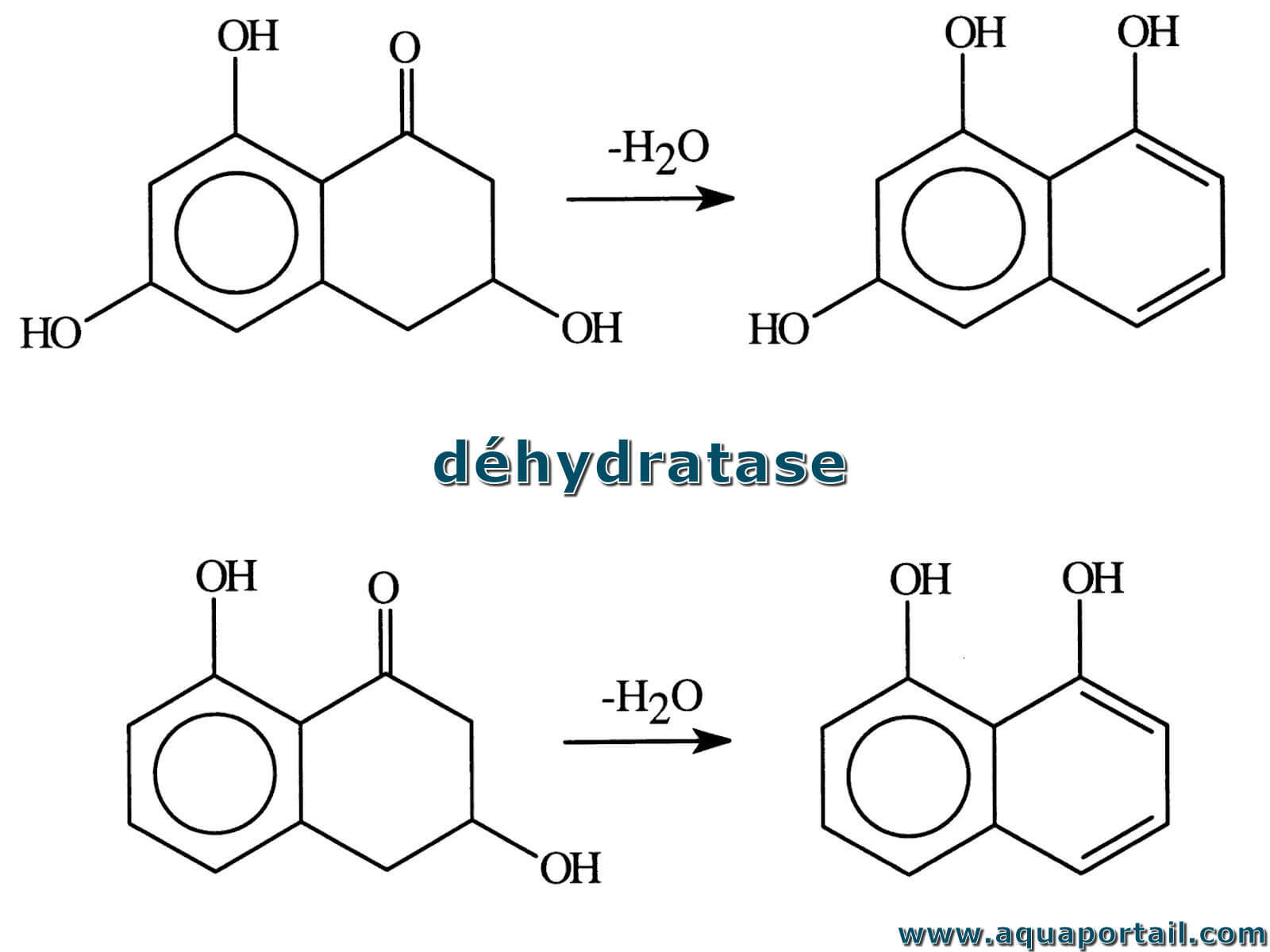
Une déhydratase, ou une déshydratase, est une enzyme qui catalyse l'élimination d'un oxygène et de deux hydrogènes d'un composé organique sous forme d'eau.
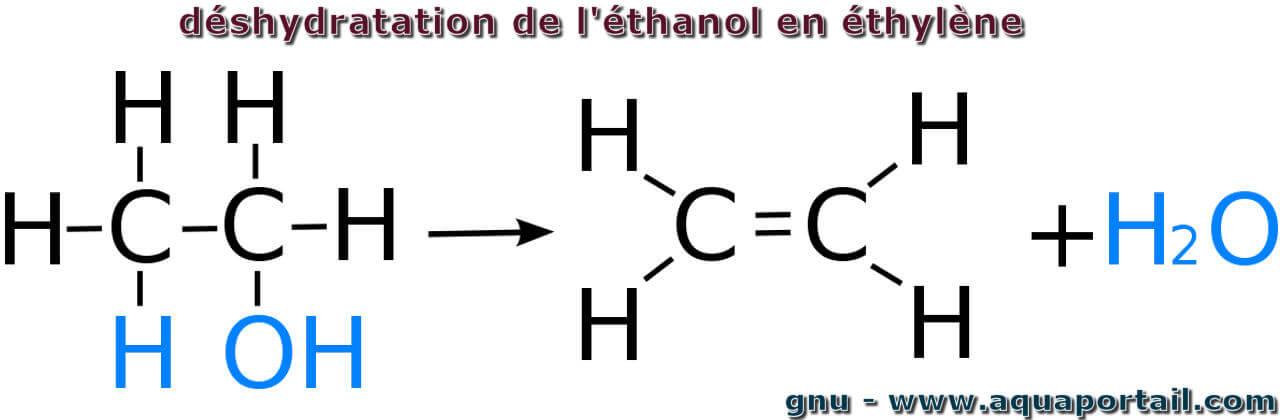
La déshydratation est l'altération ou le manque d'eau et de sels minéraux dans un organisme, aussi définie comme la perte d'eau corporelle au-dessus de 3 %.
