Ester
Définition
Un ester est un composé organique dérivé du pétrole ou inorganique oxygéné dans lequel un ou plusieurs protons sont substitués par des groupes organiques. En chimie, les esters sont des substances résultant d'une réaction entre des alcools (dans certains cas des phénols) et des acides. La préparation d'esters est appelée estérification.
Des esters :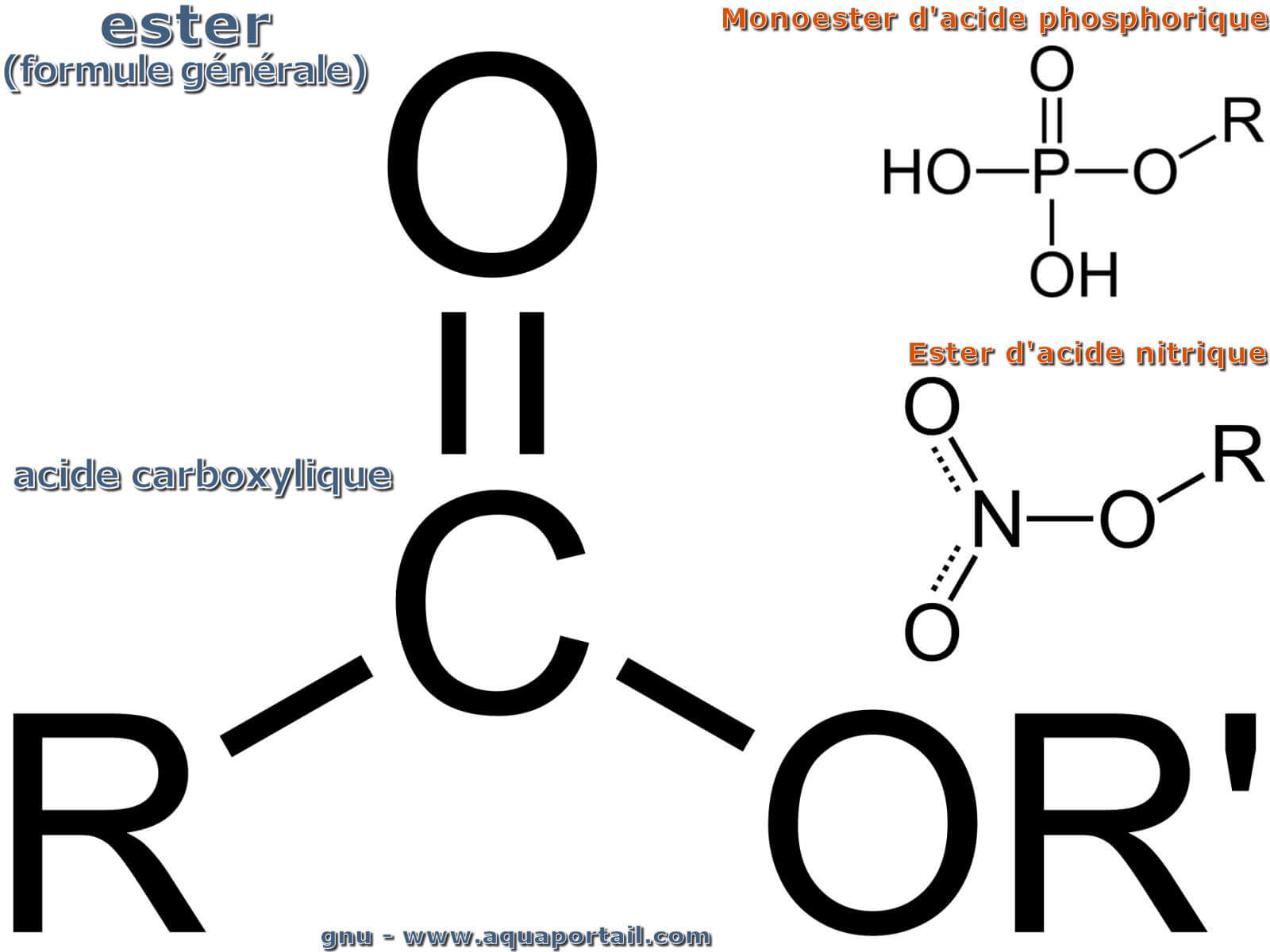
Les esters peuvent être basés sur l'acide d'un élément chimique différent : carbone, phosphore, azote...
En chimie, les esters forment un groupe de composés chimiques résultant formellement ou de facto de la réaction d'un acide et d'un alcool ou d'un phénol avec élimination de l'eau (réaction de condensation). Il existe des esters d'acides organiques (acides carboxyliques tels que l'acide acétique, des acides sulfoniques) et acides inorganiques (acide phosphorique, acide sulfurique, acide borique, acide carbonique, par exemple).
Le nom ester a été formé par le chimiste Léopold Gmelin en 1850 à partir du terme "éther de vinaigre", un nom historique pour l'acétate d'éthyle. Les vapeurs d'acétate d'éthyle ont un effet anesthésiant, similaires à celles de "l'éther" (éther diéthylique), d'où le terme "éther éthylique".
Explications générales
Dans le cas particulier des esters organiques les plus étudiés, il s'agit de composés formés par la substitution d'un atome d'hydrogène présent dans le carboxyle (-COOH) des acides carboxyliques par un groupe alkyle (R') ou aryle (Ar). Les esters inorganiques, en revanche, résultent de réactions entre alcools inorganiques et oxyacides, de sorte que l'acide perd un proton (H+) et se lie à la chaîne ayant appartenu à un alcool après la perte de l'hydroxyle (OH-) par cette molécule. Ainsi, les réactions d'estérification - comme les réactions entre alcools-phénols et acides - produisent également de l'eau (HOH ou H2O).
Les esters les plus courants dans la nature sont les triglycérides - les triesters de glycérine - des composants des huiles essentielles et des graisses destinées à la consommation humaine. En outre, ils existent également dans l'arôme des fleurs et le goût des fruits. L'industrie emploie beaucoup d'esters pour conférer des arômes artificiels aux gâteries et à la fabrication de plastiques appelés polyesters.
Description
Les esters peuvent être considérés comme s'ils provenaient d'une réaction de condensation entre un alcool/sucre et un acide/chlorure d'acide. Les types les plus courants d'esters sont les esters d'acide carboxylique qui contiennent le groupe -(C=O)-O- en tant que groupe fonctionnel. Il contient deux chaînes R qui peuvent être à la fois une chaîne alkyle et une chaîne aryle. Cependant, les esters peuvent également résulter de réactions de condensation d'alcools avec d'autres types d'acides (inorganiques), tels que l'acide phosphorique, l'acide sulfurique, l'acide nitrique ou l'acide borique.
Si toutes les chaînes C sont des groupes alkyle, on parle alors d'alcanoate d'alkyle.
Les esters volatils de faible poids moléculaire ont souvent une odeur typique, ce qui signifie qu'ils peuvent être trouvés dans les parfums et les phéromones. Les esters trouvent des applications dans, entre autres, les parfums, les solvants, les plastiques polyester et le biodiesel. Certains esters d'acide nitrique ont la propriété de pouvoir exploser ou de s'enflammer violemment.
Les esters servent de parfum aux bonbons :
Une des utilisations des esters est de parfumer les bonbons (bonbons), le chewing-gum (gomme à mâcher), la crème glacée (crème glacée), etc.
Nomenclature IUPAC
Le nom d'un ester est composé en premier lieu du nom de l'alcool ou du saccharide, puis du nom de l'acide, suivis d'un suffixe approprié. À partir du nom du premier groupe fonctionnel, dérivé de l'alcool ou du sucre, le suffixe -ol ou -ose est remplacé par -yl. La deuxième partie du nom de l'ester consiste en le nom de l'acide, -acide étant remplacé par -oate. Par exemple, l'ester d'acide éthanoïque du méthanol (formé en combinaison avec l'acide acétique) est appelé dans l'appellation systématique : méthyléthylanoate.
Parce que les esters les plus courants sont des esters carboxyliques, ils ont reçu un nom spécifique. Pour les esters d'acides carboxyliques courts, le nom trivial consiste en le nom de l'alcool (-ol est remplacé par -yl) suivi de la souche du nom en langue anglaise de l'acide carboxylique (dont le nom de départ est donné). L'éthanoate de méthyle est aussi appelé acétate de méthyle.
Propriétés
En comparaison avec d'autres molécules organiques contenant des groupes carbonyle, les esters sont relativement non polaires. Cela est évident, par exemple, lorsque l'on compare les points d'ébullition de ces produits avec ceux des alcanes correspondants : les points d'ébullition des esters sont approximativement égaux aux points d'ébullition des alcanes de même poids moléculaire. Cela indique que les interactions de van der Waals ont la plus grande contribution aux forces intermoléculaires sur les esters.
Les atomes d'oxygène du groupe ester n'ont presque aucun caractère fondamental. Un proton qui adhérerait au groupe ester induirait ainsi une charge positive sur un atome d'oxygène. Cependant, l'oxygène est un élément électronégatif libre, de sorte que les esters protonés ont une valeur de pKa relativement basse et que leur proton supplémentaire est immédiatement libéré. Par exemple, la valeur de pKa de l'acétate d'éthyle protoné est de -6,5.
L'ester d'acide hexaphosphorique est appelé l'acide phytique (phytate d'inisitol), un antinutriment.
Esters carbonés
Les esters carboxyliques sont des esters des acides carboxyliques avec le groupe fonctionnel -COOR. Ils sont composés d'une partie acide et d'une partie alcool.
Les esters carboxyliques forment un groupe de substances fréquemment rencontrées en chimie organique et dans la nature (esters de fruits, graisses, huiles).
Les esters biologiquement importants sont les triglycérides (également appelés "triesters de glycérol", plus rarement des "graisses neutres" obsolètes). Ces huiles naturelles (état liquide de la matière) ou graisses (solides) sont presque toutes peu solubles dans l'eau, bien qu'elles soient polaires, car elles comportent (à quelques exceptions près) trois groupes alkyle hydrophobes. Plus la chaîne est longue, plus la solubilité du triester dans l'eau est mauvaise.
Esters organophosphorés
Les esters d'acide phosphorique sont des esters d'acide orthophosphorique qui se forment formellement ou réellement lors de la réaction de l'acide avec un alcool avec élimination de l'eau. Les acides nucléiques sont (en tant que partie de leur structure) des esters de l'acide phosphorique avec la fonction alcool des sucres (par exemple, le ribose ou le désoxyribose).
La structure distingue les monoesters, les diesters et les triesters de l'acide orthophosphorique. Parmi les esters de l'acide phosphorique et ses dérivés, les composés sont connus pour être des insecticides puissants (par exemple, E605). Parmi les dérivés figurent également des composés hautement toxiques, tels que les agents de guerre chimique sarin, tabun et soman.
Esters sulfurés
Les esters d'acide sulfurique ou les alkylsulfates sont des esters d'acide sulfurique. Ils sont largement représentés dans la nature. (Exemples : carraghénane, héparine ou les sulfatides en tant que constituants de la substance cérébrale). Les sels d'esters d'acide monoalkyl sulfurique à longue chaîne, souvent appelés sulfates d'alcools gras, sont utilisés dans les produits cosmétiques en tant que tensioactifs anioniques (par exemple le laurylsulfate de sodium).
Le sulfate de diméthyle et le sulfate de diéthyle sont des esters dialkyliques de l'acide sulfurique et sont utilisés en tant que réactifs puissants en chimie pour transférer des groupes méthyle ou éthyle à d'autres molécules. Ces esters dialkyliques de l'acide sulfurique sont toxiques et cancérigènes en raison de leur effet alkylant.
Esters nitreux
Les esters d'acide nitrique sont des esters d'acide nitrique. Le groupe nitro (NO2) qu'il contient est stabilisé mésomériquement.
Esters spéciaux
Il existe des esters d'acides instables en tant qu'acides libres et qui ne peuvent exister que sous forme de dérivés (par exemple, un ester d'acide carbamique ou d'orthocarbonate). D'autre part, il arrive également que le composant alcool d'un ester n'existe pas en tant que composé libre car il se réorganiserait et ne serait stabilisé que par le composé ester avec un acide (par exemple, l'acétate de vinyle).
Synonymes, antonymes
Voir tous les synonymes pour "ester".1 synonyme (sens proche) de "ester" :
- éther éthylique
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ESTER sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot ESTER est dans la page 4 des mots en E du lexique du dictionnaire.
Mots en E à proximité
espèces réactives de l'oxygène essaimage essartage essence essence endémique esterestérase estérification esthésie esthésiologie esthète
En rapport avec "ester"

L'acétylcholinestérase (AChE) est une enzyme impliquée dans la transmission de l'influx nerveux.

Le cholestérol est une molécule stéroïde à 27 carbones présent dans les membranes plasmiques des eucaryotes.
Une cholinestérase (ChE) sont des enzymes d'ester de choline. Elles sont indispensables dans le métabolisme des animaux pluricellulaires à décomposer...

Le 7-déhydrocholestérol (7-DHC), ou provitamine D3, est un dérivé déshydrogéné du cholestérol obtenu par l'action d'une déshydrogénase sur le C7.
