Acide nitrique
Définition
L'acide nitrique (HNO3) est un acide minéral, un liquide incolore, fumant et hautement corrosif, qui est un réactif de laboratoire courant et un produit chimique industriel important pour la fabrication d'engrais et d'explosifs.
L'acide nitrique HNO3 :
Acide nitrique en flacon à gauche, et modèle boule et bâton de la molécule d'acide nitrique HNO3 à droite.
Explications
L'acide nitrique sous forme pure est incolore, mais les échantillons plus anciens ont tendance à acquérir une teinte jaune en raison de la décomposition en oxydes d'azote (NOx) et en eau. Les contaminants (généralement des oxydes d'azote) peuvent donner au liquide une couleur jaune clair à ocre.
L'acide nitrique (aqua fortis, esprit de nitre ou nitrate d'hydrogène) est l'un des réactifs de digestion le plus important et l'oxydant primaire le plus largement utilisé pour la décomposition de la matière organique.
L'acide nitrique chaud et concentré (16 M et 68 %) est un agent oxydant puissant qui libère des oligo-éléments de nombreux matériaux sous forme de sels de nitrate hautement solubles. Les propriétés oxydantes de l'acide nitrique sont perdues lorsqu'il est dilué en dessous d'environ 2 M.
La plupart des acides nitriques disponibles dans le commerce ont une concentration de 68 % (v/v) dans l'eau. Lorsque la solution contient plus de 86 % (v/v) d'acide nitrique, on parle d'acide nitrique fumant, qui, en fonction de la quantité de dioxyde d'azote (NO2) présent, est en outre caractérisé comme de l'acide nitrique fumant blanc ou rouge à des concentrations supérieures à 95 %.
Utilisations
L'acide nitrique est le principal réactif utilisé pour la nitration - l'ajout d'un groupe nitro (liaison simple NO2), généralement à une molécule organique. Alors que certains des composés nitrés résultants sont des explosifs sensibles aux chocs et thermiquement sensibles (comme la nitroglycérine et le trinitrotoluène (TNT), certains sont suffisamment stables pour être utilisés dans les munitions et la démolition, tandis que d'autres sont encore plus stables et utilisés comme pigments dans les encres. et colorants. L'acide nitrique est également couramment utilisé comme agent oxydant fort.
L'acide nitrique est utilisé comme intermédiaire dans la fabrication du nitrate d'ammonium (NH4NO3), qui est principalement utilisé dans la fabrication d'engrais. Une autre utilisation de l'acide nitrique est dans le processus d'oxydation pour la fabrication de l'acide adipique (HO2CCH2CH2CH2CH2CO2H) qui est un acide dicarboxylique utilisé dans la production de nylon.
L'acide nitrique est également utilisé dans l'oxydation organique pour fabriquer de l'acide téréphtalique (C6H4(CO2H)2) et d'autres composés organiques.
L'acide nitrique est également utilisé dans la fabrication d'explosifs, tels que les dérivés de nitrobenzène, le dérivé de dinitrotoluène et les dérivés de TNT, et pour produire d'autres intermédiaires chimiques.
L'acide nitrique est produit par deux méthodes :
- la première méthode utilise l'oxydation, la condensation et l'absorption pour produire un acide nitrique faible qui peut avoir des concentrations allant de 30 % à 70 % (v/v) d'acide nitrique;
- la deuxième méthode combine la déshydratation, le blanchiment, la condensation et l'absorption pour produire de l'acide nitrique à haute résistance à partir d'acide nitrique faible; l'acide nitrique à haute concentration contient généralement plus de 90 % (v/v) d'acide nitrique.
En géologie, l'application la plus importante de l'acide nitrique dans l'analyse des roches est de décomposer à la fois les minéraux carbonatés et sulfurés (généralement en association avec HCl). Les matrices d'acide nitrique sont le meilleur milieu acide pour l'analyse ICP-MS. Ses constituants (H2, N2 et O2) sont déjà présents dans l'air entraîné par le plasma, et la gamme des ions polyatomiques n'est pas augmentée de manière significative par l'ajout d'une matrice HNO3, et il n'interfère pas non plus avec la plupart des déterminations. De plus, l'acide nitrique est disponible dans le commerce avec une pureté suffisante.
Caractéristique de l'acide nitrique
L'acide nitrique pur et anhydre est un liquide incolore d'une densité d'environ 1,5 g/mL. À environ 25 °C, la viscosité est de 0,746 mPa·s. À une température de -42 °C, il cristallise en cristaux blancs. On connaît deux hydrates (à l'état solide) de l'acide nitrique : le monohydrate et le trihydrate. La température de stockage idéale pour l'acide nitrique est inférieure à 0 °C, car des températures plus élevées peuvent donner lieu à des réactions de décomposition. Des oxydes d'azote se forment, qui donnent au liquide une couleur jaune ou même brune caractéristique.
Lorsque le liquide pur est exposé à l'air, des vapeurs blanches se forment (dans ce contexte on parle de liquide fumant). Si le liquide contient déjà du dioxyde d'azote dissous, des vapeurs nitreuses rouge-brun se forment. L'acide nitrique fumant a une concentration molaire de 16 mol/L; c'est la forme la plus concentrée d'acide nitrique dans des conditions standard. L'acide nitrique forme un mélange azéotropique avec l'eau à une concentration de 68 %. Ce mélange bout à 120,5 °C (à pression atmosphérique).
L'acide nitrique se décompose sous l'influence de la température et de la lumière en, entre autres, dioxyde d'azote : 4 HNO3 ⟶ 2 H2O + 4 NO2 + O2.
Cette décomposition peut produire des variations de pression de vapeur au-dessus du liquide, car le dioxyde d'azote résultant se dissout partiellement ou complètement dans l'acide. Pour limiter la décomposition, il est préférable de conserver l'acide nitrique dans une bouteille brune et au frais.
Occurrence naturelle
À l'état libre, l'acide nitrique se retrouve en très faible quantité dans l'atmosphère sous la forme d'un produit des décharges électriques (foudre) intervenant lors des orages. Les nuages nacrés sont des nuages de très haute altitude, dans la stratosphère (15 à 25 kilomètres de haut), et sont constitués d'une petite partie d'acide nitrique cristallisé (la température à laquelle les nuages se forment est de -78 °C ou moins).
L'acide nitrique est un composant des pluies acides, il se forme par oxydation de l'ammoniac suivie d'une hydrolyse.
Histoire
L'acide nitrique est mentionné pour la première fois dans le manuscrit De Inventione Veritatis de l'alchimiste anonyme Pseudo-Geber, qui faisait référence à la méthode utilisée au 9ème siècle par l'alchimiste arabe Jabir ibn Hayyan.
L'acide nitrique (aqua fortis) était connu et sa chimie pratiquée au Moyen Âge. Il a été obtenu en chauffant du sulfate de cuivre hydraté ou de l'acide sulfurique avec du nitrate de sodium (salpêtre ou nitre) et en refroidissant les vapeurs générées pour obtenir une solution d'acide nitrique. Au 13ème siècle, Albertus Magnus aurait utilisé de l'acide pour fabriquer de l'or et de l'argentles séparant les uns des autres : l'argent était dissous, tandis que l'or restait inchangé.
Alors qu'il est théoriquement possible d'obtenir 2 moles d'acide nitrique pour chaque mole d'acide sulfurique utilisé, la température de 900 °C requise rend cette stoechiométrie peu pratique. Cependant, l'indice d'acide résiduel du "gâteau de nitre" pourrait être utilisé pour fabriquer de l'acide chlorhydrique à partir de sel.
Pour les engrais azotés et pour les besoins en acide nitrique pour la fabrication d'explosifs au 19ème siècle, le nitrate de sodium (ou de potassium) naturel constituait la seule source.
La production actuelle d'acide nitrique se fait presque entièrement par l'oxydation de l'ammoniac et l'absorption des produits d'oxydation dans l'eau. La chimie de ce procédé a été prouvée expérimentalement par Kuhlmann en 1839, mais a dû attendre le développement d'une voie économique vers l'ammoniac avant qu'il ne devienne commercialement significatif.
Étymologie
Le terme salpêtre vient du latin sal petrae (sel de la roche). À l'origine, les sels d'acide nitrique (principalement le nitrate de sodium et de calcium) étaient grattés des pierres autour des tas de fumier et des latrines.
Synonymes, antonymes
Voir tous les synonymes pour "acide nitrique".5 synonymes (sens proche) de "acide nitrique" :
- aqua fortis
- eau forte
- esprit de nitre
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACIDE NITRIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE NITRIQUE est dans la page 2 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide minéral acide muginéique acide N-acétylmuramique acide N-acétylneuraminique acide nicotinique acide nitriqueacide nucléique acide oléique acide organique acide orotique acide oxalique
En rapport avec "acide nitrique"
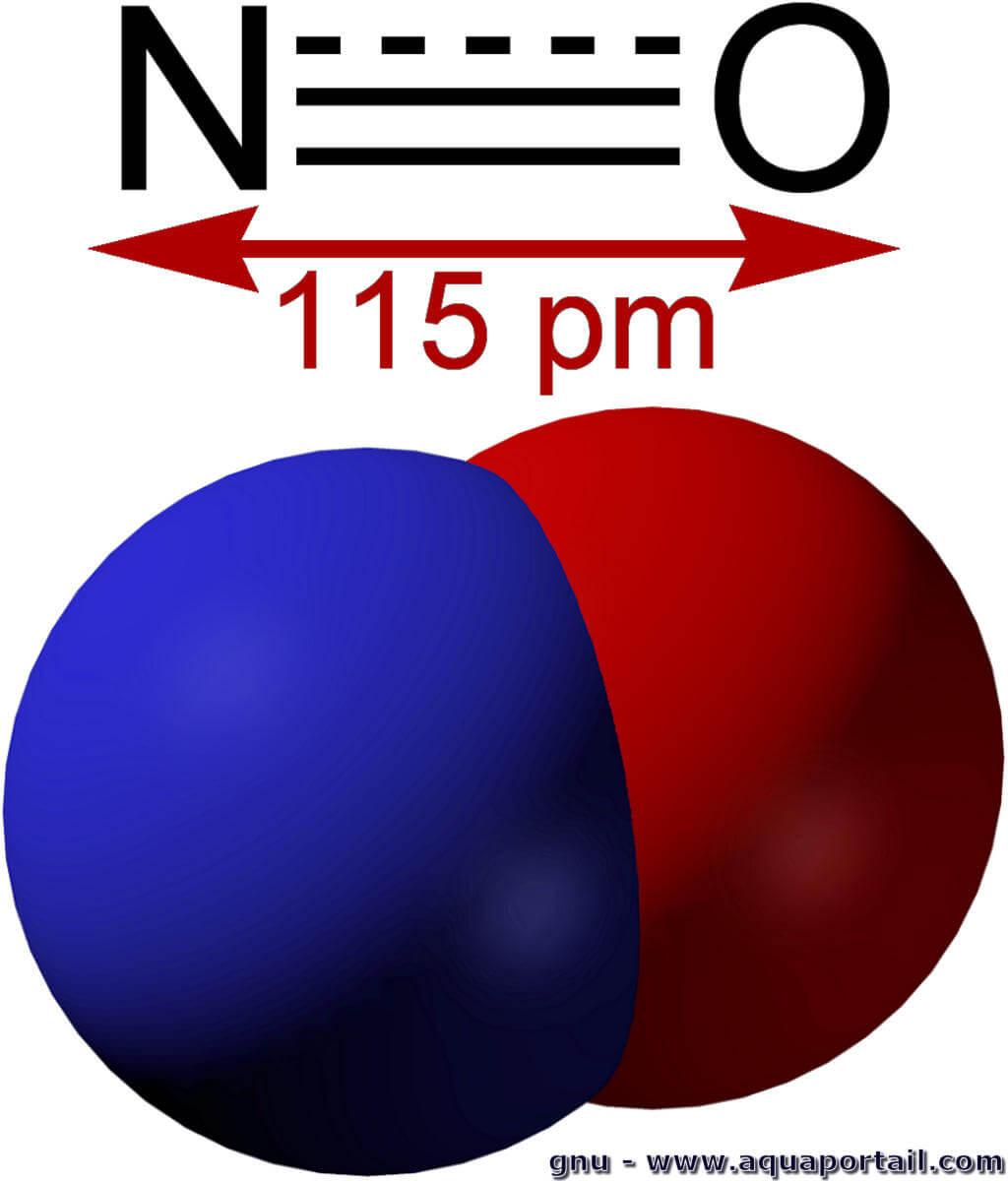
Un oxyde nitrique, ou le monoxyde d'azote NO, est un gaz incolore et hydrosoluble, présent en petites quantités chez les mammifères.

Un acide est une substance qui, lorsqu'elle est dissoute dans l'eau, produit une concentration accrue d'ions hydrogène.

L'acide 2,3-diphosphoglycérique, anciennement appelé diphosphoglycérate (DPG), est un métabolite intermédiaire du glucose synthétisé à partir de l'acide...
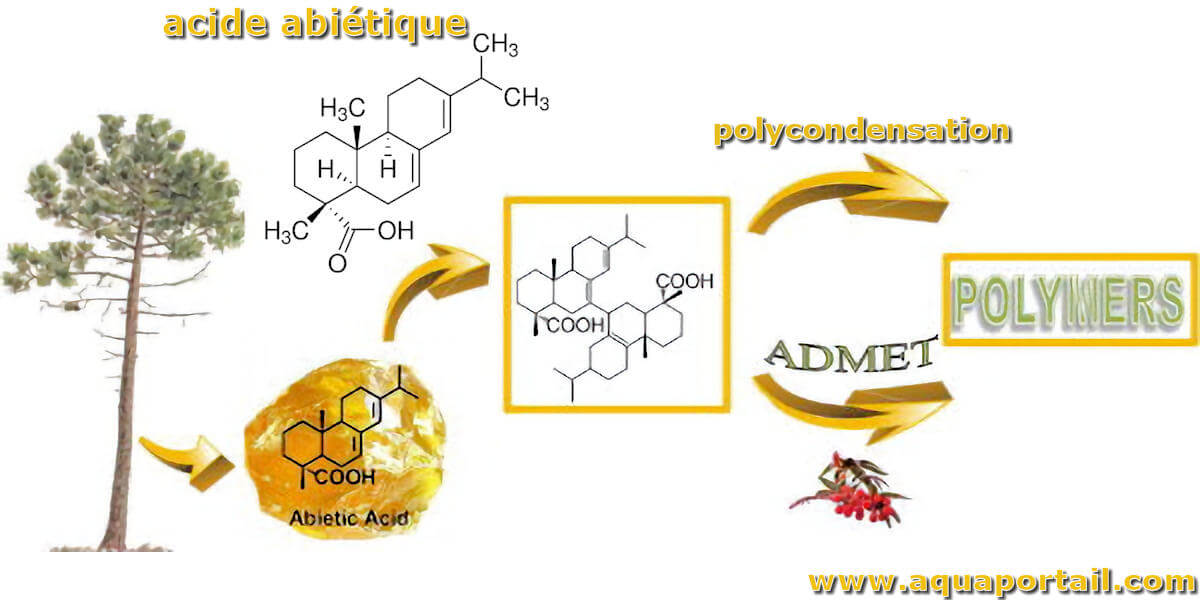
L'acide abiétique est une substance cristalline incolore obtenue à partir de l'oléorésine de quelques Gymnospermes, notamment des pins.
