Acide chlorhydrique (HCl, chlorure d'hydrogène)
Définition
L'acide chlorhydrique est une solution aqueuse incolore et fortement acide de chlorure d'hydrogène gazeux (HCl) dans l'eau. Il est composé d'ions hydronium H3O+ et d'ions chlorure Cl-. Il a une odeur âcre et irritante et produit des vapeurs irritantes.
L'acide chlorhydrique est un monoacide naturel produit dans l'estomac des mammifères pour faciliter la digestion. Chez l'Homme, on le trouve dans le suc gastrique (qui est aussi l'acide gastrique), où il aide à décomposer les aliments.
Une solution d'acide chlorhydrique :
L'acide chlorhydrique est produit industriellement en dissolvant du chlorure d'hydrogène gazeux dans l'eau. En tant que solution corrosive et acide, l'acide chlorhydrique a plusieurs applications dans la fabrication et la transformation de divers produits.
Explications
Le poids moléculaire de l'acide chlorhydrique est de 36,47 g/mol. Il se présente sous la forme d'une solution aqueuse ou d'un gaz incolore et ininflammable. L'acide chlorhydrique a une odeur irritante et piquante, avec un seuil olfactif d'environ 7 mg/m.
Biologiquement, l'acide chlorhydrique joue un rôle important dans la digestion. Composant du suc gastrique dans l'estomac des mammifères, il donne à l'acide gastrique un volume normal compris entre 20 et 100 ml avec un pH acide compris entre 1,5 et 3,5.
Dans l'organisme, l'acide chlorhydrique est produit par les cellules pariétales qui libèrent des ions hydrogène et chlore. L'acide chlorhydrique est particulièrement important pour maintenir le pH nécessaire à l'activation de la pepsine, la principale enzyme digestive essentielle à la digestion des protéines.
Utilisations
Industriellement, l'acide chlorhydrique est produit en dissolvant du chlorure d'hydrogène gazeux dans de l'eau. En ce qui concerne les applications industrielles, l'acide chlorhydrique a divers rôles essentiels qu'il joue, du maintien des piscines au pH optimal à la production de composés inorganiques et organiques.
Voici quelques-unes des utilisations pratiques de l'acide chlorhydrique dans les industries :
- Traitement ou fabrication de matières organiques : de nombreux composés organiques, comme le dichloroéthane et le chlorure de vinyle, nécessitent de l'acide chlorhydrique comme réactif. Par exemple, le chlore dans les plastiques polymères, comme le polychlorure de vinyle (PVC), provient de la polymérisation du chlorure de vinyle monomère. Une voie de production de monomères de chlorure de vinyle passe par la réaction exothermique de l'acétylène avec du chlorure d'hydrogène gazeux anhydre en présence de chlorure mercurique comme catalyseur. L'équation chimique équilibrée est : C2H2 + HCl → CH2=CHCl.
- tampon chimique : De nombreux types de processus de fabrication nécessitent que les niveaux de pH soient maintenus dans une certaine plage. L'acide chlorhydrique sert de tampon dans ces cas. Les produits pharmaceutiques, les aliments transformés et l'eau potable propre ont besoin d'acide chlorhydrique à une ou plusieurs étapes de traitement.
- Maintien du niveau de pH des piscines : l'acide chlorhydrique est également utilisé pour réguler le pH dans les piscines, où le niveau de pH de l'eau doit être maintenu dans une plage légèrement alcaline comprise entre 7,2 et 7,6. L'hypochlorite de sodium, un alcali, est régulièrement ajouté aux piscines pour les désinfecter. Mais son alcalinité fait qu'il peut facilement devenir excessif et irritant pour la peau des baigneurs. Le niveau de pH de l'eau peut ainsi être abaissé en ajoutant du HCl.
- sel de table purifiant : Le chlorure de sodium, le sel de table commun, est abondant dans la nature. Le sel a une concentration d'environ 2,68 % dans l'eau de l'océan, mais peut également être extrait sur terre sous forme de dépôts épais provenant de l'évaporation des océans préhistoriques. Cependant, il existe plusieurs impuretés de substances alcalines qui doivent être éliminées, et cela se fait avec l'utilisation de HCl.
- Décapage de l'acier : avant que les métaux puissent être traités, ils doivent subir un traitement de surface appelé décapage, qui élimine toutes les impuretés telles que la rouille, le tartre d'oxyde de fer, les taches et autres contaminants. L'acide chlorhydrique est un agent de décapage courant et efficace en raison de sa corrosivité - mais cela signifie également qu'il ne peut être utilisé que sur les nuances d'acier au carbone, car il pourrait tacher ou corroder les nuances d'acier inoxydable.
- Traitement du cuir : L'industrie du tannage du cuir utilise de l'acide chlorhydrique pour empêcher la croissance de bactéries sur le cuir, ainsi que pour maintenir son pH. Cela aide à empêcher la décomposition de survenir.
- Production de composés inorganiques : L'acide chlorhydrique réagit facilement avec les substances alcalines et autres produits chimiques. Ces réactions forment des composés, tels que l'acide ferrique et le chlorhydrate d'aluminium, qui peuvent ensuite être utilisés dans le traitement de l'eau.
- Aide à la production de puits de pétrole : le HCl est également utilisé en grande quantité dans l'industrie pétrolière, où il est appliqué dans le forage pour dissoudre les minéraux de la roche, ce qui facilite le forage.
- Traitement des additifs alimentaires : L'acide chlorhydrique est utilisé dans le traitement de divers additifs alimentaires tels que le fructose, l'acide citrique et les protéines végétales hydrolysées.
Par exemple, l'acide chlorhydrique est utilisé pour maintenir le pH des piscines.
Formule chimique
L'acide chlorhydrique est un acide inorganique composé de seulement deux éléments : l'hydrogène et le chlore. Il a la formule chimique simple HCl, le chlorure d'hydrogène. Il ne devient un acide que lorsqu'il est dissous dans l'eau (solution aqueuse). Lorsqu'elle est dissoute dans l'eau, la formule peut être écrite comme HCl(aq).
S'il n'est pas dissous dans l'eau, l'acide chlorhydrique est simplement connu sous le nom de chlorure d'hydrogène. Dans cet état, c'est un gaz incolore à température ambiante. Le nom officiel IUPAC de l'acide chlorhydrique est le chlorane, mais il est également connu sous de nombreux autres noms, notamment l'acide muriatique, l'esprit de sel, le chlorure d'hydronium et l'acide chlorhydrique.
Dans une solution aqueuse, l'ion chlore négatif se dissocie de l'ion hydrogène positif. L'hydrogène supplémentaire se combine ensuite avec la molécule d'eau, formant un groupe d'ions positifs constitué d'un atome d'oxygène central entouré de trois hydrogènes. Cela forme une structure ionique tétraédrique connue sous le nom d'eau protonée, avec la formule ionique H3O+.
Une étude combinant la diffraction infrarouge, Raman, rayons X et neutronique a révélé que l'acide chlorhydrique concentré forme H5O2+ comme cation dominant. Ce cation et les anions chlorure sont liés par une liaison hydrogène aux molécules d'eau voisines de diverses manières.
pH de HCl
Tout comme les autres types d'acides, le pH de l'acide chlorhydrique varie en fonction de la concentration. Par exemple, l'acide chlorhydrique disponible dans le commerce a un pH compris entre 1 et 2 à la concentration de 31,45 %.
La vraie mesure de la force d'un acide est la constante de dissociation, ou pKa. C'est le rapport entre le nombre d'ions et le nombre de molécules d'une substance dans une solution aqueuse. La formule s'écrit :
La formule pour trouver le contenu de dissassociation, ou la force d'un acide : Ka = ([A-][H+]) / [HA], où Ka = constante de dissociation acide; [A-] = concentration de la base conjuguée de l'acide; [H+] = concentration en ions hydrogène; [HA] = concentration des espèces chimiques HA.
Plus le pKa est bas, plus il est facile pour une solution acide de céder ou de donner des protons. Cela signifie que l'acide est essentiellement un donneur de protons. Le niveau d'acidité de l'acide chlorhydrique est relativement élevé. Lorsque le chlorure d'hydrogène est dissous dans l'eau, la constante d'acidité ou pKa est de -5,9.
Lorsque le chlorure d'hydrogène gazeux devient de l'acide chlorhydrique, il a plus tendance à se dissocier complètement en ions que les acides plus faibles. En tant qu'acide fort, HCl peut facilement perdre ses ions hydrogène, qui sont ensuite remplacés par d'autres éléments. Il dissout de nombreux types de métaux, y compris le fer, en libérant le gaz hydrogène de la solution. Ce processus est exothermique.
Voici une liste d'autres acides forts :
- acide perchlorique (HClO4);
- acide bromhydrique (HBr);
- acide iodhydrique (Hl);
- acide nitrique (HNO3);
- acide sulfurique (H2SO4).
Synonymes, antonymes
Voir tous les synonymes pour "acide chlorhydrique".6 synonymes (sens proche) de "acide chlorhydrique" :
- acide muriatique
- chlorane
- chlorure d'hydrogène
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à ACIDE CHLORHYDRIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE CHLORHYDRIQUE est dans la page 1 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide butanedioïque acide butyrique acide carbonique acide carboxylique acide cérébronique acide chlorhydriqueacide cholique acide chromique acide citrique acide clavulanique acide cyanhydrique
En rapport avec "acide chlorhydrique"
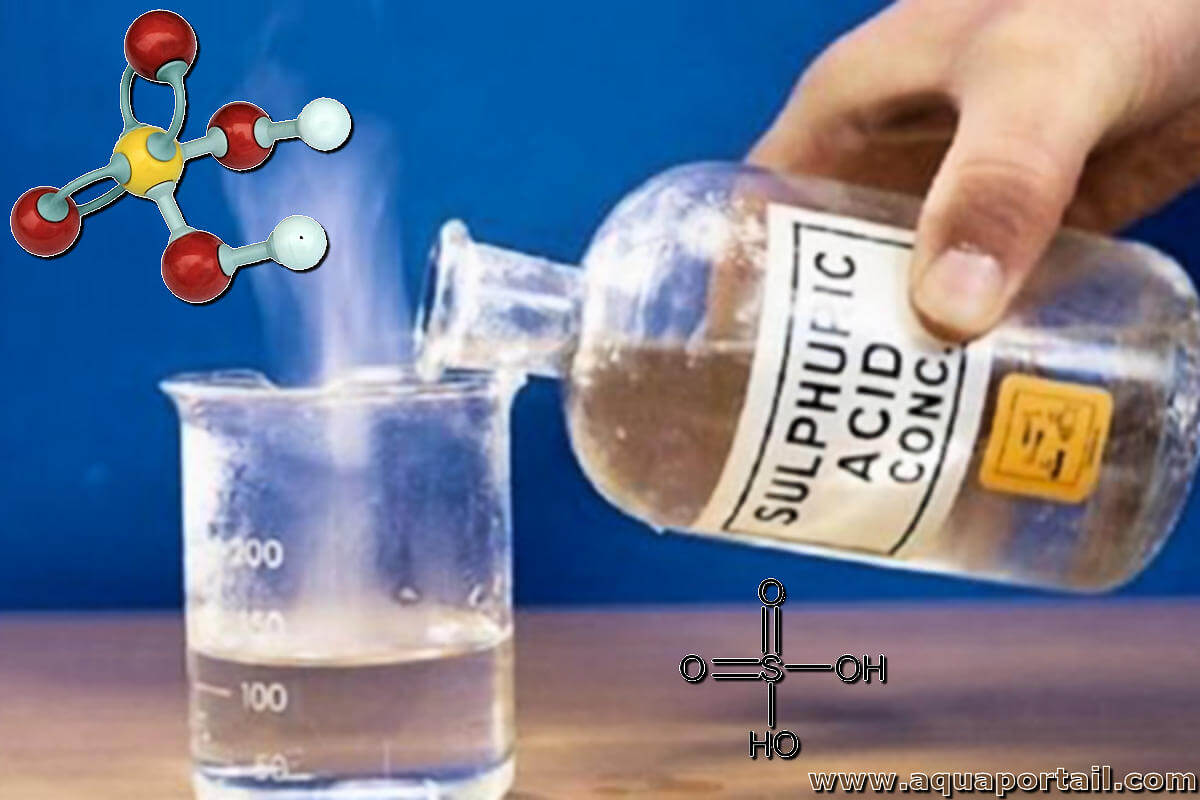
L'acide sulfurique est un composé acide extrêmement corrosif dont la formule est H₂SO₄.
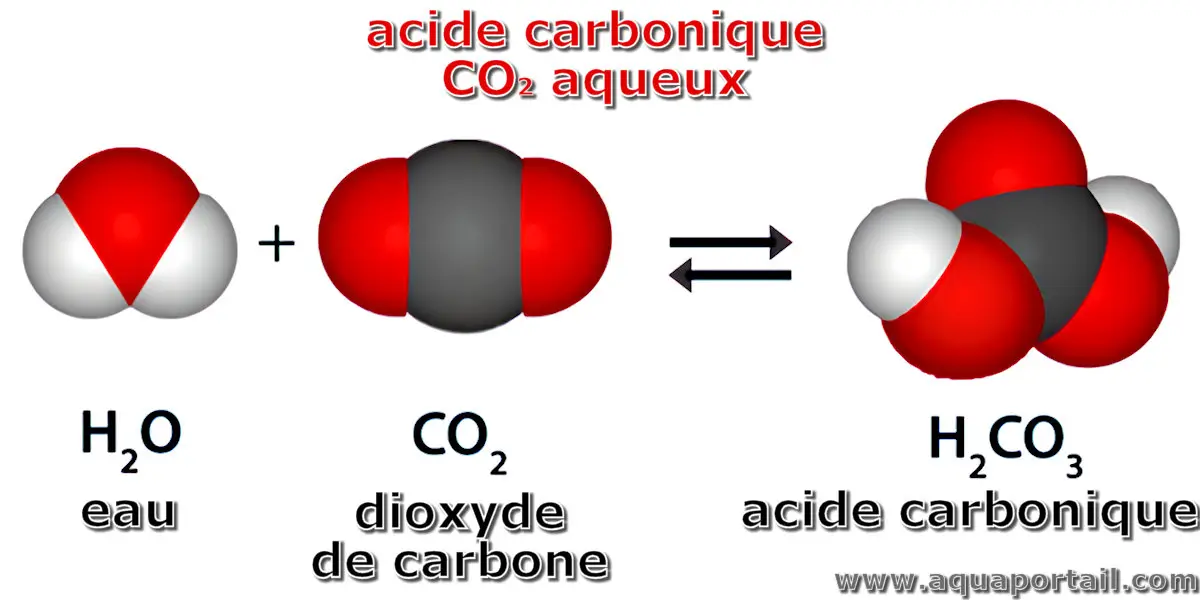
L'acide carbonique est du dioxyde de carbone CO2 aqueux qui est un acide faible de formule H₂CO₃.

Les acides carboxyliques sont des composés organiques qui portent un ou plusieurs groupes carboxyles (−COOH) et présentent donc un caractère acide plus...

L'acide cholique est un acide biliaire primaire naturel qui représente un composant majeur du pool total d'acides biliaires chez l'homme, le plus abondant...
