Force d'un acide
Définition
La force d'un acide est la possibilité, pour un acide, de perdre un proton facilement. Un acide fort est celui qui se dissocie complètement dans l'eau; en d'autres termes, une mol d'un acide fort HA est dissous dans de l'eau pour produire une mole de H+ et d'une mole de sa base conjuguée, A-, et aucun de l'acide protoné HA. La force d'un acide faible est quantifiée par sa constante de dissociation acide, pKa.
En revanche, un acide faible n'est que partiellement dissocié et, à l'équilibre, la solution existe à la fois pour l'acide et sa base conjuguée. La force d'un acide définit l'acidité d'une solution. La dissociation d'un acide fort en solution est effectivement complète, sauf dans ses solutions les plus concentrées.
Classement d'acides en fonction de leur force :
classements de produits chimiques selon leur d'acide dans des flacons (y compris l'hydroxyde d'ammonium et l'acide nitrique) éclairés de différentes couleurs
Exemples
Des exemples d'acides forts sont l'acide chlorhydrique (HCl), l'acide iodhydrique (HI), l'acide bromhydrique (HBr), l'acide perchlorique (HClO4), l'acide nitrique (HNO3) et l'acide sulfurique (H2SO4). Chacun des éléments chimiques de l'eau se ionise pratiquement à 100 %. Plus fort est un acide, plus il perd facilement un proton H+. Deux facteurs clés qui contribuent à la facilité de déprotonation sont la polarité de la liaison HA.
Explications
La force des acides habituellement est également discutée en termes de la stabilité de la base conjuguée. Les acides plus forts ont un K supérieur, Kp inférieur à celui des acides plus faibles.
Les acides alkylsulfoniques et arylsulfoniques qui sont des oxyacides organiques, sont un type d'acides forts. Un exemple courant est l'acide toluène sulfonique (acide tosique ou tosyle). À la différence du même acide sulfurique, les acides sulfoniques peuvent être solides. En effet, le polystyrène (sulfonate de polystyrène) est une matière plastique solide fortement acide, qui est filtrable.
Superacide
Les superacides sont plus forts que l'acide sulfurique à l'acide à 100 %. Des exemples de superacides sont l'acide fluoroantimonique, l'acide magique et l'acide perchlorique. Les superacides peuvent en permanence "protoner" l'eau, pour produire des "sels" d'oxonium, un ion cristallin. Ils peuvent également stabiliser quantitativement les carbocations.
Le nombre d'atomes électronégatifs adjacents qui lient un acide affecte également la force de l'acide. Les oxyacides ont la formule générale HOX, où X peut être un atome quelconque et peut ou non partager des liaisons avec d'autres atomes. En augmentant le nombre d'atomes ou de groupes électronégatifs sur l'atome X, la densité électronique décroît la force de la liaison acide, ce qui provoque la perte de protons plus aisément.
Force d'un acide organique
La force d'un acide organique faible peut dépendre des effets des substituants. La force d'un acide inorganique dépend de l'état d'oxydation de l'atome auquel le proton peut se lier. La force de l'acide dépend du solvant. Par exemple, le chlorure d'hydrogène est un acide fort en solution aqueuse, mais c'est un acide faible lorsqu'il est dissous dans de l'acide acétique glacial.
Mesures de la force de l'acide
La mesure habituelle de la force d'un acide est sa constante de dissociation acide (Ka), qui peut être déterminée expérimentalement par des méthodes de titrage. Les acides plus forts ont un Ka plus élevé et une constante logarithmique plus petite (pKa = -log Ka) que les acides plus faibles. Plus un acide est fort, plus il perd facilement un proton, H+. Deux facteurs clés qui contribuent à la facilité de déprotonation sont la polarité des liaisons. H-A et la taille de l'atome A, qui déterminent la force de la liaison H-A. Les concentrations d'acide dépendent également de la stabilité de la base conjuguée.
Tandis que la valeur de pKa mesure la tendance d'un soluté acide à transférer un proton vers un solvant standard (le plus souvent de l'eau ou du DMSO), la tendance d'un solvant acide à transférer un proton vers un soluté de référence (le plus souvent une base d'aniline faible) est mesurée par sa fonction d'acidité de Hammett, la valeur H0. Bien que ces deux concepts de force acide correspondent souvent à la même tendance générale d'une substance à donner un proton, les valeurs de pKa ou H0 sont des mesures de propriétés différentes et peuvent parfois diverger. Par exemple, le fluorure d'hydrogène, qu'il soit dissous dans l'eau (pKa = 3,2) ou DMSO (pKa = 15), les valeurs pKa indiquant qu'il subit une dissociation incomplète dans ces solvants, ce qui en fait un acide faible. Cependant, en tant que milieu acide propre et rigoureusement sec, le fluorure d'hydrogène a une valeur H0 de -15, ce qui en fait un moyen de protonation plus puissant que l'acide sulfurique à 100 %, et donc par définition un superacide.
Pour éviter toute ambiguïté, dans la suite de cet article, "acide fort" fera référence, sauf indication contraire, à un acide fort tel que mesuré par son pKa (pKa ← 1,74). Cet usage est conforme au langage courant de la plupart des chimistes en exercice.
Lorsque le milieu acide considéré est une solution aqueuse diluée, le H0 est approximativement égale à la valeur du pH, qui est un logarithme négatif de la concentration de H+ en solution aqueuse. Le pH d'une solution simple d'un acide dans l'eau est déterminé à la fois par Ka et la concentration en acide. Pour les solutions d'acides faibles, cela dépend du degré de dissociation, qui peut être déterminé par un calcul d'équilibre. Pour les solutions concentrées d'acides, en particulier les acides forts dont le pH < 0, la valeur H0 est une meilleure mesure de l'acidité que le pH.
Synonymes, antonymes
Voir tous les synonymes pour "force d'un acide".0 synonyme (sens proche) pour "force d'un acide".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à FORCE D'UN ACIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression FORCE D'UN ACIDE est dans la page 3 des mots en F du lexique du dictionnaire.
Mots en F à proximité
fontinal forage foramen foraminifère forçage force d'un acideforce d'une base force de van der Waals force électrostatique force génératrice de la marée force motrice
En rapport avec "force d'un acide"
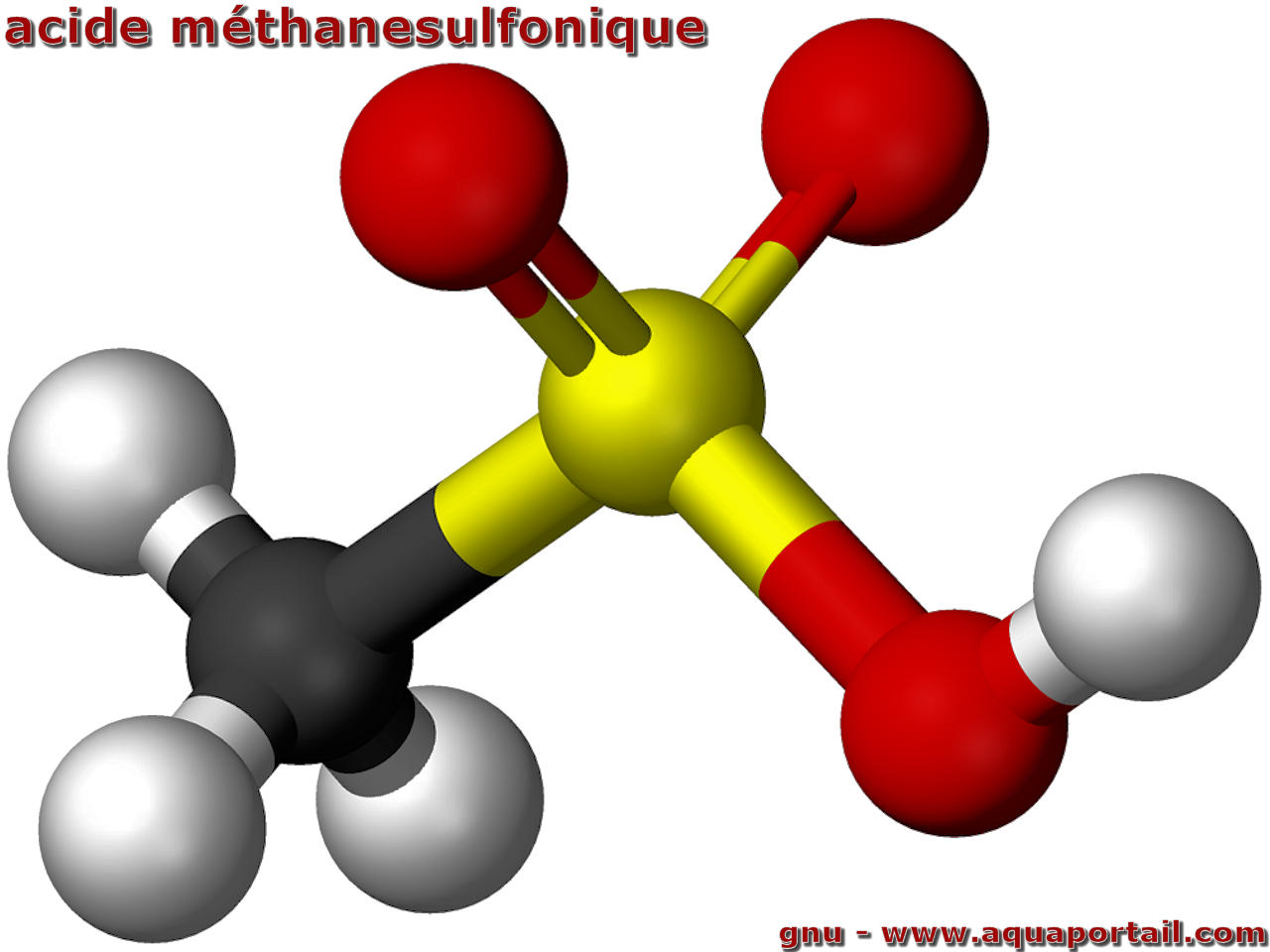
L'acide méthanesulfonique (acide méthylsulfonique) est un alcane d'acide sulfonique dans lequel le groupe alkyle directement lié à la fonctionnalité sulfo...
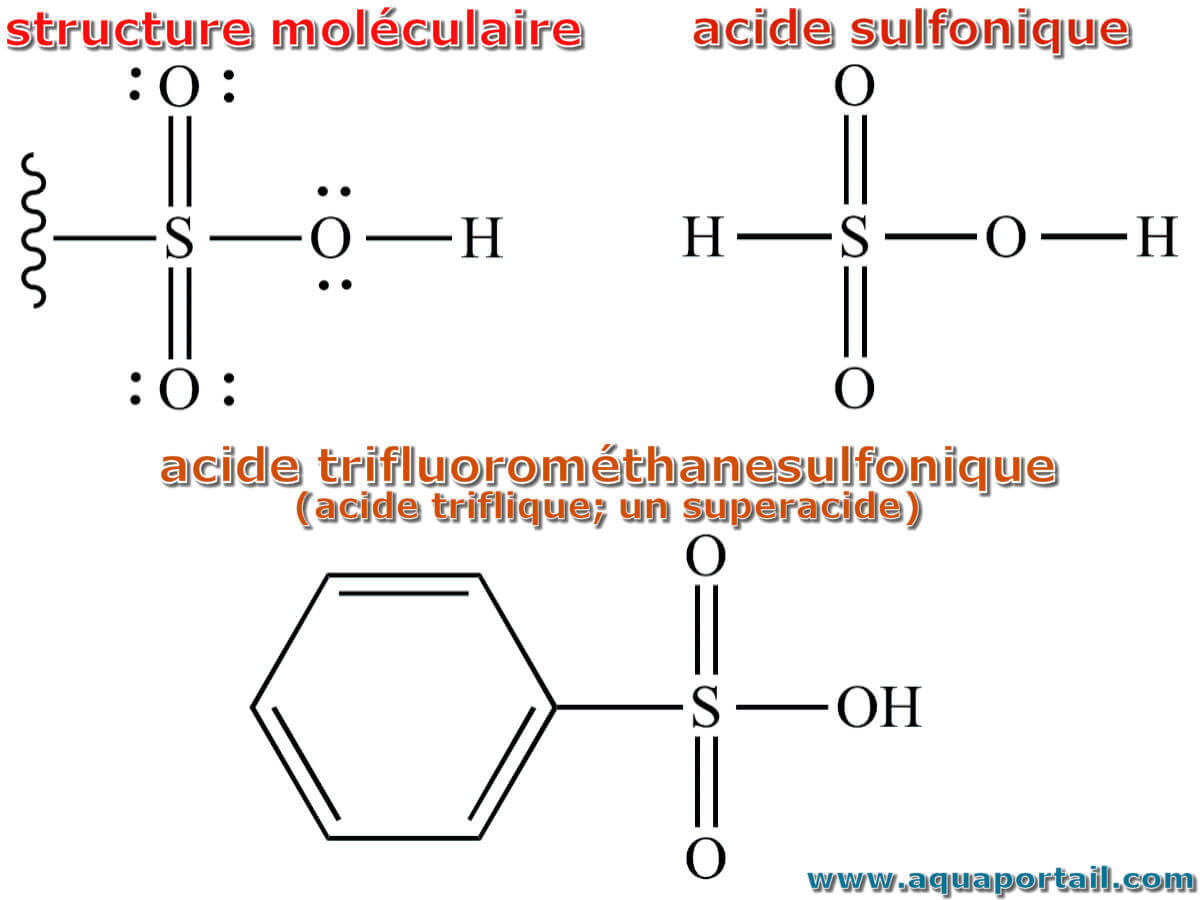
L'acide sulfonique est un acide fort avec un groupe fonctionnel caractérisé par un atome de soufre doublement lié à deux atomes d'oxygène, un groupe hydroxyle...

La force d'une base se définit par l'opposé de l'acidité d'un acide, et est le contraire de la force d'un acide.

Un acide est une substance qui, lorsqu'elle est dissoute dans l'eau, produit une concentration accrue d'ions hydrogène.
