Déprotonation
Définition
La déprotonation est la lysation d'un cation hydrogène (hydron H+) à partir d'une espèce chimique (molécule ou ion). Un ion hydrogène avec une charge électrique positive est généralement appelé proton, car il se compose uniquement d'un proton. Elle peut suivre un protonation, ou être précédée d'une reprotonation.
En général, cette réaction se produit lorsqu'une base est combinée à une substance qui peut dégager des ions hydrogène (acides intrinsèques). Ainsi, la déprotonation retire un proton H+ d'une molécule, ce qui va former sa base conjuguée.
Schémas des réaction de déprotonation :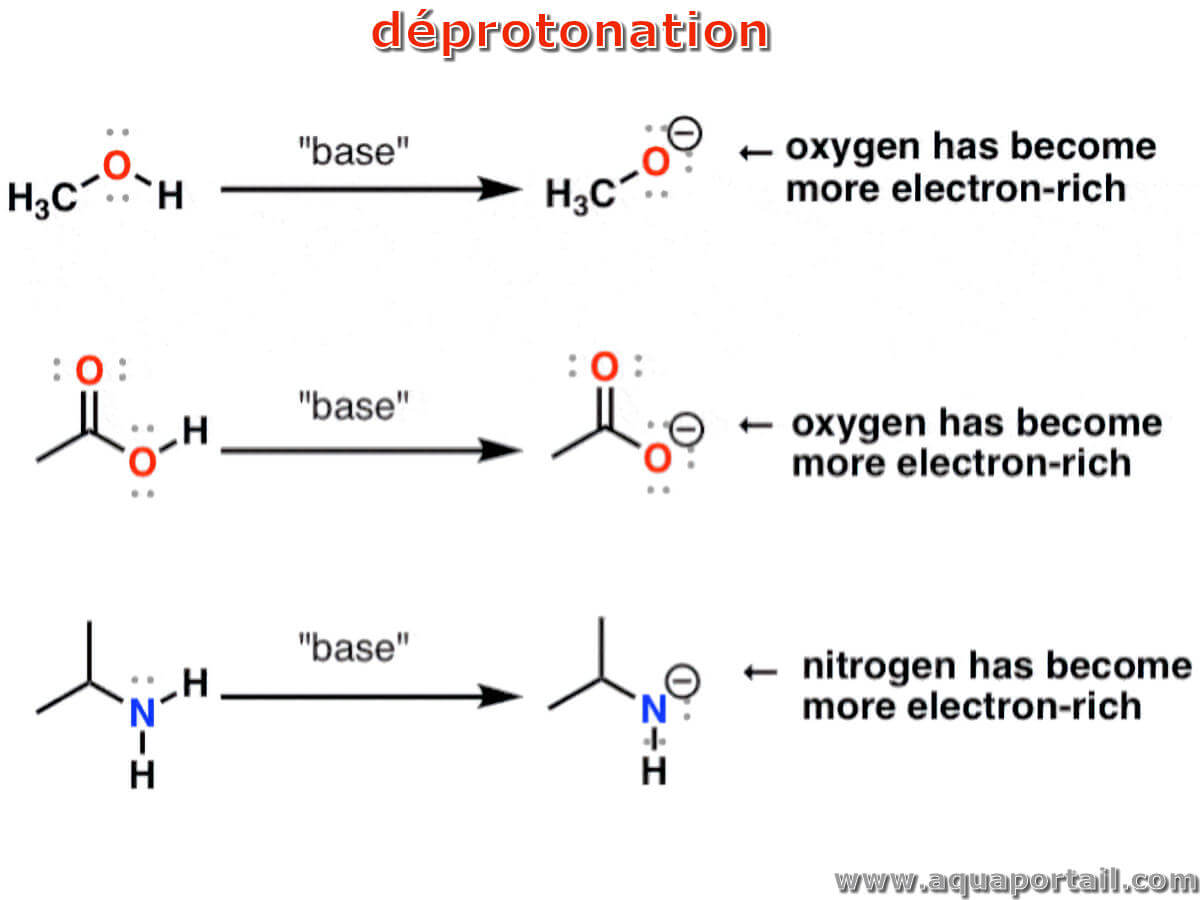
La déprotonation (ou déshydronation) est l'élimination par transfert d'un proton (hydron) d'un acide de Brønsted-Lowry dans une réaction acide-base (théorie acide-base de Brønsted-Lowry)..
Explications
La déprotonation est un terme en chimie qui fait référence à l'élimination d'un hydron d'une molécule,formant la base conjuguée. La capacité relative d'une molécule à produire un proton est mesurée par une valeur de pKa. Une faible valeur de pK indique que le composé est acide et qu'il donnera facilement ce proton à une base. Le pKa d'un composé est déterminé par beaucoup de choses, mais plus significativement est affecté par la capacité (ou l'incapacité) de la base à stabiliser la charge négative par résonance.
Les bases utilisées pour déprotoner dépendent du pKa du composé. Lorsque le proton n'est pas particulièrement acide,et en tant que tel, la molécule ne produit pas facilement ce proton, une base plus forte que la souche d'hydroxyde connue est nécessaire. Les hydrures sont l'un des nombreux types d'agents protonants puissants. Les hydrures couramment utilisés sont l'hydrure de sodium et l'hydrure de potassium. Ces bases sont si puissantes en raison de l'hydrure formant de l'hydrogène sous forme de gaz lorsque le proton d'autres molécules est éliminé.
Cependant, la production d'hydrogène signifie également que la déprotonation à l'aide de réactifs réagissant à l'hydrogène est dangereuse et que de telles réactions doivent être effectuées sous atmosphère inerte (par exemple l'azote)car l'eau est une source de protons qui est présente dans l'air environnant de la réaction tout le temps et peut réagir avec l'hydrure au lieu de la molécule souhaitée et enflammer le dispositif.
Racémisation
La déprotonation du carbone de l'acide aminé conduit à la tautomérisation de la base de Schiff pour donner une cétimine quinonoïde. La réaction la plus simple que la cétimine puisse subir est la reprotonation sur le carbone désormais symétrique. Le déplacement du substrat par le résidu lysine réactif conduit au mélange racémique d'acides d- et l-aminés. C'est la racémisation de la vitamine B6.
Les racémases d'acides aminés sont connues depuis longtemps pour être importantes dans le métabolisme bactérien, car plusieurs acides aminés D sont nécessaires à la synthèse des mucopolysaccharides de la paroi cellulaire. Le d-aspartate et la d-sérine sont des neurotransmetteurs chez les mammifères, le d-aspartate joue un rôle dans la signalisation pendant le développement du cerveau, et il existe des racémases dans l'hypothalamus et d'autres régions du cerveau.
Théorie acide-base de Brønsted-Lowry
Selon la théorie acide-base de Brønsted-Lowry, la déprotonation a lieu lorsque des acides plus forts que l'eau sont introduits dans une solution (aqueuse). L'acide est déprotoné, puis agit comme un donneur de protons. L'eau agit comme un accepteur de protons : elle est protonée en un ion hydroxonium. Un exemple est la déprotonation de l'acide acétique (pKa = 4,75) dans l'eau (pKa = 15) : CH3COOH + H2O ⇌ CH3COO- + H3O+.
La déprotonation peut également avoir lieu lorsqu'une base est amenée dans un environnement aqueux. La base agit alors comme un accepteur de protons. L'eau, à son tour, libère un proton, formant un ion hydroxyde. Un exemple est la déprotonation de l'eau (pKa = 15) par l'ammoniac (pKa = 35) : NH3 + H2O ⇌ NH4+ + OH-.
Dans l'exemple ci-dessus, la réaction acide-base (acido-basique) de Brønsted-Lowry est élaborée pour les solutions aqueuses, mais en (en particulier) la chimie organique synthétique, des bases solides telles que le butoxyde de tert de potassium, l'amide de sodium, le di-isopropylamide de lithium et le n-butyllithium sont utilisées pour extraire l'hydrogène de toutes sortes de composés carbonés.
Synonymes, antonymes
Voir tous les synonymes pour "déprotonation".1 synonyme (sens proche) de "déprotonation" :
- déshydronation
2 antonymes (sens contraire) :
- protonation
- reprotonation
Les mots ou les expressions apparentés à DÉPROTONATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot DEPROTONATION est dans la page 1 des mots en D du lexique du dictionnaire.
Mots en D à proximité
dépôts acides déprédateur dépression dépression consanguine dépression endogamique déprotonationdepside dépuratif dépurination dérépressiondérivatisation
En rapport avec "déprotonation"

Une acétylation est un transfert d'un groupe acétyle CH₃-CHO sur une molécule réceptrice.

L'acétylation des histones signifie la suppression de la charge positive de la molécule d'histone, ce qui affaiblit l'interaction entre les groupes phosphate...
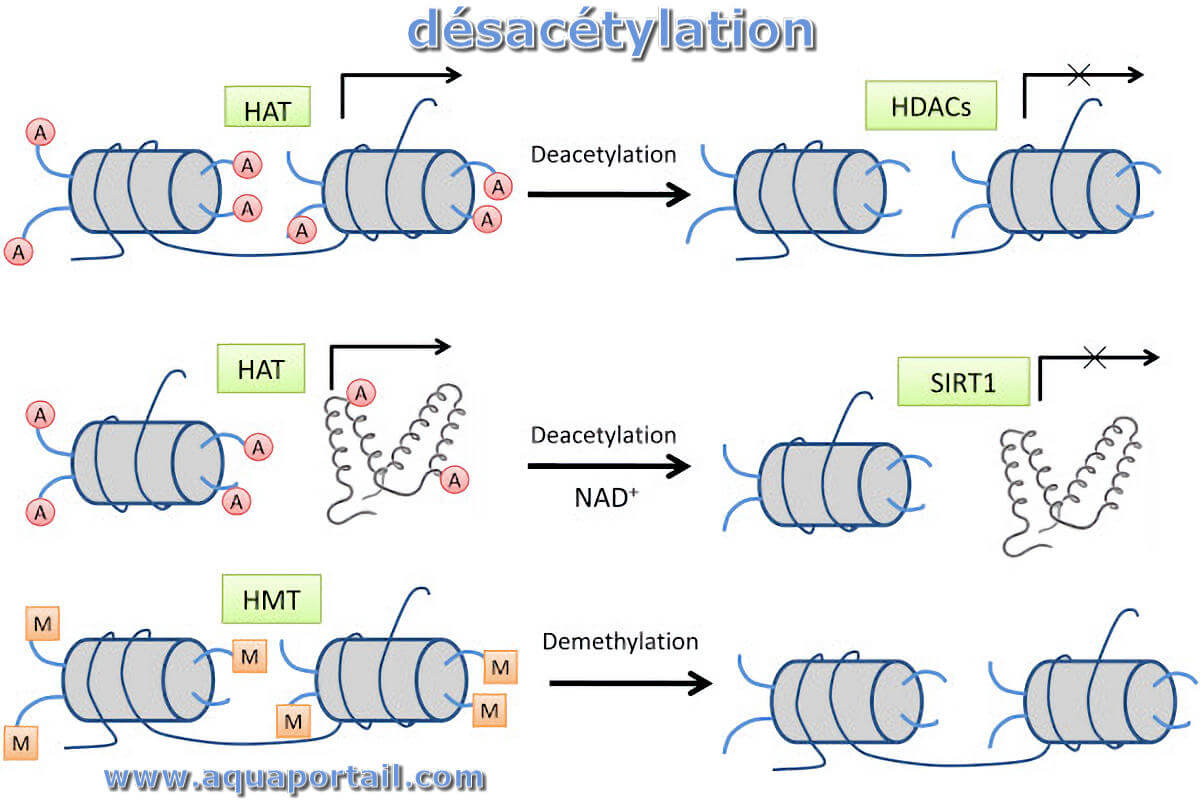
La désacétylation est le processus d'élimination des groupes acétyle de la chitine et de substitution des groupes amino réactifs (liaison simple NH₂).

Un proton est une particule subatomique avec une charge électrique élémentaire positive, égale en valeur absolue et en signe opposé à celle de l'électron.
