Sérine
Définition
La sérine (Ser) est un acide aminé non essentiel sur le plan nutritionnel, mais elle est essentielle à la production de protéines, d'enzymes et de tissus musculaires. Elle est synthétisée à partir de l'acide 3-phosphoglycérique.
Structure de la sérine :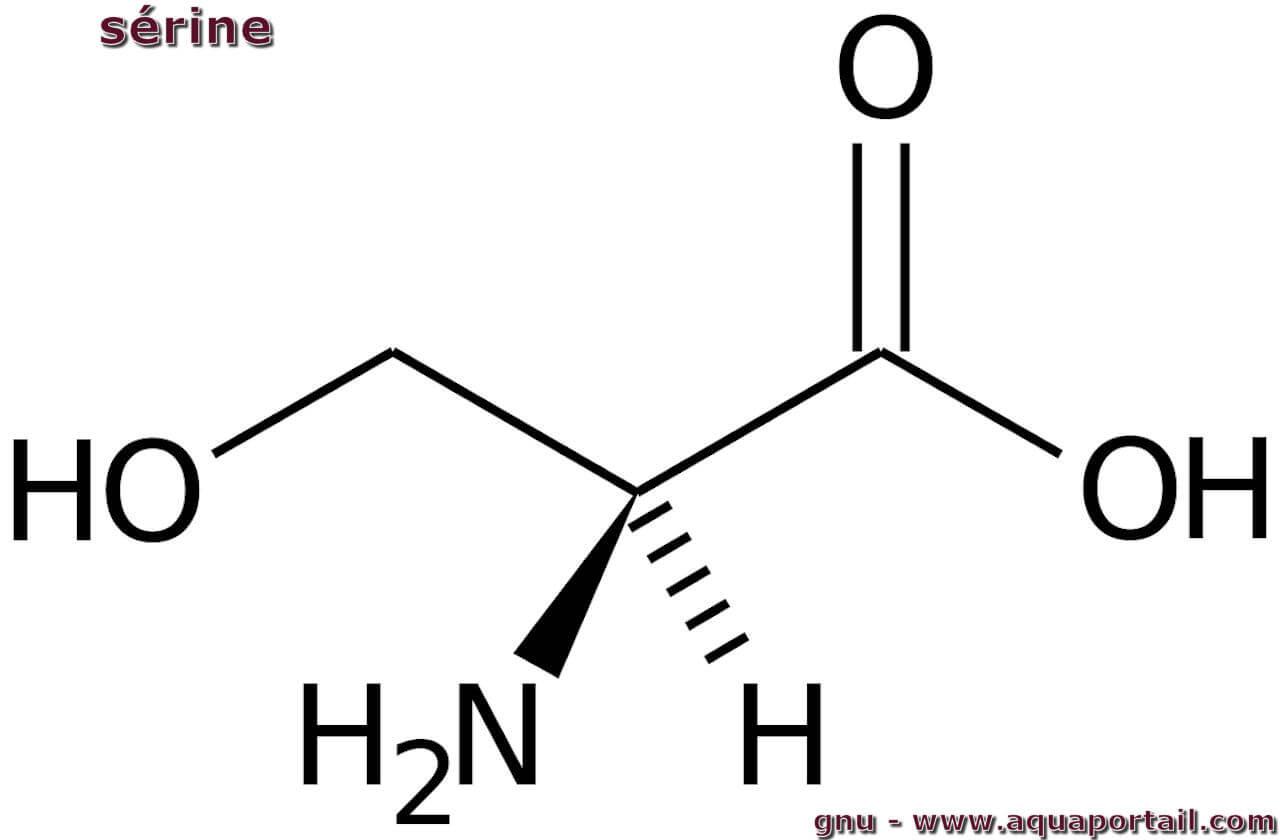
La sérine est un acide aminé polaire non essentiel, élément fondamental des protéines, et joue un rôle essentiel dans la santé cérébrale, le fonctionnement du système immunitaire et la récupération musculaire. Les codons correspondants à la sérine sont : AGC, AGU, UCA, UCC, UCG, UCU. Sa formule chimique est CH2OH-CH(NH2)-COOH (acide 2-amino-3-hydroxypropanoïque).
Explications
La sérine est l'un des vingt composants acides aminés de biosynthèse des protéines codées par le génome. Toutefois, elle appartient au groupe des 11 acides aminés non essentiels. Par décarboxylation, elle donne l'éthanolamine constitutive des céphalines. En se combinant au palmitylcol, elle forme la sphingosine.
Dans le cas d'une protéase, voir aussi la sérine protéase.
Naturellement présente dans des aliments comme le soja, les noix, les oeufs et la viande, la sérine peut également être synthétisée par l'organisme. Elle est essentielle à la production de phospholipides, de neurotransmetteurs et de diverses molécules critiques. De plus, la sérine participe à de nombreux processus biologiques tels que la modification des protéines et le maintien de la structure des membranes cellulaires.
Propriétés
Le stéréoisomère naturel de la sérine est L (formule C3H7NO3). En plus de posséder toutes les propriétés communes aux acides α-aminés, elle possède un groupe hydroxyle en position 3 : elle est donc classée comme acide aminé polaire.
La sérine est un acide aminé non essentiel (neutre), ce qui signifie qu'elle est nécessaire au bon fonctionnement du corps humain, mais elle ne doit pas provenir d'une source externe (dans le régime alimentaire) puisque l'organisme est capable de la synthétiser de manière interne. Au lieu de cela, elle est généralement produite dans le corps à partir de métabolites tels que la glycine.
Seul le stéréoisomère L apparaît naturellement dans les protéines.
La sérine est un élément essentiel des phosphatidylsérines, un groupe de phosphoglycérides dans la bicouche lipidique de la membrane cellulaire.
Isosérine
L'isosérine est un acide α-hydroxy-β-aminé non protéinogène et un isomère de la sérine. Les acides aminés non protéinogènes ne forment pas de protéines et ne font partie du code génétique d'aucun organisme connu. L'isosérine n'a été fabriquée que synthétiquement.
La première synthèse documentée d'isosérine en laboratoire a été réalisée par Miyazawa et al., qui ont publié leurs résultats en 1976.
Origine
La sérine a été obtenue pour la première fois en 1865 à partir de protéines de soie, une source très riche en sérine. En fait, son nom est dérivé du terme latin pour soie, sericum qui donne la séricine, qui est collée à la soie brute de manière collante pour enlever les filaments et être enlevée pendant le déliantage. La structure de la sérine a été créée en 1902.
Le bâton enveloppant du fil de soie, que la larve du papillon de la soie Bombyx mori fait tourner autour du cocon, consiste en un tiers de sérine.
Stéréochimie
La sérine a un centre stéréogénique et possède donc deux énantiomères, le D–acide aminé D-sérine [synonyme : R(+)-sérine] et son image miroir, la L-sérine "naturelle". Le racémate DL-serine [synonyme : (RS)-sérine] consiste en parts égales de L- sérine et de D- sérine. Lorsque la sérine est mentionnée dans la littérature scientifique sans autre ajout, L-sérine est presque toujours synonyme.
La L-sérine racémique (partiellement) s'obtient plus facilement que les autres acides aminés protéinogènes. Par conséquent, de nombreuses préparations de L-sérine contiennent de petites quantités (0,5 à 3 %) de D-sérine.
Fonctions
À pH neutre, la sérine existe principalement sous forme de zwitterion, dont la formation peut s'expliquer par le fait que le proton du groupe carboxyle migre vers la paire d'électrons de l'atome d'azote du groupe amine.
Dans le champ électrique, le zwitterion ne migre pas car il n'est pas chargé dans son ensemble. Strictement parlant, c'est le cas au point isoélectrique (à un certain pH) où la sérine a également sa plus faible solubilité dans l'eau. Le point isoélectrique de la sérine est 5,68.
Tout comme tous les acides aminés à groupe OH (hydrophile, groupe hydroxyle), la sérine peut être phosphorylée et joue donc un rôle important dans l'activation ou l'inactivation des enzymes. De plus, il se trouve souvent dans le site actif des enzymes et joue donc un rôle important dans la biocatalyse : des exemples sont les sérine protéinases et leurs inhibiteurs, la serpine (inhibiteurs de la sérine protéinase).
La sérine joue un rôle important dans la fonction catalytique de nombreuses enzymes. Cela s'est avéré exister dans les sites actifs de la chymotrypsine, de la trypsine et de nombreuses autres enzymes. Il a été démontré que les gaz neurotoxiques et de nombreuses substances utilisées dans les insecticides agissent en se combinant avec un résidu sérine dans le site actif de l'acétylcholinestérase, ce qui génère l'inhibition totale de l'enzyme.
L'acétylcholinestérase dégrade l'acétylcholine, un neurotransmetteur qui est libéré aux jonctions nerveuses et musculaires afin de permettre au muscle ou à l'organe de se détendre. Le résultat de l'inhibition de l'acétylcholinestérase est que l'acétylcholine s'accumule et continue d'agir de sorte que toute impulsion nerveuse est transmise de manière continue et que les contractions musculaires ne s'arrêtent pas.
En tant que composant des protéines, sa chaîne latérale peut subir une O-glycosylation, dans laquelle il peut exister une relation fonctionnelle avec le diabète. C'est l'un des trois résidus d'acides aminés couramment phosphorylés par les kinases dans la signalisation cellulaire (protéines kinases, MAP kinases) chez les organismes eucaryotes.
Catabolisme
La sérine peut être catabolisée soit par :
- Amonolyse oxydative : On effectue une élimination de l'hydroxyle, une tautomérie de l'imine enamine et son hydrolyse ultérieure en pyruvate.
- Conversion réversible en glycérate : le passage irréversible du catabolisme est la phosphorylation du glycérate en 3-phosphoglycérate, qui peut être réincorporé dans la glycolyse ou la gluconéogenèse.
Biosynthèse
La sérine peut être synthétisée à partir de plusieurs voies, mais les deux qui donnent une biosynthèse nette de sérine sont :
- À partir des glycérates : soit du glycérate, soit du 3-phosphoglycérate (catabolite de la glycolyse), la sérine peut être biosynthétisée par deux alternatives : on oxyde l'hydroxyle de la position 2 du phosphoglycérate, formant ainsi le pyruvate 3-phosphate, qui est transaminé en phosphosérine pour l'hydrolyser ultérieurement; l'autre alternative consiste à oxyder l'hydroxyle de la position 2 du glycérate pour donner le 3-hydroxypyruvate, qui est transaminé en sérine.
- De la glycine : dans les plantes vertes, lorsque la photorespiration est effectuée, le chloroplaste absorbe le dioxygène O2, qui est catalysé avec le ribulose-1,5-bisphosphate (RuBP) par l'enzyme Rubisco; la transformer en acide glycolique ou glycolate. Le glycolate est transféré au peroxysome (sac membraneux contenant des enzymes) et, sous l'action de l'O2, ils sont catalysés par l'enzyme oxydase, se transformant d'une part en peroxyde d'hydrogène et en glyoxylate incorporant l'azote par transamination et formant l'acide aminé. glycine. Deux de ces acides aminés sont transportés dans les mitochondries où trois composés sont finalement obtenus : sérine, ammoniac et CO2. Le CO2 et les gaz ammoniac sont libérés. La sérine retourne dans le peroxysome où elle peut être utilisée ou transformée en glycérate. Ceci est transporté au chloroplaste où, grâce à la dépense d'une molécule d'ATP, il est réintégré dans le cycle de Calvin en tant que 3-phosphoglycérate. La glycine, en revanche, peut être convertie de manière réversible en sérine par action du tétrahydrofolate de N5, N10 (Me = THF) par action de la glycine hydroxyméthyltransférase.
Les autres voies métaboliques pouvant donner de la sérine en tant que produit sont :
- dégradation des phospholipides contenant de la sérine.
- Dans la biosynthèse de la méthionine, une molécule de cystéine est utilisée comme source de soufre pour donner de la cystathionine, qui est hydrolysée pour obtenir de la sérine. Le squelette précurseur de la cystéine est identique à celui de la sérine produite.
- Par hydrolyse des protéines.
Dégradation et métabolites
Par oxydation et transamination ultérieure à partir du 3-phosphoglycérate, la sérine est synthétisée. Dans le corps, la sérine est dégradée en glycine, mais elle peut également être convertie en pyruvate dans un composé dépendant du PLP (phosphate de pyridoxal qui est une coenzyme dérivée d'une vitamine, la pyridoxine vitamine B6), éliminant ainsi la désamination par la sérine déshydratase.
La sérine est importante dans le métabolisme car elle participe à la biosynthèse des purines et des pyrimidines. C'est le précurseur de plusieurs acides aminés tels que la glycine, la cystéine dans les plantes et le tryptophane dans les bactéries. Il est également un précurseur de divers métabolites primaires et secondaires, tels que les sphingolipides, les phosphatidylsérines, l'éthanolamine et ses dérivés, la choline et ses dérivés, l'acide folique, l'entérobactine, l'acide 2,3-diaminopropionique (constituant des capréomycines), cyclosérine et monobactame SQ 26 180.
Production technique
Industriellement, la L-sérine est produite par fermentation, avec une quantité estimée de 100 à 1 000 tonnes par an. Alternativement, les protéines contenant de la kératine peuvent être hydrolysées avec de l'acide chlorhydrique et neutralisées avec de l'ammoniac. Le mélange résultant d'environ 20 acides aminés protéinogènes (dont un est la L-sérine) est séparé en raison de différentes solubilités et au moyen d'une chromatographie par échange d'ions. Les fractions individuelles sont purifiées par recristallisation.
D-sérine
Dans les cellules gliales et les neurones, la D-sérine est formée par l'enzyme sérine racémase. Aux récepteurs NMDA, la D-sérine agit comme un co-agoniste endogène, elle se lie à la sous-unité NR1 et augmente l'affinité du glutamate au niveau de ce récepteur. Il existe des preuves qu'un déficit physiologique en D-sérine peut jouer un rôle dans la dépression.
Chez certaines plantes, la sérine-racémase est détectée dans les timbres et les ovules et joue un rôle dans la navigation du tube pollinique en croissance. La L-sérine est reconfigurée en D-sérine et reconnue par le tube pollinique. Les gènes GLR (gènes du récepteur du glutamate) forment des canaux Ca2+ dans le tube pollinique, activés par la D-sérine, créant ainsi un signal oscillant Ca2+ dans la pointe du tube pollinique qui favorise et dirige la croissance. Les tubes polliniques dans lesquels ce trajet de signal a été perturbé montrent une croissance déformée, ramifiée et moins fertile.
Ce mécanisme de signalisation végétale est intéressant en ce sens que la communication médiée par les acides aminés a jusqu'à présent été plus associée au système nerveux central des animaux supérieurs.
Synonymes, antonymes
Voir tous les synonymes pour "sérine".1 synonyme (sens proche) de "sérine" :
- isosérine
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à SÉRINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot SERINE est dans la page 2 des mots en S du lexique du dictionnaire.
Mots en S à proximité
sériationséricé séricigène séricine série type sérinesérine protéase sériole séronégatifséropositifsérosité
En rapport avec "sérine"
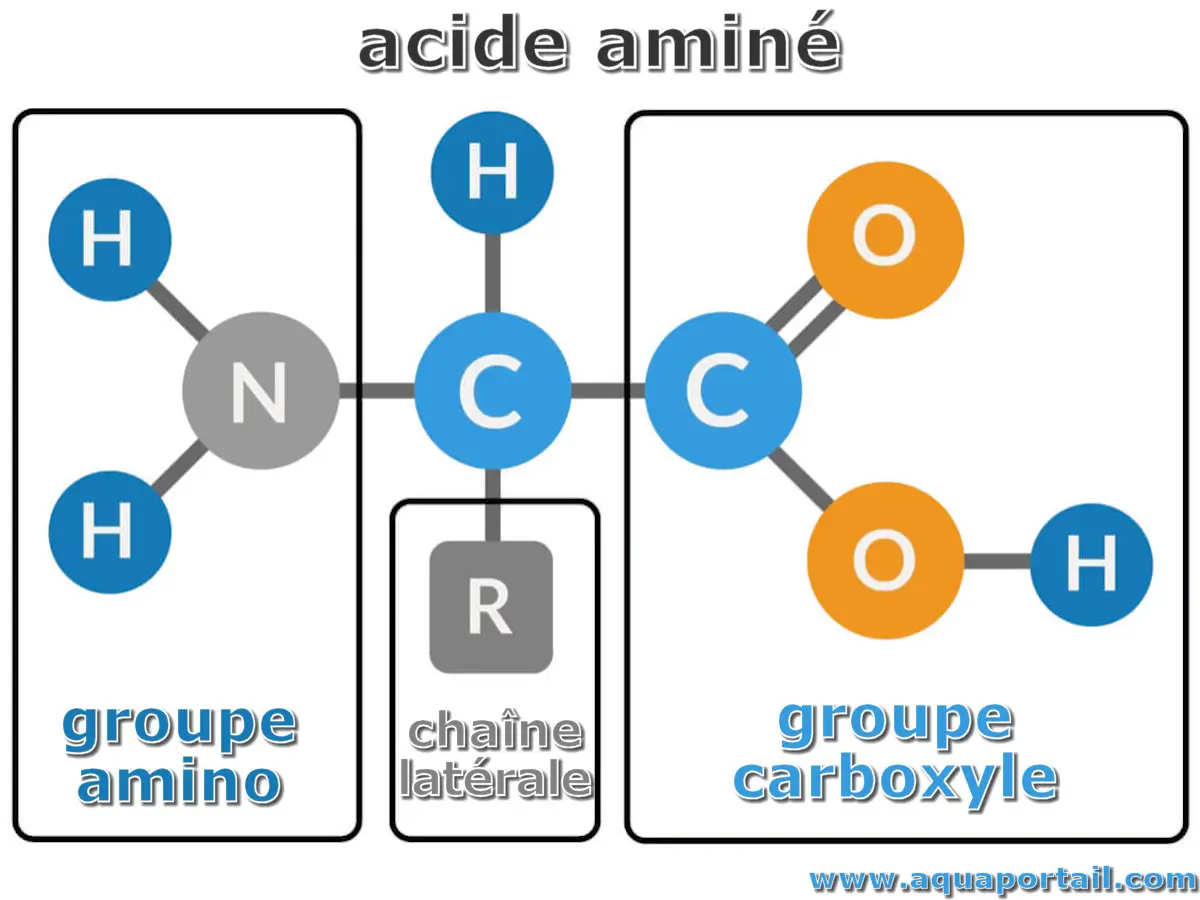
Un acide aminé est la molécule fondamentale qui sert de composant aux protéines. Une protéine est constituée d'une ou plusieurs chaînes d'acides aminés...

Un acide aminé essentiel est un acide aminé indispensable qui ne peut pas être synthétisé et fabriqué par l'organisme.

Une sélénoprotéine est une protéine avec du sélénium qui intègre l'acide aminé sélénocystéine (Sec), intégré lors de la synthèse protéique.
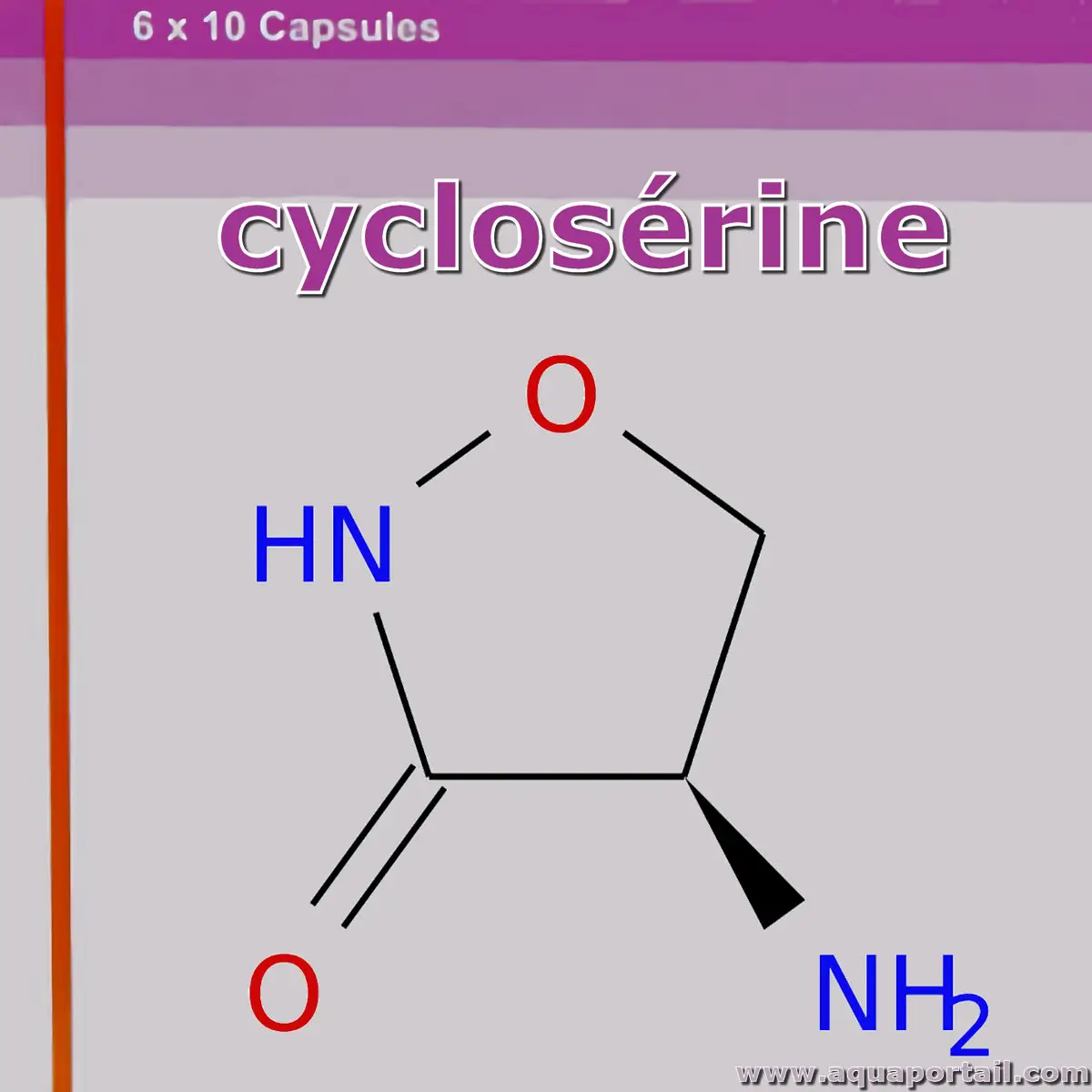
La cyclosérine est un antibiotique à large spectre qui agit en inhibant la biosynthèse de la paroi cellulaire des bactéries, ce qui en fait un agent efficace...
