Serpine
Définition
La serpine est un inhibiteur de sérine protéase qui contrôle des processus physiologiques étroitement régulés et leur dysfonctionnement est associé à diverses maladies. Un intérêt croissant est porté à ces protéines comme nouvelles cibles thérapeutiques.
La structure de la serpine et mécanisme d'inhibition (en bas) :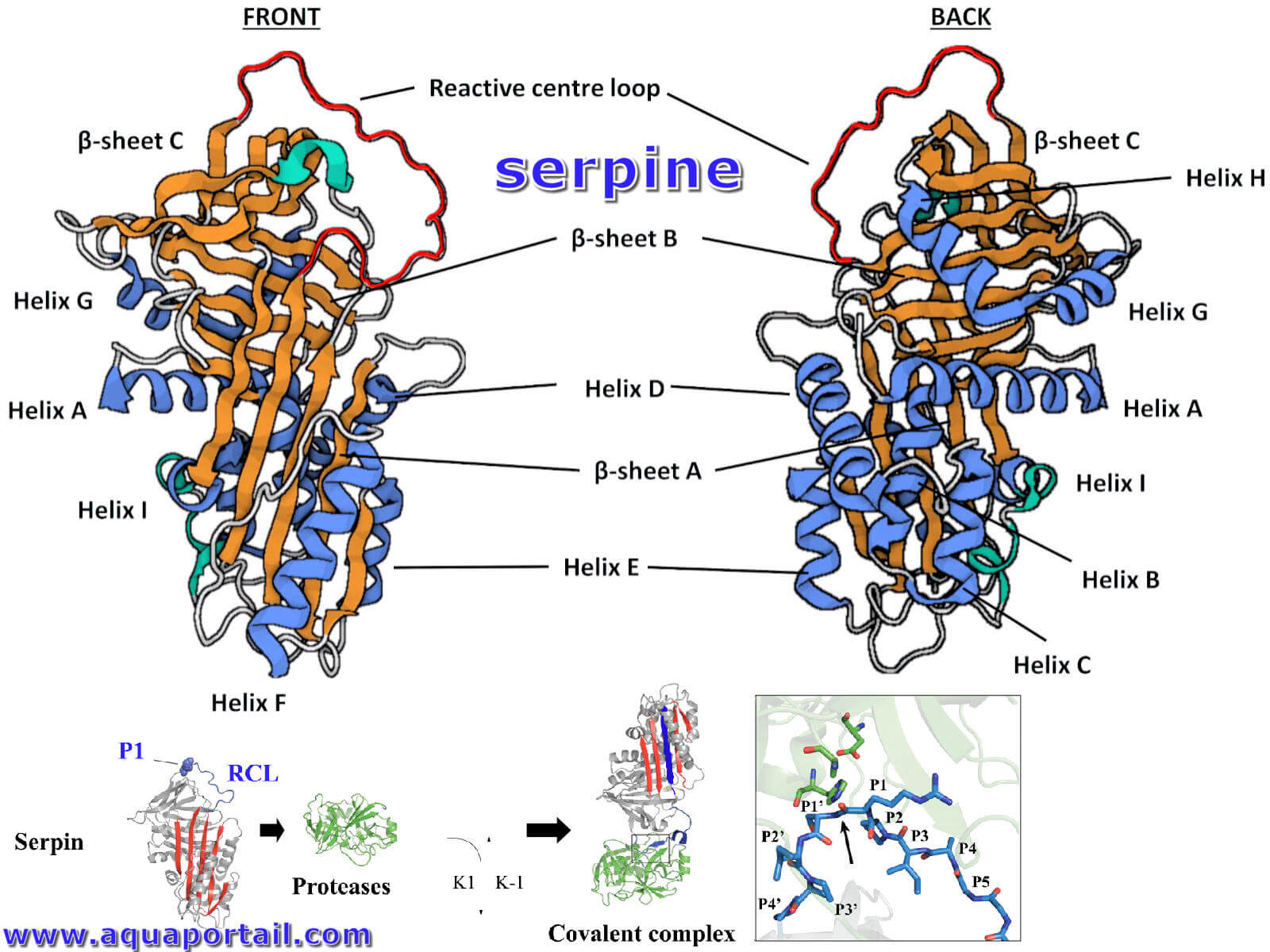
Structure de la serpine et mécanisme d'inhibition. En bas, la boucle centrale réactive (RCL, bleu) est reconnu par une sérine protéase (vert). Après clivage, RCL s'insère rapidement dans le feuillet β et forme un complexe covalent serpine-protéase. En bas à droite, vue rapprochée de l'interaction entre la serpine et sa protéase cible.
Explications
Les progrès des technologies de dépistage ont permis d'identifier de nombreux membres de la superfamille des serpines comme ayant une expression différentielle dans une multitude de maladies pulmonaires chroniques par rapport aux individus en bonne santé.
Les serpines présentent un mécanisme unique d'inhibition suicide-substrat au cours duquel elles subissent un changement conformationnel spectaculaire vers une forme plus stable. Une limitation est que cela les rend également sensibles aux mutations pathogènes.
Les serpines agissent via un mécanisme irréversible unique différent de celui des inhibiteurs de protéase standard. Elles se lient à la manière d'un verrouillage et d'une clé de pseudo-substrat et ont une spécificité relativement large au sein des sous-classes de sérine protéases. En formant une liaison covalente avec leurs protéases cibles, un changement de conformation intervient dans le site actif, entraînant une inhibition enzymatique efficace et le "suicide" de la serpine.
Grâce à l'émergence d'études métagénomiques, de nombreuses serpines bactériennes ont été identifiées dans de nombreuses niches écologiques, y compris le microbiote intestinal humain.
L'origine, la distribution et la fonction de ces protéines restent à établir. Dans ce rapport, nous mettons en lumière le rôle clé des serpines humaines et bactériennes dans la santé et la maladie. L'utilisation potentielle des serpines bactériennes peut définir de nouvelles approches thérapeutiques.
Rôles physiologiques
Chez l'homme, 30 des 37 serpines identifiées ont une fonction inhibitrice, dont beaucoup sont essentielles au contrôle strict des processus biologiques qui incluent la cascade de la coagulation sanguine, le remodelage tissulaire, la thrombose et les réponses inflammatoires. Cependant, des fonctions non inhibitrices ont également été rapportées. Ceux-ci incluent le transport hormonal, comme observé avec la globuline liant le cortisol (CBG) (SERPINA6) et la globuline liant la thyroxine (TBG) (SERPINA7), le chaperonnage moléculaire (SERPINH7) ou la suppression tumorale (SERPINB5).
Structure
Plusieurs études ont fourni des données fonctionnelles et structurelles sur les serpines humaines. En comparaison, il n'existe que peu de connaissances sur les serpines bactériennes.
La structure tertiaire canonique de la serpine (code PDB : 1QLP) comprend trois feuillets B (β, orange dans le le schéma ci-dessus), sept à neuf hélices α (bleu) et la boucle centrale réactive (rouge) représentée dans les orientations avant et arrière.
Les serpines sont des molécules relativement grosses, généralement de 350 à 400 acides aminés de longueur et ont un poids moléculaire moyen compris entre 40 et 60 kDa, la variation des poids moléculaires étant une conséquence de la glycosylation différentielle.
Par exemple, SERPING1, également connu sous le nom d'inhibiteur C1, a un poids moléculaire particulièrement élevé de 105 kDa en raison d'une extrémité N-terminale étendue fortement O- et N-glycosylée. Cependant, des structures secondaires et tertiaires hautement conservées contribuent à un domaine central composé de trois feuillets β (A – C), entre sept et neuf hélices α (A – I) et une boucle centrale réactive (RCL).
La boucle centrale réactive (RCL) forme une région étendue qui dépasse du corps de la protéine serpine principale et au-dessus de celui-ci, permettant une interaction avec les protéases cibles. Cette longue boucle flexible facilite un changement de conformation pendant l'amarrage et l'inhibition de la protéase, elle est donc essentielle pour déterminer la spécificité de l'inhibition de la serpine.
En effet, la boucle centrale réactive (RCL) ainsi que le plus grand feuillet β, la feuillet β A, comprennent les composants clés du domaine central essentiels à la fonctionnalité de la serpine.
La plupart des serpines sont des molécules extracellulaires (plasmatiques) et régulent les protéases impliquées dans la coagulation sanguine, l'inflammation, le remodelage tissulaire et la réponse immunitaire. Les serpines qui résident principalement dans les cellules ont tendance à être exprimées de manière ubiquitaire ou spécifique aux tissus. Ces serpines appartiennent généralement au clade B et agissent sur les processus cytosoliques et participent donc aux événements associés aux cellules.
Classification
Les serpines sont la superfamille d'inhibiteurs de protéase la plus grande, la plus largement distribuée et la plus diversifiée sur le plan fonctionnel. Semblables aux protéases à sérine, elles ont été identifiées dans les cinq règnes de la vie et sont subdivisées en 16 clades (A–P) en fonction de leurs relations phylogénétiques.
À ce jour, pas moins de 37 serpines ont été identifiées chez l'homme, séparées en neuf clades (A–I) avec plusieurs membres au sein de chaque clade. Le clade A représente le plus grand groupe de serpines humaines, au sein duquel les serpines sont nommées SERPINXY; où X désigne le clade et Y le nombre au sein dudit clade.
Dans la plupart des cas, les serpines ont également des noms alternatifs sous lesquels elles sont plus communément connues en raison de leur découverte précédant cette nomenclature.
Les serpines peuvent également être classées comme inhibitrices ou non inhibitrices en fonction de leur fonctionnalité et sont impliquées dans de nombreuses fonctions physiologiques dans de nombreux compartiments cellulaires dans tout le corps.
Bien qu'on pensait à l'origine qu'ils inhibaient uniquement les protéases à sérine, il a depuis été découvert que des inhibiteurs de protéases "interclasses" existent au sein de la famille des serpines.
Par exemple, une serpine virale, CrmA, peut inhiber la caspase-1, et SERPINB3 peut inhiber les protéases à cystéine de type papaïne cathepsines S, K et L.
La serpine procaryote, la miropine, a également été identifiée comme un inhibiteur d'une large gamme de sérine les protéases, y compris les neutrophiles et les élastases pancréatiques, la cathepsine G, la plasmine, la trypsine, la subtilisine ainsi que les protéases à cystéine cathepsine L et papaïne.
De plus, un certain nombre de serpines peuvent réguler les fonctions biologiques sans présenter d'activité inhibitrice, comme la régulation du transport hormonal et de la pression artérielle.
Mécanisme d'inhibition
L'inhibition de la protéase par les serpines repose sur la capacité des protéines natives à exister dans un état métastable qui peut facilement se transformer en un état plus stable au cours du processus d'inhibition. Au centre du processus se trouve la RCL, qui agit comme un substrat d'appât pour piéger la protéase cible, qui est ensuite attirée dans un piège conformationnel entraînant une inactivation immédiate.
L'interaction initiale intervient lorsque la protéase cible se lie, dans le cadre d'un complexe réversible non covalent de type Michaelis-Menten, au site P1, situé sur la RCL exposée de la serpine. La protéase ancrée clive ensuite la liaison scissile entre les résidus P1 et P1'de la RCL, ce qui entraîne la formation d'une liaison covalente entre la protéase liée et la serpine.
À ce stade, la réaction peut compléter la voie "inhibitrice", dans laquelle la serpine et l'enzyme restent sous forme de complexe covalent stable (intermédiaire acyle), ou une autre voie "substrat" peut être favorisée. La voie inhibitrice progresse lorsque l'événement de clivage entraîne un changement conformationnel spectaculaire avant que la protéase ne puisse terminer ce qui serait normalement une étape de désacylation formant un produit.
La protéase liée à la RCL est tirée vers le bas dans la feuillet β A à l'intérieur du noyau de la serpine, ce qui facilite une augmentation de la stabilité thermique et libère la serpine de sa conformation métastable. La molécule passe ainsi d'un état "stressé à détendu". La formation d'un complexe covalent avec la serpine piège par conséquent la protéase cible et les deux deviennent inactivées.
La voie du substrat implique une dissociation rapide de la protéase du complexe de type Michaelis-Menten après clivage de la RCL. Cela signifie que la protéase échappe au piège conformationnel avant que l'insertion de la boucle puisse avoir lieu. De plus, la protéase libérée conserve son activité tandis que la serpine clivée reste inactive.
La condition requise du clivage RCL signifie que les serpines sont connues comme des inhibiteurs irréversibles du "suicide". La stoechiométrie d'inhibition (SI) est le rapport des moles de serpine nécessaires pour inhiber 1 mole de protéase et est utilisée pour déterminer quelle voie prédominera. SI doit être proche de 1 pour qu'une inhibition efficace survienne. Les mécanismes "suicide-substrat" par lesquels les serpines interagissent avec une protéase cible.
Régulation de la fonction
Il existe un certain nombre de facteurs qui renforcent l'action inhibitrice des serpines, notamment la longueur et la flexibilité de la RCL, la reconnaissance des protéases et d'autres séquences de reconnaissance d'exosites.
Certaines serpines utilisent également des cofacteurs pour réguler l'activité, la serpine conservant toujours sa métastabilité et sa réactivité, mais la liaison du cofacteur entraîne un changement conformationnel optimal qui confère une activité inhibitrice maximale si nécessaire. Les cofacteurs courants de la serpine sont les glycosaminoglycanes (GAG).
Les GAG sont des chaînes polysaccharidiques sulfatées non ramifiées qui sont couramment utilisées par certaines serpines, mais pas toutes, pour modifier la cinétique d'inhibition. SERPINC1 (antithrombine III) montre une inhibition accrue de la thrombine et du facteur Xa après activation par l'héparine, potentialisant son effet anticoagulant par 1 000.
D'autres serpines de liaison aux GAG bien connues comprennent le cofacteur II de l'héparine (SERPIND1) et l'inhibiteur de la protéine C (SERPINA5), qui sont capables de se lier à l'héparine et au sulfate d'héparane, le cofacteur II de l'héparine étant également capable de se lier au sulfate de dermatane.
Pour la plupart, les GAG se lient aux serpines dans une région conservée située autour de l'hélice D. SERPINA5 est l'exception, avec une liaison de co-facteur utilisant l'hélice H.
Rôles pathologiques
La capacité des serpines à subir un changement conformationnel contrôlé vers une forme plus stable est essentielle à leur capacité à effectuer une inhibition efficace. Cependant, cette caractéristique peut également rendre les serpines sensibles aux réarrangements spontanés ou aux mutations qui peuvent altérer leur affinité et leur efficacité.
Des mutations peuvent exister presque n'importe où dans la serpine, ce qui peut convertir la serpine native métastable en une forme plus stable présentant une latence ou des formes polymères inactives.
Certains polymères de serpines mutantes sont retenus dans la cellule de synthèse et donnent lieu à des conditions cliniques résultant soit d'une surcharge protéique (gain de fonction) entraînant la mort de la cellule de synthèse, soit d'une perte de fonction par carence plasmatique en serpines natives.
"Serpinopathies" est le terme inventé pour décrire les pathologies se manifestant par des anomalies conformationnelles et la polymérisation des serpines. Il existe de nombreux exemples de serpinopathies.
Par exemple, l'emphysème et la cirrhose peuvent être causés par une déficience et une polymérisation de SERPINA1, respectivement, la thrombose peut être causée par la polymérisation de SERPINC1, l'oedème de Quincke résulte d'une déficience de SERPING1 et la démence familiale est une conséquence de la polymérisation de SERPINI1
Synonymes, antonymes
Voir tous les synonymes pour "serpine".2 synonymes (sens proche) de "serpine" :
- inhibiteur de sérine protéase
- miropine
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à SERPINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot SERPINE est dans la page 2 des mots en S du lexique du dictionnaire.
Mots en S à proximité
sérotype sérovar serpent serpent de mer serpentiforme serpineserpolet serpule Serpulidés serran Serrasalmidés
En rapport avec "serpine"
La cyclosérine est un antibiotique à large spectre qui agit en inhibant la biosynthèse de la paroi cellulaire des bactéries, ce qui en fait un agent efficace...
Une protéase est une peptidase, une enzyme protéolytique qui coupe une liaison peptidique au sein d'une séquence protéique, mais pas aux extrémités.
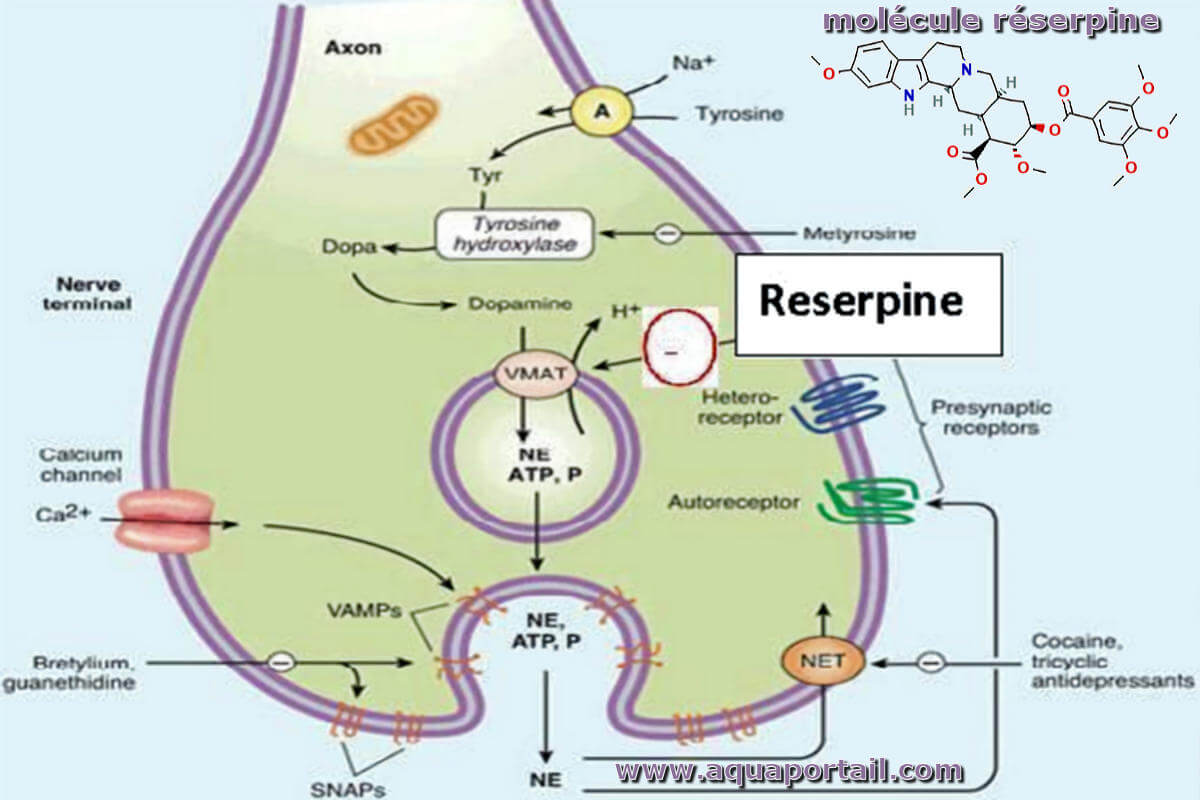
La réserpine est un alcaloïde indolique de Rauvolfia sp. (famille des Apocynacées en Inde) anti-adrénergique, neuroleptique et anti-hypertensif.
La sérine (Ser) est un acide aminé non essentiel sur le plan nutritionnel, mais elle est essentielle à la production de protéines, d'enzymes et de tissus...
