Subtilisine
Définition
La subtilisine est une sérine endopeptidase extracellulaire, qui englobe désormais également toute enzyme digérant les protéines (protéase) isolée d'espèces apparentées de Bacillus. Son nom dérive du nom de l'espèce bactérienne Bacillus subtilis, à partir de laquelle l'enzyme a été isolée pour la première fois.
Les subtilisines sont des enzymes dégradant les protéines, et plus spécifiquement des sérines protéases, avec une faible spécificité en matière de liaison peptidique.
La subtilisine avec son prosegment :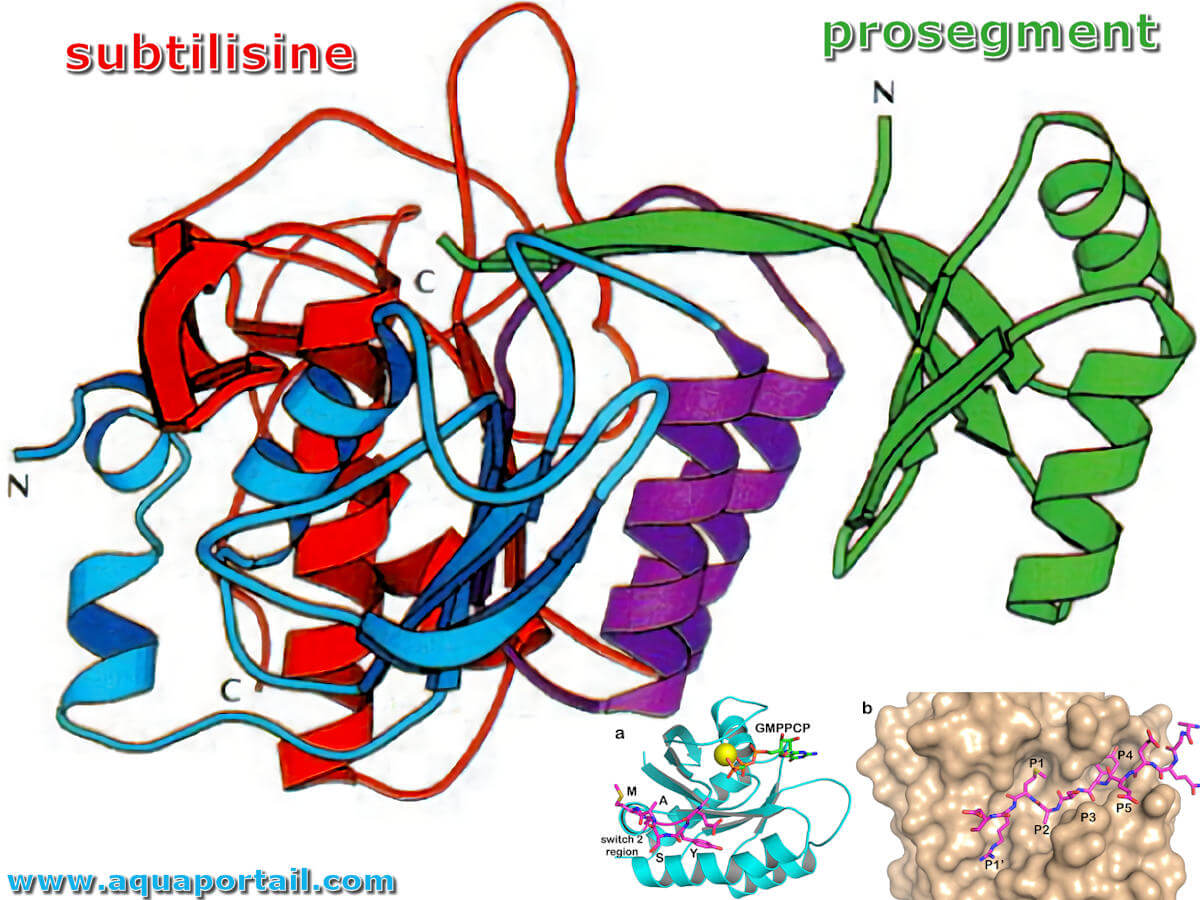
Le complexe prosegment–subtilisine BPN′ : structure cristalline d'une "foldase" spécifique. Le repliement de la protéase bactérienne subtilisine BPN'(SBT) dépend de son prosegment de 77 résidus, qui est ensuite éliminé de manière autocatalytique pour donner l'enzyme mature. La subtilisine mature représente une classe de protéines dépourvue d'une voie de repliement efficace.
Explications
Les subtilisines sont des enzymes protéolytiques de la classe des sérine protéinases, qui sont produites par des bactéries, principalement du genre Bacillus.
Les subtilisines n'ont pas de "spécificité de site". Elles sont capables d'hydrolyser les liaisons d'acides aminés sur toute la longueur de la chaîne peptidique. Plus la chaîne d'acides aminés est accessible à l'hydrolyse, plus la protéolyse est efficace. Les molécules de protéines qui ont perdu leur structure native deviennent plus accessibles à l'hydrolyse par les subtilisines. Les protéines qui n'ont pas de protection polysaccharidique sont également efficacement hydrolysées.
Catalyse
Le centre catalytique des subtilisines est formé par une triade d'acides aminés : Asp-32, His-64 et Ser-221. Malgré la distance les uns des autres dans la chaîne peptidique, ces acides aminés sont très proches dans la structure tridimensionnelle de la protéine. Le rôle décisif dans l'hydrolyse de la liaison peptidique appartient à Ser-221, c'est pourquoi les subtilisines et les enzymes protéolytiques apparentées sont appelées sérine protéinases. Asp-32, His-64 "jouent pour le leader", formant une puissante activité hydrolytique de Ser-221.
Histoire
L'histoire de la découverte et de l'étude des subtilisines a commencé dans le centre de recherche de la brasserie Carlsberg, et la première enzyme décrite est appelée "subtilisine Carlsberg". Plus tard, plus de subtilisines et d'enzymes de type subtilisine ont été isolées d'autres bactéries et champignons (mycosubtiline). Les subtilisines végétales (SBT végétales) sont des homologues des subtilisines bactériennes qui ont été identifiées pour la première fois dans les souches Carlsberg et BPN′ de Bacillus subtilis.
En 2018, Frances Arnold a reçu le prix Nobel de chimie pour l'évolution dirigée des subtilisines.
La structure cristallographique tridimensionnelle aux rayons X de la subtilisine BPN'a été élucidée pour la première fois par Wright et ses collègues en 1969 et s'est avérée présenter un pli distinct de la sérine protéase pancréatique, la chymotrypsine. La similitude marquée des géométries des sites catalytiques et de liaison pour la subtilisine et la chymotrypsine, malgré leurs structures tertiaires différentes, a donné lieu à la notion d'évolution moléculaire convergente. Les études enzymologiques avec cette enzyme ont été cruciales pour comprendre le mécanisme d'action de la sérine protéase.
Ligature glycopeptidique
Les subtilisines peptidases ont été utilisées avec élégance pour catalyser la synthèse de glycopeptides, malgré le fait que la spécificité naturelle de ces enzymes a limité ces ligatures peptidiques à celles dans lesquelles les résidus glycosylés sont typiquement distants d'au moins un résidu (P2, P3… ou P2', P3′...) à partir de la liaison amide formée.
Ainsi, alors que la ligature de Z-Gly-OBz avec H-Gly-[GlcNAcAc3(β1-O)]Ser-NH2 a réussi, aucun rendement de produit n'a été obtenu avec H-[GlcNAcAc3(β1-O)]Ser-NH2. L'utilisation de cette méthode de ligature couplée à d'autres stratégies à médiation enzymatique a abouti à une synthèse vraiment élégante d'une seule glycoforme non naturelle de la ribonucléase B (RNase B) 16 en utilisant une ligature catalysée par une protéase de fragments du squelette protéique, y compris un fragment portant un GlcNAc(β1-N)Asn unique, suivi de réactions d'élaboration catalysées par la glycosyltransférase de ce glycane.
Les limitations de la spécificité naturelle des subtilisines à cet égard ont également été surmontées par la reconception logique par le biais d'une modification chimique sélective du site.
Utilisations
Après la découverte des subtilisines, leur utilisation principale s'est concentrée dans l'industrie alimentaire. Peu à peu, les propriétés uniques des subtilisines ont attiré l'attention des biologistes et des médecins. Les subtilisines sont utilisées dans de nombreuses technologies de recherche biologique.
En pharmacologie, des médicaments uniques sont créés à base de subtilisines. En médecine, de nouvelles technologies pour le traitement de la thrombose et des maladies inflammatoires sont développées à base de subtilisines.
Les subtilisines sont ajoutées aux détergents depuis 1959. Elles aident à éliminer les taches de protéines de sang, de lait, d'oeufs, etc. Elles conviennent bien pour cette action de détachant car elles sont très stables et également actives à basse température et en milieu alcalin typique du processus de lavage. Aujourd'hui, des subtilisines modifiées spécifiques sont produites à cette fin à l'aide de micro-organismes génétiquement modifiés.
Synonymes, antonymes
Voir tous les synonymes pour "subtilisine".2 synonymes (sens proche) de "subtilisine" :
- mycosubtiline
- subtiline
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à SUBTILISINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot SUBTILISINE est dans la page 5 des mots en S du lexique du dictionnaire.
Mots en S à proximité
substrat crevette substrat synthétique de ponte substratum subterranologiesubtidal subtilisinesubtropical subulé suc gastrique succenturié succès reproducteur
En rapport avec "subtilisine"
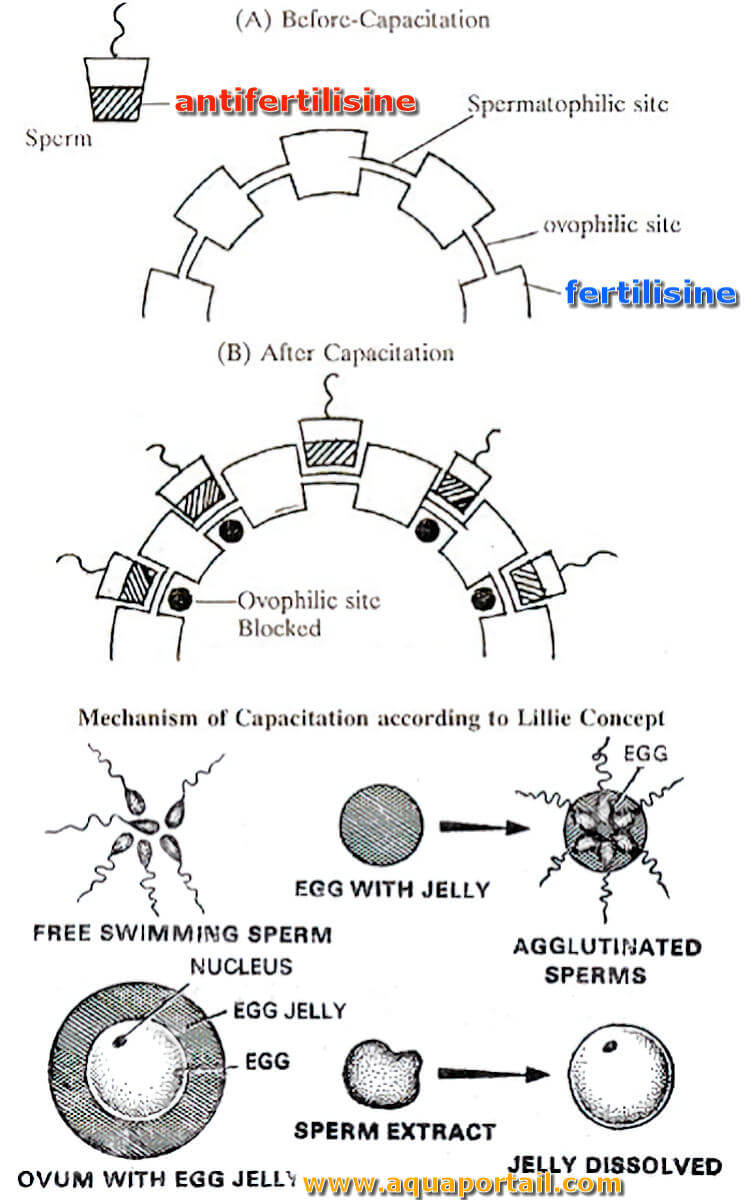
Une antifertilisine (androgamone) s'oppose ou est contre la fertilisine. Une antifertilisine est une protéine présente dans la membrane plasmique du sperme.
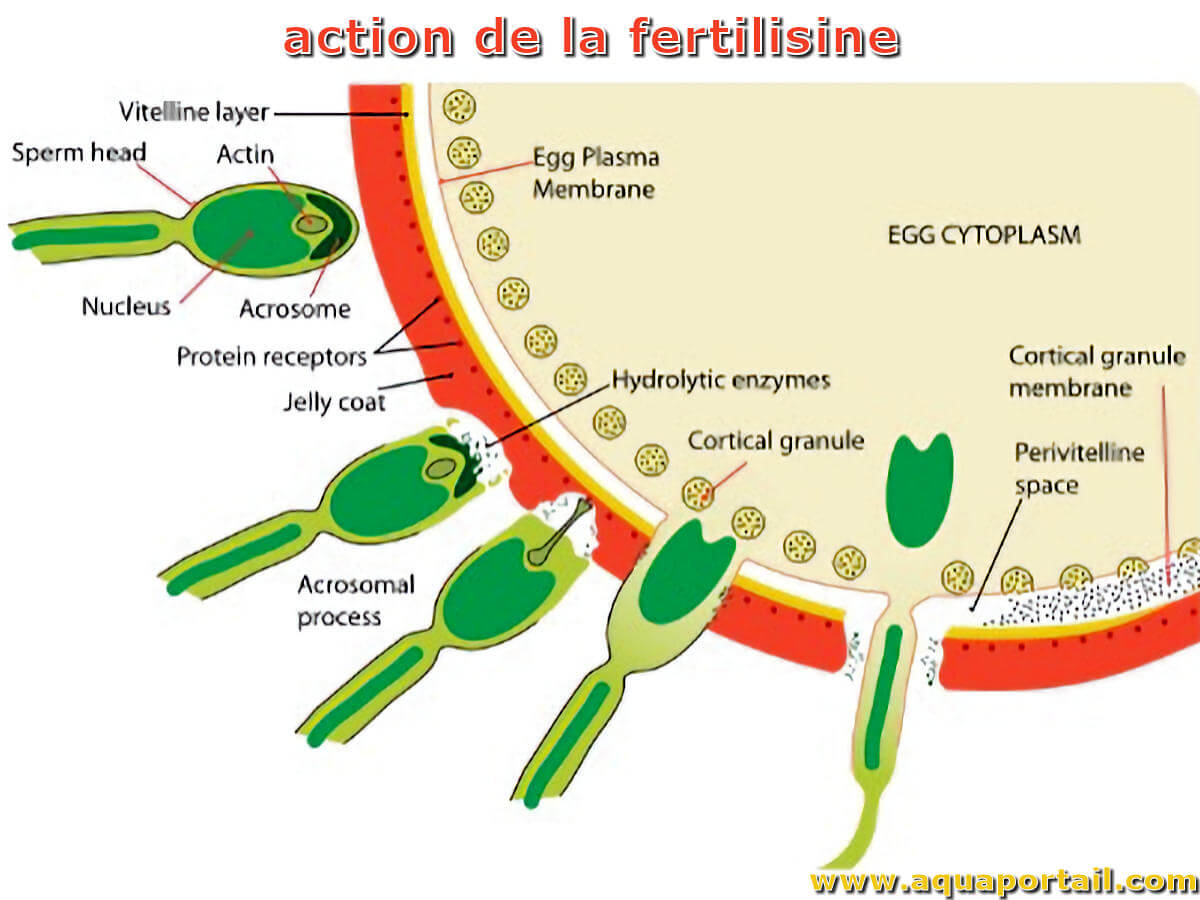
La fertilisine (gynogamone) est un agent agglutinant des spermatozoïdes qui est produit par un ovule et joue un rôle dans les préliminaires de fertilisation...
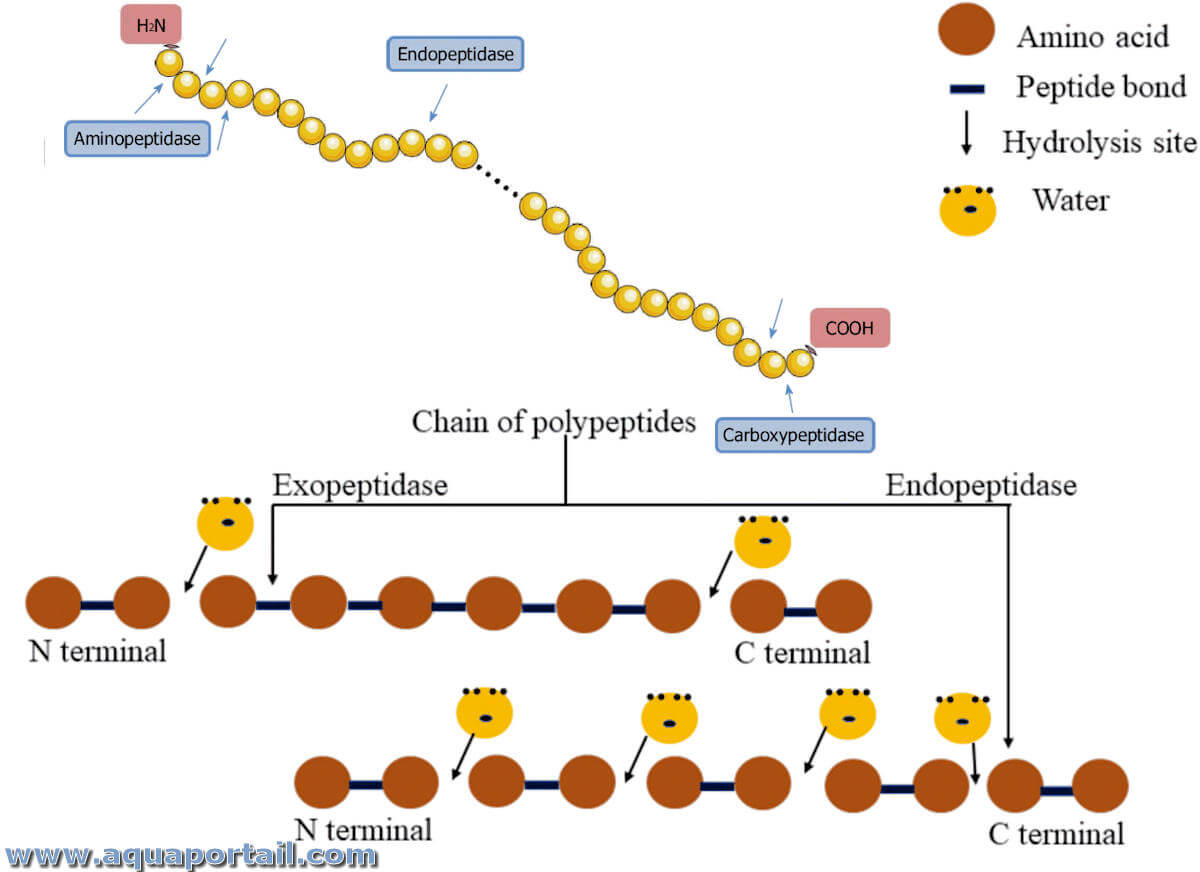
Une endopeptidase, ou une (endo)protéinase, est une forme de protéase, une peptidase à l'intérieur qui rompt les liaisons l'intérieur de la chaîne protéique.
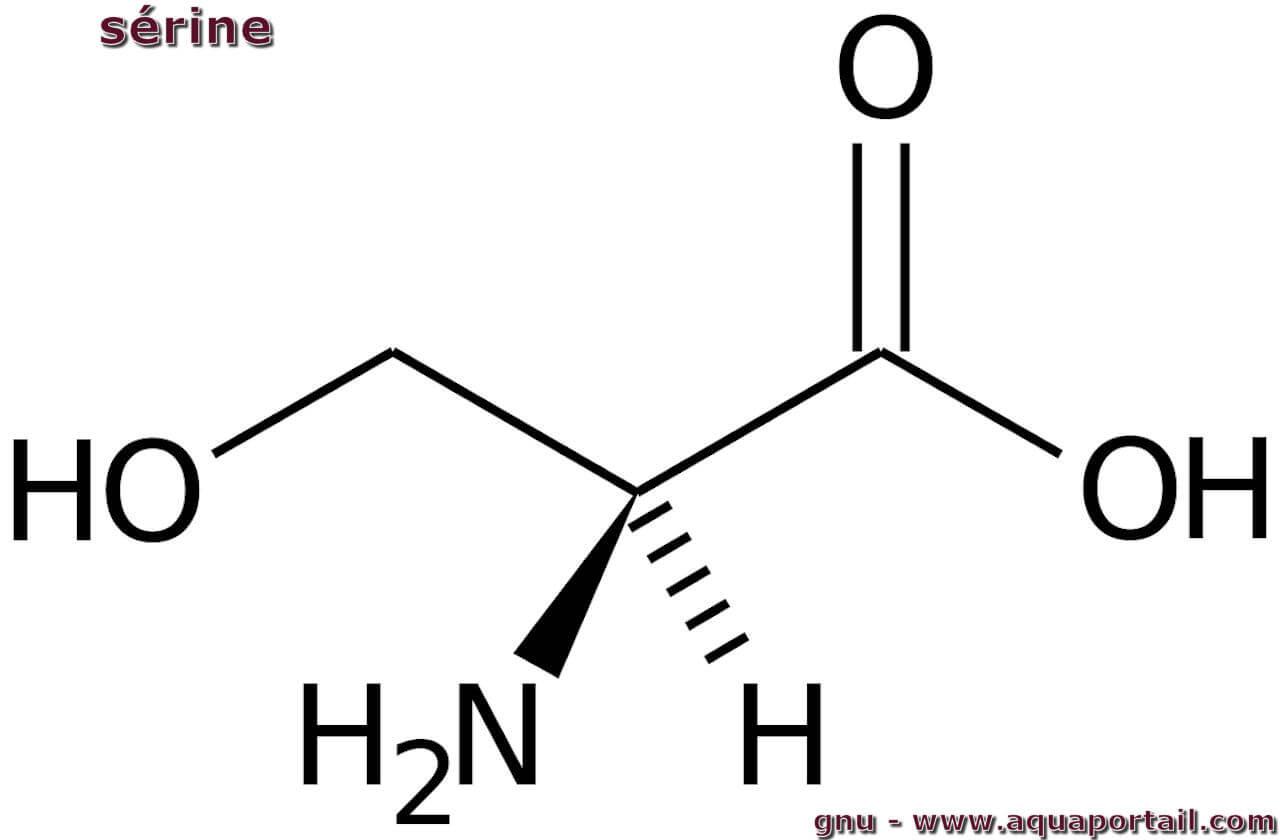
La sérine (Ser) est un acide aminé non essentiel sur le plan nutritionnel, mais elle est essentielle à la production de protéines, d'enzymes et de tissus...
