Glycopeptide
Définition
Un glycopeptide est un composé formé d'un peptide de glycoprotéine et d'une partie glucidique. Les antibiotiques glycopeptidiques constituent une classe de peptides contenant des sucres liés à des acides aminés, comme dans la paroi cellulaire bactérienne. La classe contient des peptides glycosylés non ribosomaux cycliques ou polycycliques.
Quelques structures de glycopeptides :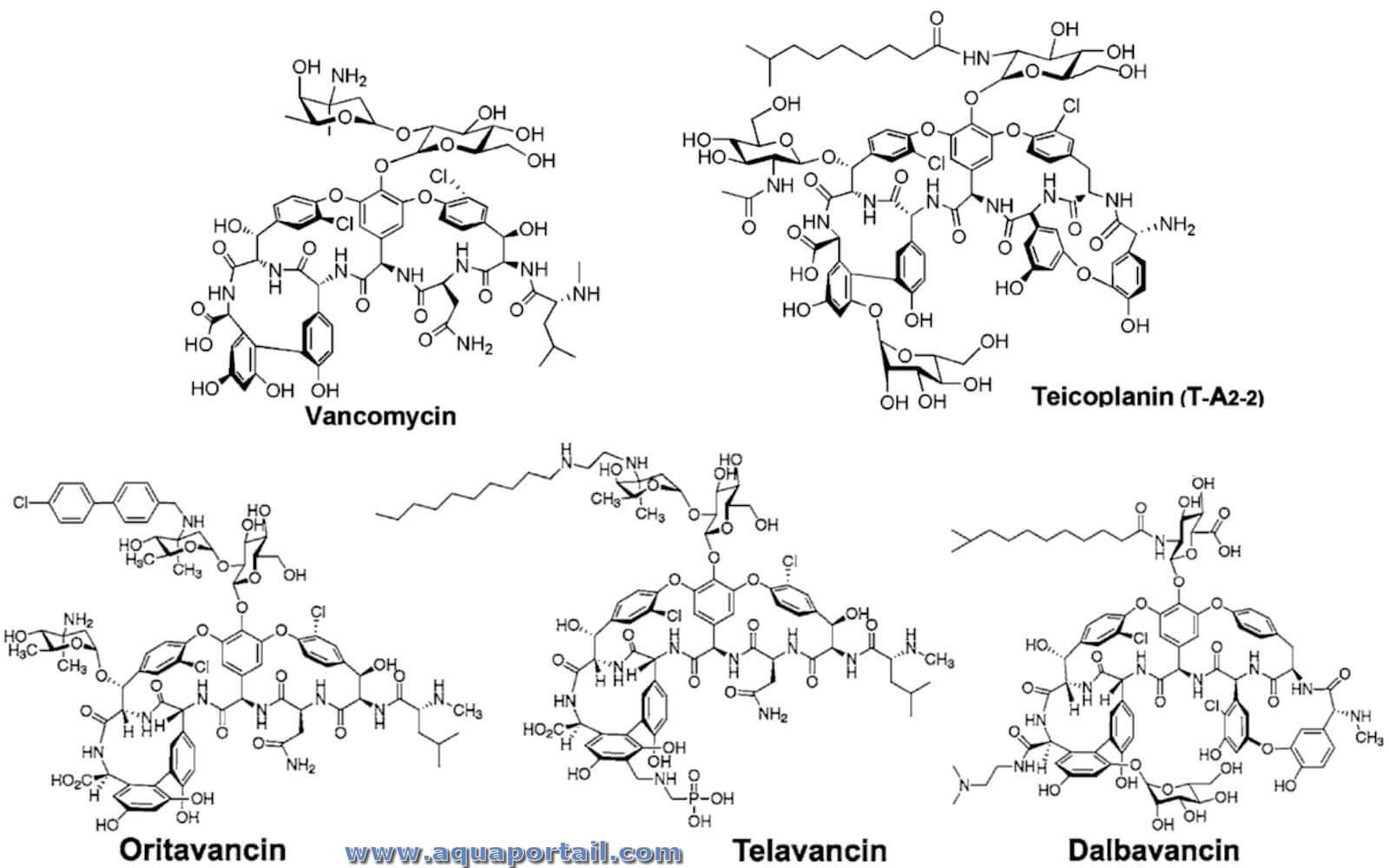
Structures de 5 glycopeptides : vancomycine, teicoplanine, oritavancine, télavancine, dalbavancine. Structures des antibiotiques glycopeptidiques naturels et semi-synthétiques (GPA). La vancomycine et la teicoplanine sont des produits naturels. Dans le cas de la teicoplanine, l'antibiotique cliniquement utilisé est un mélange de cinq molécules lipoglycopeptidiques différant par la longueur (C10-C11) et la ramification de la queue d'acide gras, dont le composant principal, celui rapporté sur la figure, porte le 8-méthylnonanoïque (iso-C10 :0) et est nommé T-A2–2. L'oritavancine et la télavancine sont des GPA semi-synthétiques de deuxième génération appartenant à la famille des vancomycines. La dalbavancine est le dérivé semi-synthétique de la teicoplanine A40926.
Explications
Les glycopeptides sont utilisés comme antibiotiques : ils agissent en inhibant la synthèse du peptidoglycane à une étape métabolique différente et avant les agents bêta-lactames. Ils modifient la perméabilité de la membrane (paroi cellulaire) et inhibent la synthèse de l'ARN. Ils agissent en inhibant la synthèse des bactéries sur la paroi cellulaire et n'affectent que les bactéries à Gram positif (donc aucune action sur les bactéries à Gram négatif).
Les glycopeptides sont inclus dans ce groupe :
- vancomycine,
- teicoplanine,
- bacitracine,
- bléomycine,
- ramoplanine.
Les glycopeptides sont actuellement utilisés pour les infections sévères causées par des bactéries à Gram positif qui ne peuvent pas être traitées avec des antibiotiques β-lactames. Cela peut être dû au fait que le patient est allergique aux antibiotiques β-lactames ou à une résistance aux bactéries aux antibiotiques β-lactames.
Les glycopeptides sont des antibiotiques bactéricides. La vancomycine lie le dipeptide D-wing-D-wing, bloquant ainsi la transpeptidase, interférant avec la polymérisation du peptidoglycane, constituant fondamental de la paroi bactérienne. La bacitracine inhibe l'action du bactoprénol, un lipide bactérien nécessaire au transport transmembranaire de NAM-NAG-5aa (acide N-acétylmuramique + chaîne N-acétylglucosamine + pentaminoacide), par accumulation intracellulaire de NAM-NAG-5aa (absence concomitante de peptidoglycane). Au lieu de cela, la polymyxine pénètre dans la cellule bactérienne et agit en modifiant sa membrane plasmique.
Les indications incluent des infections bactériennes appartenant aux genres Staphylococcus, Streptococcus, Enterococcus et Corynebacterium. De plus, ces substances sont utilisées dans le traitement local de l'inflammation intestinale causée par Clostridium difficile.
Voir aussi un glycolipide, un glycoside, un oligopeptide, un polypeptide, un lipoglycopeptide.
Antibiotiques glycopeptidiques (action et résistance)
Les glycopeptides sont considérés comme des antibiotiques de dernier recours pour le traitement des infections potentiellement mortelles causées par des agents pathogènes humains à Gram positif pertinents, tels que Staphylococcus aureus, Enterococcus spp. et Clostridium difficile.
L'émergence d'isolats cliniques résistants aux glycopeptides, d'abord chez les entérocoques puis chez les staphylocoques, a suscité des recherches sur les glycopeptides de deuxième génération et un foisonnement d'activités visant à comprendre les mécanismes de résistance et leur évolution. Les glycopeptides sont des peptides non ribosomiques glycosylés produits par un groupe diversifié d'actinomycètes du sol. Ils ciblent les bactéries Gram-positives en se liant à l'extrémité acyl-D–alanyl-D–alanine (D-Ala-D–Ala) du peptidoglycane en croissance sur la surface externe de la membrane cytoplasmique.
Les organismes résistants aux glycopeptides évitent un tel sort en remplaçant l'extrémité D–Ala-D–Ala par du D–alanyl-D-lactate (D-Ala-D-lac) ou de la D–alanyl-D-sérine (D-Ala-D -Ser), réduisant ainsi nettement l'affinité antibiotique pour la cible cellulaire. La résistance s'est manifestée chez les entérocoques et les staphylocoques en grande partie par l'expression de gènes (nommés van) codant pour des protéines qui reprogramment la biosynthèse de la paroi cellulaire et, ainsi, échappent à l'action de l'antibiotique.
Ces mécanismes de résistance ont très probablement été cooptés par les actinomycètes producteurs de glycopeptides, qui les utilisent pour éviter le suicide lors de la production d'antibiotiques, plutôt que d'être orchestrés par des bactéries pathogènes lors d'un traitement continu. des clusters de gènes de type van, similaires à ceux décrits chez les entérocoques, ont en effet été identifiés chez de nombreux actinomycètes producteurs de glycopeptides, comme Actinoplanes teichomyceticus, qui produit la teicoplanine, et Streptomyces toyocaensis, qui produit le glycopeptide A47934.
Une compréhension approfondie de l'immunité aux glycopeptides chez ce micro-organisme producteur peut être particulièrement pertinente pour prédire et éventuellement contrôler l'évolution de la résistance qui pourrait survenir suite à l'introduction de la dalbavancine et d'autres glycopeptides de deuxième génération dans les cliniques.
Synonymes, antonymes
Voir tous les synonymes pour "glycopeptide".0 synonyme (sens proche) pour "glycopeptide".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à GLYCOPEPTIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot GLYCOPEPTIDE est dans la page 3 des mots en G du lexique du dictionnaire.
Mots en G à proximité
glycol glycolate glycolate déshydrogénase glycolipide glycolyse glycopeptideglycophorineglycophyte glycoprotéine glycoprotéique glycosaminoglycane
En rapport avec "glycopeptide"
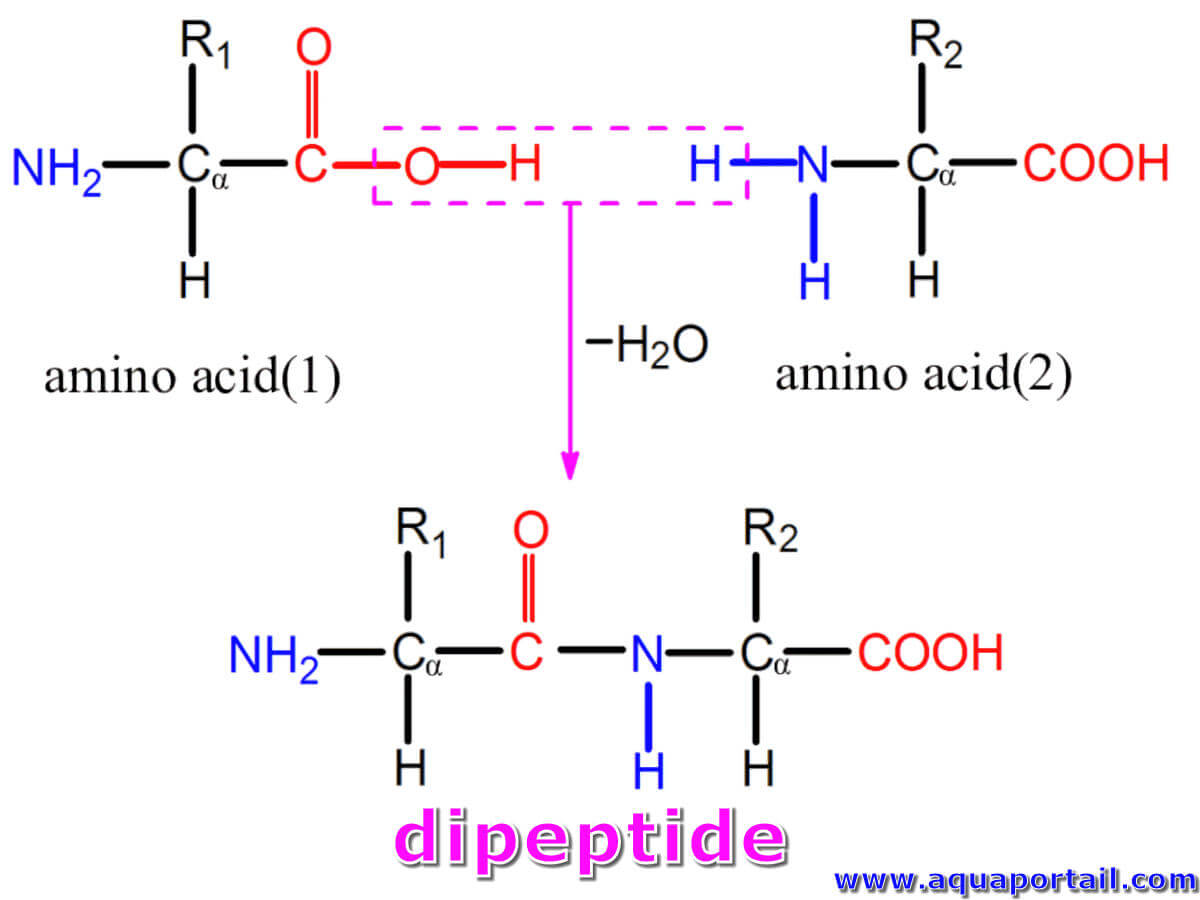
Un dipeptide est une molécule composée de deux peptides, la forme la plus simple d'un polypeptide de type oligopeptide.
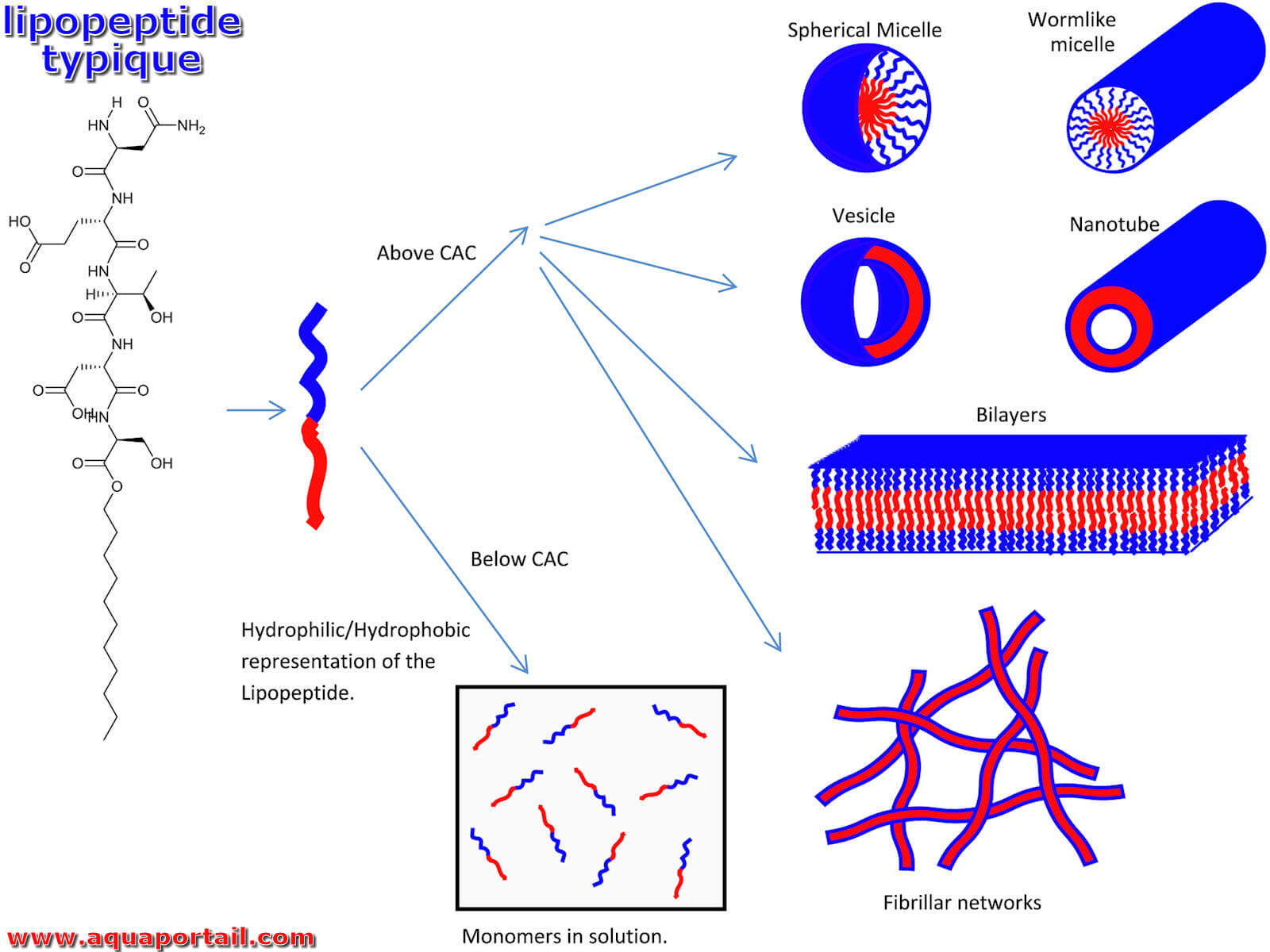
Un lipopeptide est une molécule constituée d'un lipide connecté à un peptide. Les lipopeptides sont typiques du monde bactérien, en étant capables...
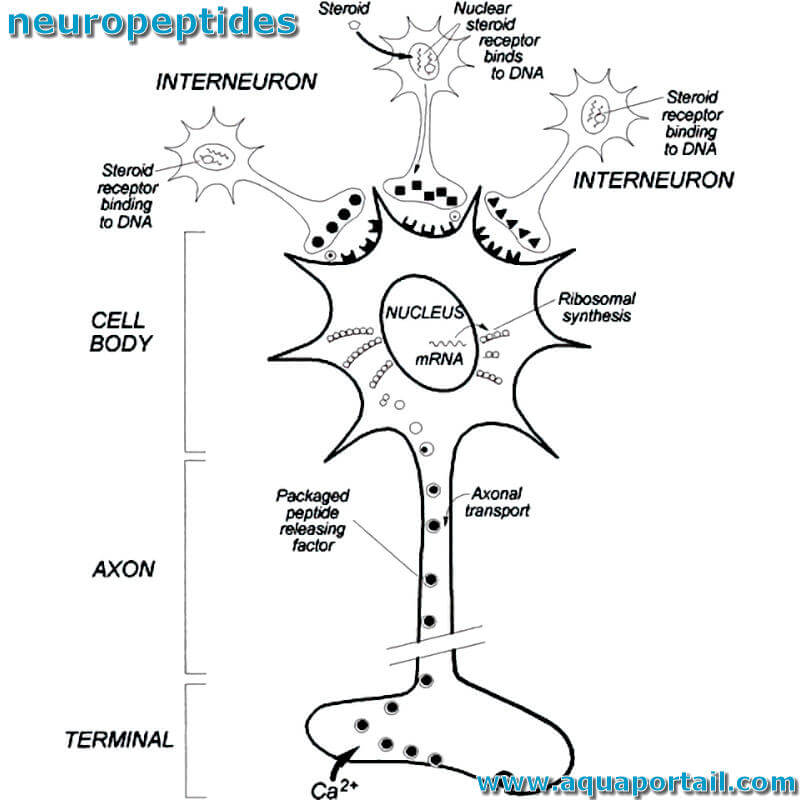
Un neuropeptide est une petite molécule, formée par l'union de 3 acides aminés ou plus et est un peptide qui montre une action sur le système nerveux.

Un oligopeptide détient peu de peptides, mais en possède quand même, avec un faible nombre d'acides aminés.
