Dipeptide
Définition
Un dipeptide est une molécule composée de deux peptides, la forme la plus simple d'un polypeptide de type oligopeptide. Chaque acide aminé de chacun des peptides est lié à l'autre par une liaison peptidique. En raison des différents mécanismes d'absorption, les dipeptides sont absorbés plus rapidement que les acides aminés.
La formation d'un dipeptide par deux acides aminés :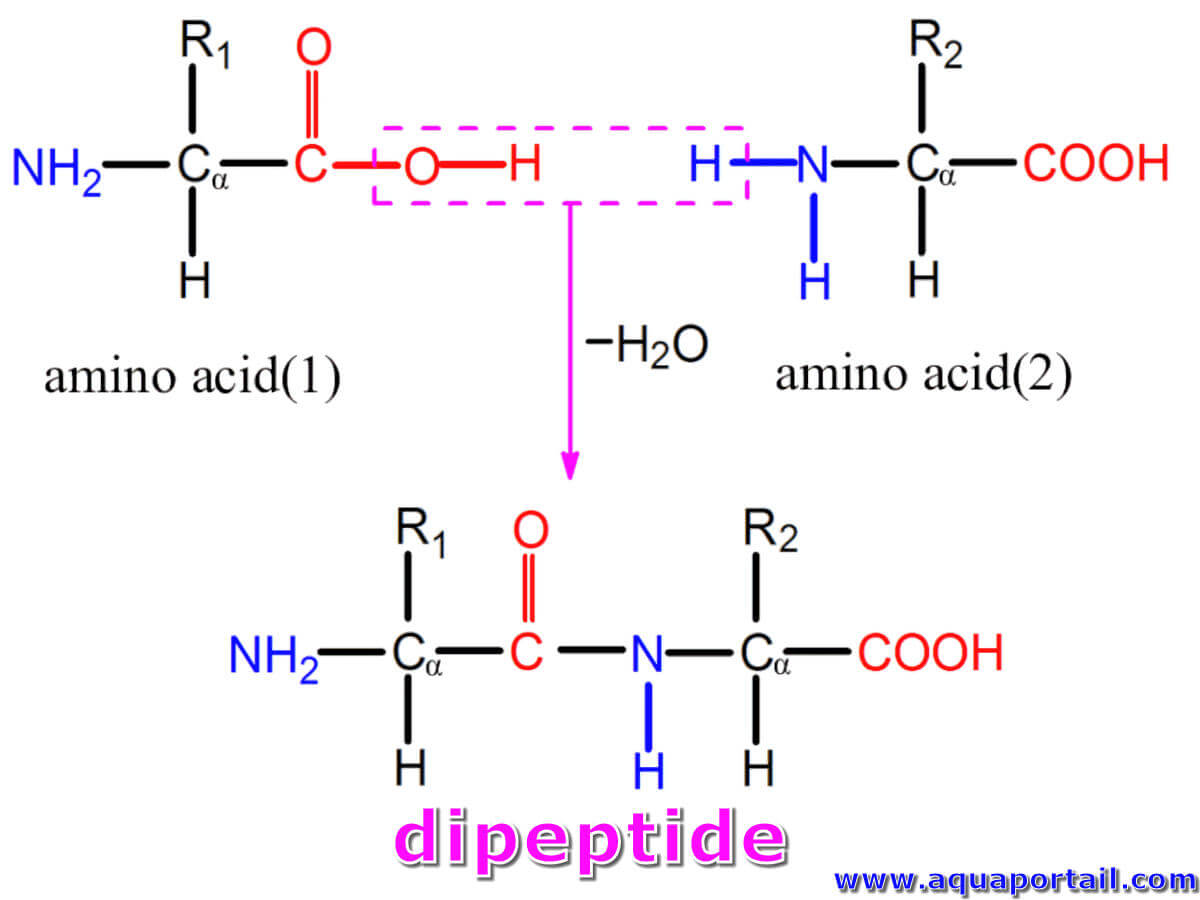
La formation d'un dipeptide est une condensation de deux acides aminés avec des chaînes latérales différentes R1 et R2. Une molécule comprend un groupe amine et un groupe carboxyle.
Explications
Un dipeptide est une molécule constituée de deux acides aminés reliés par une seule liaison peptidique. Les dipeptides peuvent provenir de polypeptides en raison de l'action de l'enzyme hydrolase dipeptidyl-peptidase. Les nutriments sont digérés en acides aminés et en dipeptides, puis absorbés. Les cellules G de l'estomac sont stimulées par des dipeptides pour la sécrétion de l'enzyme gastrine.
Un polypeptide, tel qu'une petite protéine, contient de nombreuses molécules d'acides aminés, typiquement entre 10 et 100. La cyclisation d'un dipeptide conduit à la formation de dichetopipérazines.
Les dipeptides générés par l'action des deux dipeptidyl-peptidases sont des substrats pour les transporteurs de peptides et sont en outre utilisés comme source d'acides aminés pour la croissance fongique.
Les dipeptides peuvent former des cristaux de forme caractéristique. La molécule de dipeptide contient des groupes amino- et carboxyle. Les dipeptides composés des mêmes acides L–aminés, mais dans des séquences différentes, donnent des isomères.
Une façon classique de fabriquer des dipeptides consiste à synthétiser les peptides d'azlactone de Bergmann. Cette synthèse est un moyen de synthèse organique.
Formation d'un dipeptide
La liaison chimique qui relie deux acides aminés implique une liaison amide (également connue sous le nom de liaison peptidique) entre le groupe carbonyle du premier acide aminé et le groupe aminé du deuxième acide aminé. La formation de liaison implique la libération ultérieure d'une molécule d'eau.
La jonction de deux acides aminés entraîne la formation d'un dipeptide. Le groupe carboxyle du dipeptide (maintenant connu sous le nom de terminus carboxyle) est disponible pour la formation d'une liaison peptidique avec un autre acide aminé. La liaison peptidique semble être une liaison unique et, par conséquent, libre de tourner. Cependant, la liaison peptidique a un caractère de double liaison partielle en raison d'une structure de résonance.
Les structures de résonance ont les conséquences suivantes :
- La rotation autour de la liaison peptidique est restreinte (88 kJ / mol d'énergie nécessaire pour tourner), par conséquent, elle peut être considérée comme rigide;
- L'oxygène carbonylé est positionné trans à l'hydrogène amide;
- La géométrie de l'électron de valence de l'azote amide a un caractère sp3, et est donc intermédiaire entre le plan tétraédrique et trigonal. Les atomes O-C-N-H dans la liaison peptidique sont généralement considérés comme co-planaires;
- Il y a une charge positive partielle sur l'azote amide (+0,28), et une charge négative partielle sur l'oxygène carbonyle (-0,28);
- Alors que la liaison peptidique est rigide, il existe une seule liaison entre les atomes Ca(1) et C et les atomes N et C(2) qui sont libres de tourner. Ainsi, alors que les atomes Ca(1)-C(O)-N (H)-Ca(2) sont tous planaires, cette liaison peptidique plane a deux degrés de liberté de rotation;
- Ces deux angles de rotation sont connus par les lettres grecques φ (phi) et ψ (psi). ψ est l'angle de rotation près de la liaison Ca(1)-C et φ est l'angle de rotation près de la liaison N-Ca(2). Ceux-ci sont également appelés angles de "chaîne principale";
- Ce sont ces deux degrés de liberté de rotation qui permettent aux polypeptides de se replier en conformations uniques.
Trois acides aminés reliés par liaison peptidique sont appelés tripeptides, puis tétrapeptide et ainsi de suite.
Liste des dipeptides
Les dipeptides sont les suivants :
- carnosine,
- ansérine,
- homoansérine,
- kyotorphine,
- balenine (ou ophidine),
- aspartame,
- glorine,
- barettine,
- pseudoproline,
- glutamyl tryptophane,
- glycylglycine.
Transport des nutriments, régulation des dipeptides
Les dipeptides et tripeptides sont absorbés de la lumière intestinale dans la cellule par la famille des transporteurs PEPT, qui s'appuie sur le gradient électrochimique de l'hydrogène pour fournir l'énergie nécessaire au transport.
Les acides aminés libres et les dipeptides alimentaires stimulent la transcription du gène PEPT et augmentent l'ARNm PEPT ainsi que l'abondance des protéines, conduisant à des taux d'absorption des peptides améliorés. Il a également été démontré que des augmentations de la concentration de dipeptide luminal augmentent la stabilité de l'ARNm de PEPT.
Par conséquent, les augmentations des niveaux de protéines alimentaires augmentent généralement le transport des peptides à travers la membrane de la bordure en brosse. Cependant, la régulation du transport des peptides à travers la membrane basolatérale n'est pas connue.
Les dipeptides d'histidine et leurs dérivés jouent un rôle important dans divers processus physiologiques et pathologiques.
Oxydation médiée par l'acide hypochloreux des dipeptides
Les dipeptides sont un bon modèle pour l'étude de la réaction d'oxydation du squelette protéique. En effet, les dipeptides ont une structure chimique simple qui permet de faire la distinction entre la sensibilité de la liaison peptidique à l'oxydation et d'autres groupes fonctionnels sur les résidus d'acides aminés. La réaction de quatre dipeptides différents avec deux équivalents d'acide hypochloreux démontre que le principal produit formé est la dichloramine.
La dichloramine peut subir une hydrolyse supplémentaire pour former des N-chlorimines et éventuellement subir une désamination pour former des carbonyles. La liaison peptidique a été formée pour être extrêmement stable en réponse à un traitement hypochloreux. L'exposition à l'acide hypochloreux même pendant plusieurs jours n'a pas entraîné de chloration de la liaison peptidique.
Synonymes, antonymes
Voir tous les synonymes pour "dipeptide".1 synonyme (sens proche) de "dipeptide" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à DIPEPTIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot DIPEPTIDE est dans la page 3 des mots en D du lexique du dictionnaire.
Mots en D à proximité
dioxyde de carbone dioxyde de silicium dioxyde de soufre dioxygénase dioxygène dipeptidediphycerque diphyodontediplanétismediplobacille diplobionte
En rapport avec "dipeptide"
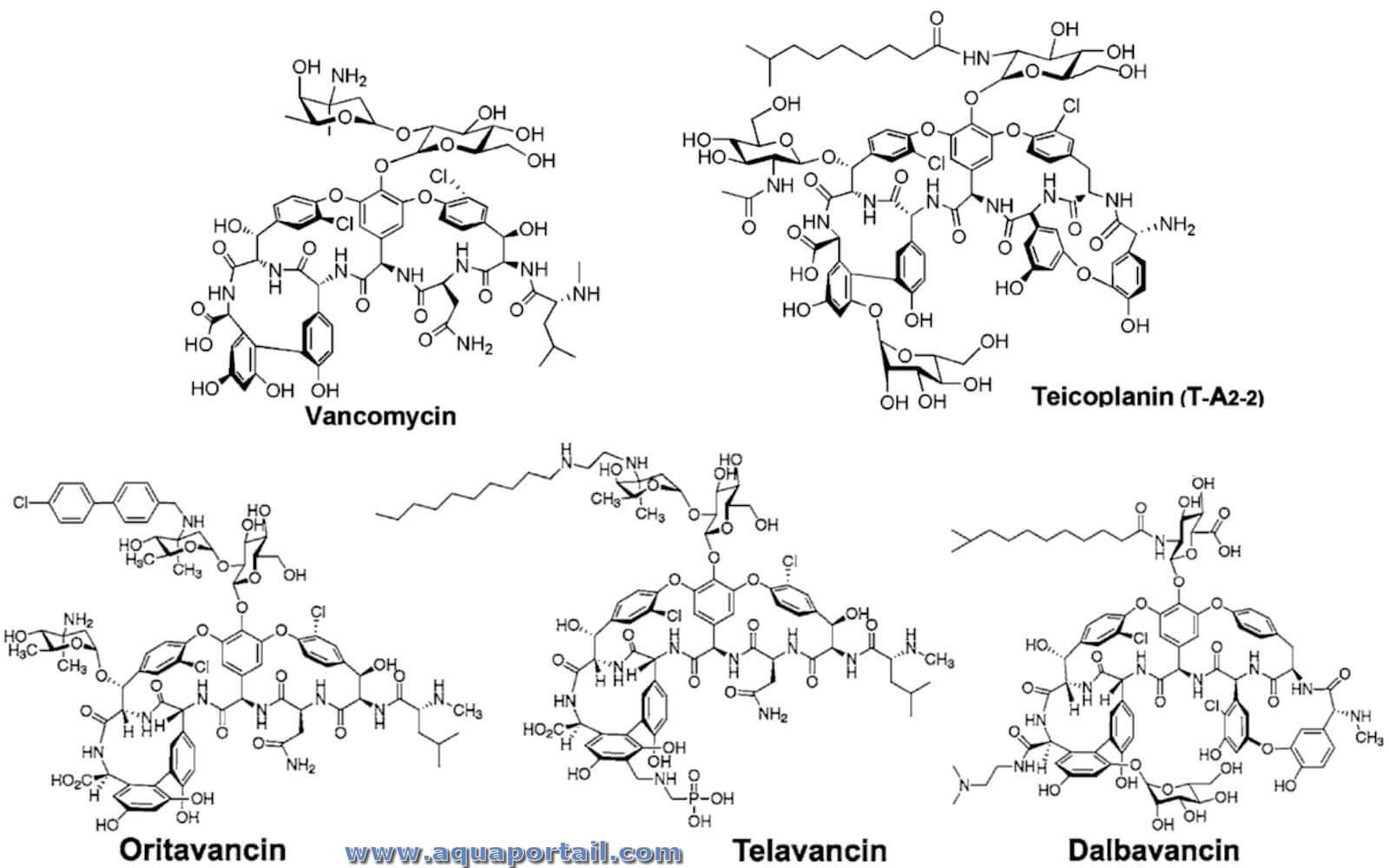
Un glycopeptide est un composé formé d'un peptide de glycoprotéine et d'une partie glucidique.
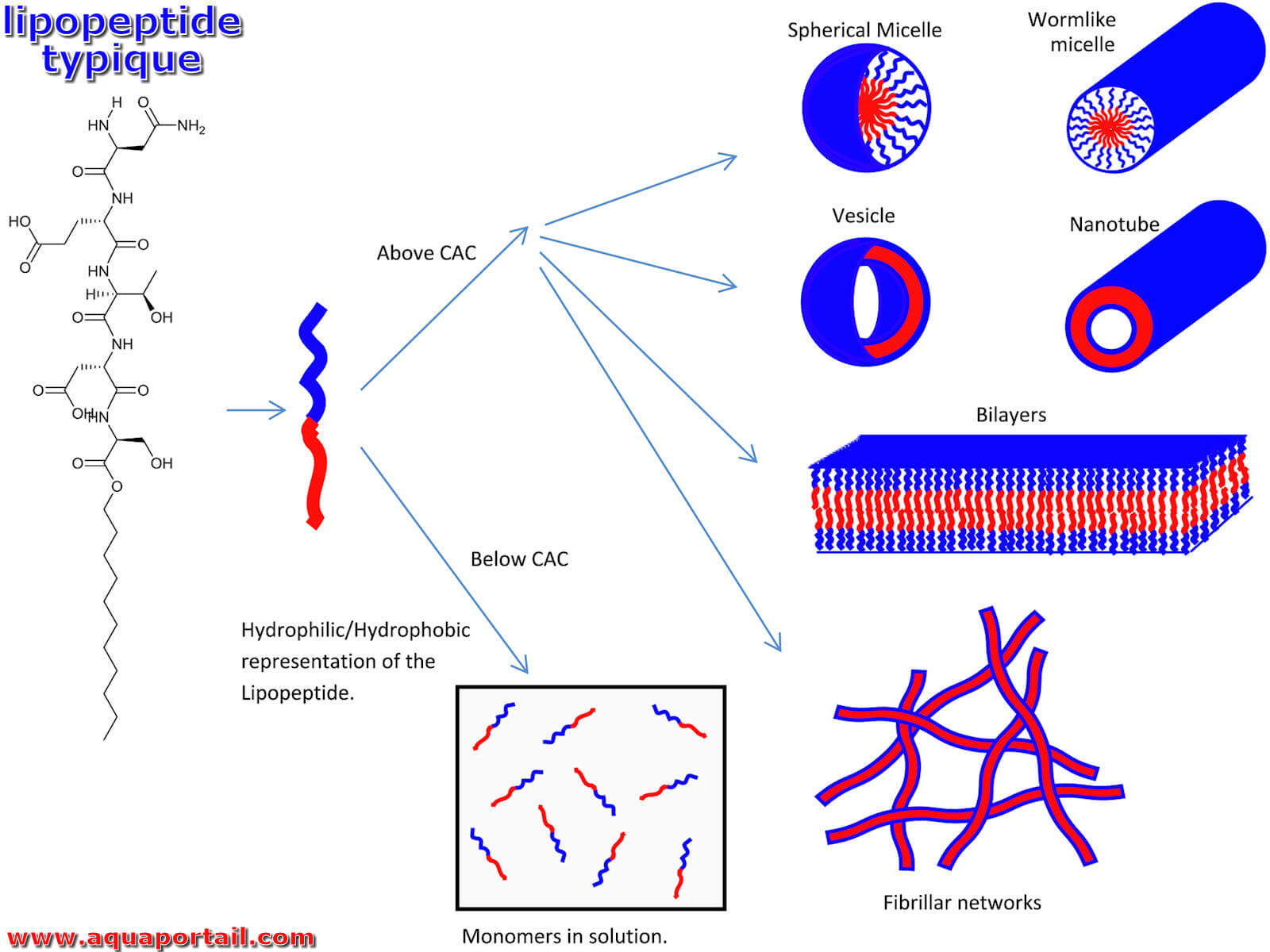
Un lipopeptide est une molécule constituée d'un lipide connecté à un peptide. Les lipopeptides sont typiques du monde bactérien, en étant capables...
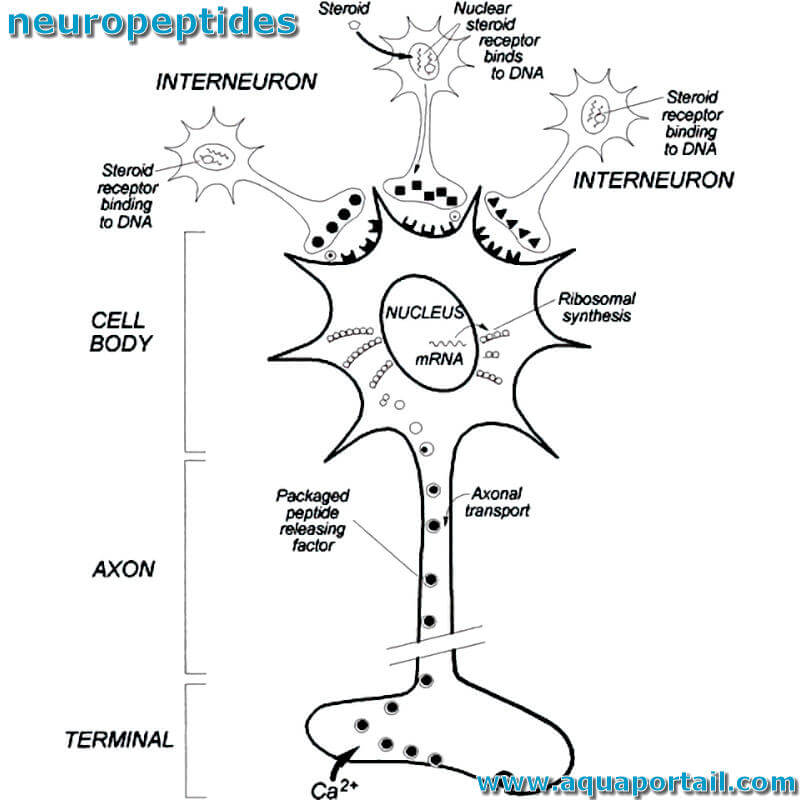
Un neuropeptide est une petite molécule, formée par l'union de 3 acides aminés ou plus et est un peptide qui montre une action sur le système nerveux.

Un oligopeptide détient peu de peptides, mais en possède quand même, avec un faible nombre d'acides aminés.
