Hydrolase
Définition
Une hydrolase est une enzyme responsable de la catalyse du clivage de substrats moléculaires de grande taille en composants plus petits, par un processus impliquant l'incorporation d'une molécule d'eau pour rompre une liaison chimique. Par exemple, les lipases décomposent les graisses, et les protéases ciblent les protéines pour les dégrader.
Comparaison entre hydrolase et transférase :
En haut, une hydrolase; en bas, une transférase.
Explications
Une hydrolase est un type d'enzyme qui catalyse une hydrolyse d'une liaison chimique, une dilution aqueuse avec l'eau H2O. Chez l'Homme, plus de 400 hydrolases sont connues comme actives dans le corps.
Les hydrolases sont des enzymes qui clivent hydrolytiquement des esters, des éthers, des peptides, des glycosides, des anhydrides d'acide ou des liaisons CC dans une réaction réversible. Ils forment le troisième groupe de la classification CE des enzymes. Leurs représentants comprennent des peptidases, des nucléases, des phosphatases, des glycosidases, des estérases. Un proche est, par exemple, une endolysine.
Pour identifier les principes qui confèrent la spécificité de la réaction de transférase par rapport à l'hydrolase, deux enzymes qui utilisent des appareils catalytiques très similaires ont été utilisées pour catalyser la transglycosylation (une réaction de transférase) ou l'hydrolyse des liaisons α-1,3-glucanes dans le tétrasaccharide cyclique cycloalternane.
La nomenclature systématique se dénomme à ces enzymes comme substrat d'hydrolase; cependant, la nomenclature traditionnelle des substrats est encore utilisée. Par exemple, l'acide nucléique hydrolase est connue sous le nom de nucléase. Les enzymes digestives appartiennent à cette catégorie. Par exemple, la pectinase a le numéro EC 3.2.1.15. La classification des enzymes par numéro CE place les hydrolases dans la catégorie EC 3. Il existe également 13 sous-classes supplémentaires, constituées sur la base du type de liaison hydrolysée par l'enzyme.
Par exemple, une enzyme qui catalyse la réaction suivante sera une hydrolase : A-B + H2O → A-OH + B-H.
Voir aussi la phosphorylase, les amidases, amylases, ATPases, ATP synthases, lactase, pepsines, trypsines, uréase, carboxypeptidase, chymotrypsine, désoxyribonucléase (DNAse).
Propriétés
Les hydrolases jouent un rôle essentiel dans divers processus biologiques, notamment la digestion, le métabolisme et l'élimination des déchets. En facilitant la décomposition de macromolécules complexes telles que les protéines et les lipides en unités plus simples, les hydrolases permettent leur utilisation pour la production d'énergie et la synthèse biomoléculaire.
Les hydrolases interviennent dans des réactions enzymatiques appelées hydrolyses, où une molécule d'eau (H2O) sert de réactif pour rompre les liaisons chimiques au sein d'une molécule de substrat.
Dans ces réactions, la molécule d'eau participe à la division du substrat en deux entités plus petites. Par exemple, les protéines sont hydrolysées en acides aminés, tandis que les graisses sont décomposées en acides gras et en glycérol.
L'altération de la synthèse de cette classe chimique d'enzymes, généralement sur une base génétique, détermine une série de pathologies appartenant au groupe hétérogène des maladies de stockage lysosomales.
Rôles
Les hydrolases facilitent la décomposition des nutriments alimentaires en unités plus petites, assurant ainsi leur absorption efficace et leur utilisation ultérieure par l'organisme. Elles contribuent à l'élimination des déchets en dégradant des composés complexes en formes plus simples, facilement excrétées par l'organisme.
Les enzymes hydrolitiques font partie intégrante des voies métaboliques, où elles permettent la conversion des biopolymères en structures monomères essentielles à la production d'énergie et aux processus cellulaires.
Les hydrolases sont universellement présentes dans les cellules vivantes, soulignant leur rôle indispensable au maintien des fonctions physiologiques vitales.
Au-delà de leurs rôles biologiques, les hydrolases sont exploitées dans divers secteurs tels que l'agroalimentaire, les formulations pharmaceutiques et la synthèse chimique, en raison de leur utilité en catalyse dans des conditions contrôlées.
Principaux types
Les principaux types d'hydrolases sont :
- lipases : spécialisées dans l'hydrolyse des lipides pour produire des acides gras et du glycérol.
- protéases (peptidases) : catalysent la dégradation des protéines en peptides et en acides aminés.
- amylases : présentes dans la salive et le pancréas, ces enzymes décomposent les molécules d'amidon en sucres plus simples.
- glycosidases : responsables du clivage des liaisons glycosidiques des glucides, libérant ainsi les monosaccharides.
- estérases : ciblent les liaisons esters de divers composés, facilitant ainsi leur décomposition.
Hydrolase acide
L'hydrolase acide lysosomale qui hydrolyse les esters d'acide phosphorique joue un rôle important dans l'absorption et le métabolisme des glucides, des nucléotides et des phospholipides.
Alors que les hydrolases acides solubles sont transportées vers les lysosomes ou les vacuoles via des endosomes tardifs, de nombreuses protéines transmembranaires sont transportées directement du TGN vers les lysosomes ou les vacuoles dans des vésicules générées par le complexe tétramérique AP-3. AP-3 est un effecteur Arf1, et il semble ne pas interagir avec la clathrine, ce qui suggère que AP-3 a des propriétés à la fois d'adaptateur et de manteau. Comme AP-1, AP-3 reconnaît les signaux peptidiques dans les queues cytosoliques des protéines transmembranaires.
Les hydrolases acides sont les produits glycoprotéiques de 40 à 50 gènes nucléaires non liés. Ils subissent une forme unique de traitement post-traductionnel par lequel ils acquièrent le marqueur de reconnaissance du mannose 6-phosphate (Man 6-P) qui les cible vers les lysosomes. La biosynthèse, le tri et le transport de ces produits géniques vers les lysosomes dans les cellules normales impliquent trois niveaux de reconnaissance.
Premièrement, les hydrolases acides sont séparées, comme toutes les autres glycoprotéines sécrétoires, par la machinerie de reconnaissance de séquence signal qui conduit à la traduction de leurs ARN messagers sur les ribosomes liés à la membrane, leur ségrégation dans l'espace cisternal du réticulum endoplasmique et leur glycosylation co-traductionnell
.
Les hydrolases acides, comme de nombreuses autres glycoprotéines de surface cellulaire et de sécrétion, contiennent principalement des oligosaccharides liés à l'asparagine. Ces oligosaccharides sont de trois types généraux, appelés à haute teneur en mannose, hybrides ou complexes
Synonymes, antonymes
Voir tous les synonymes pour "hydrolase".7 synonymes (sens proche) de "hydrolase" :
- amylase
- enzyme hydrolytique
- estérase
- Voir la suite...
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à HYDROLASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot HYDROLASE est dans la page 3 des mots en H du lexique du dictionnaire.
Mots en H à proximité
hydrogéologie hydrogéophytehydrogramme hydrographie hydroïde hydrolasehydrologie hydrologique hydrolysat hydrolysation hydrolyse
En rapport avec "hydrolase"

L'invertase est une enzyme (glycoprotéine de type hydrolase) qui sépare le saccharose en glucose et en fructose.

La lipase est une enzyme essentielle à la dégradation des graisses et des huiles en molécules plus petites, comme les acides gras et le glycérol, facilitant...
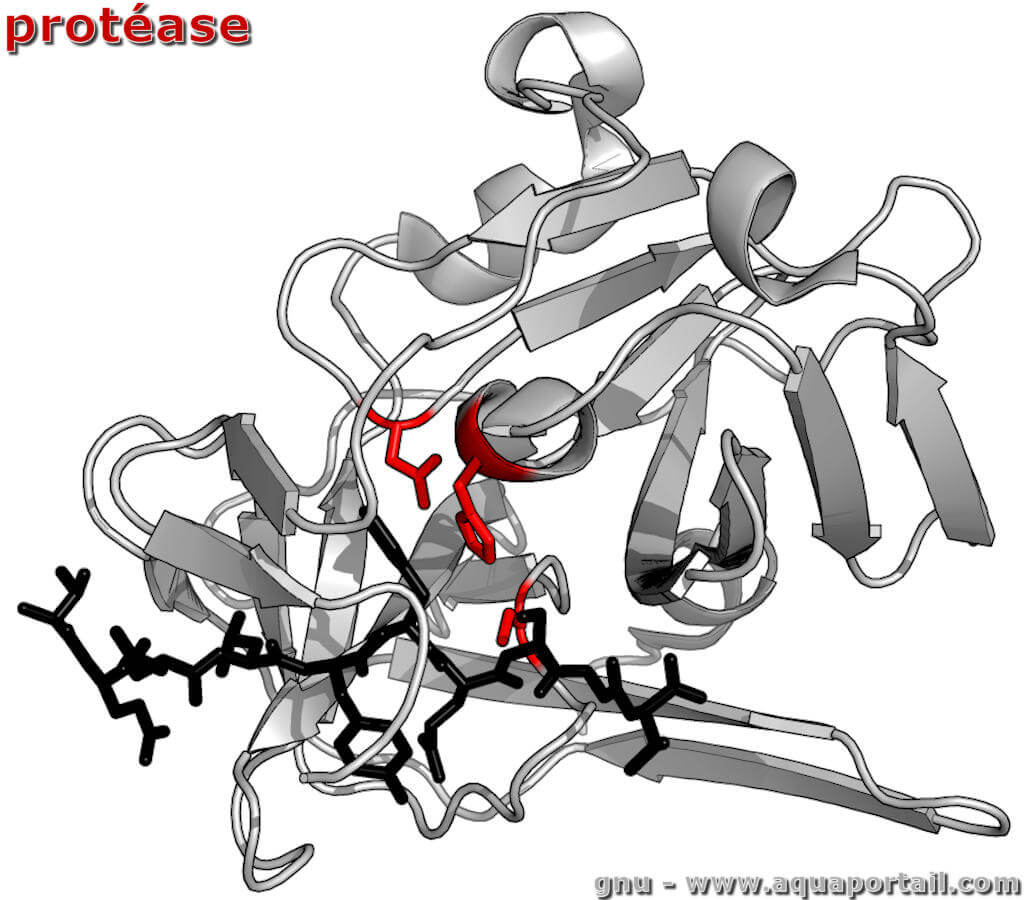
Une protéase est une peptidase, une enzyme protéolytique qui coupe une liaison peptidique au sein d'une séquence protéique, mais pas aux extrémités.
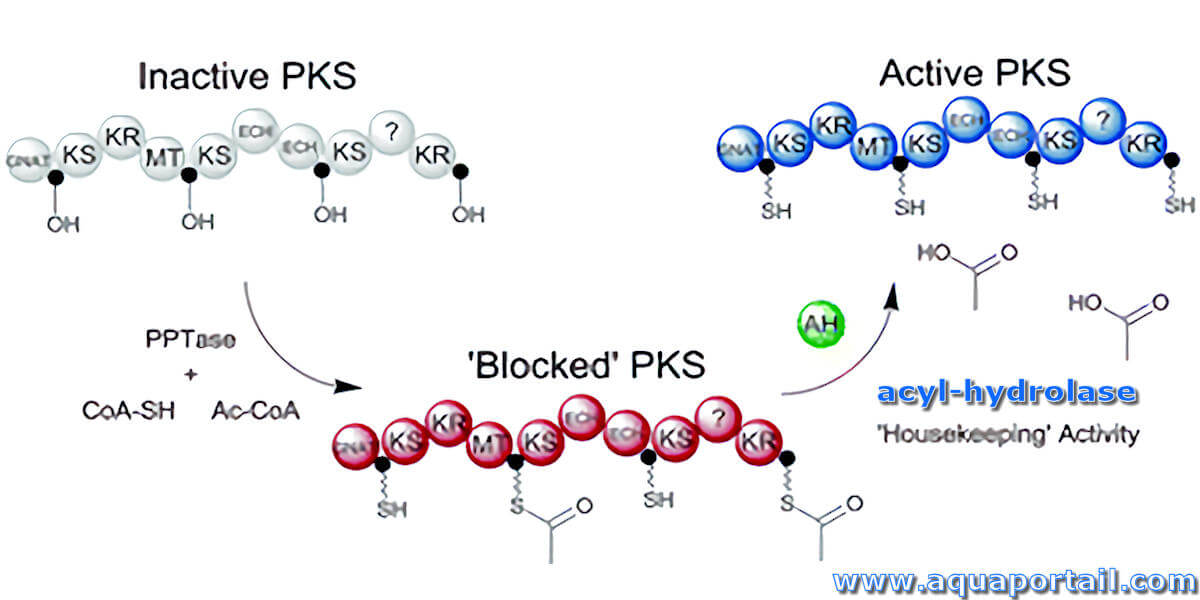
Une acyl-hydrolase est une enzyme de type hydrolase à radical (R-CO)- susceptible de dissoudre les molécules à liaison acyle en fixant de l'eau.
