Phosphatase
Définition
Une phosphatase est une enzyme du groupe des estérases qui catalyse l'élimination des groupes phosphate de certains substrats, entraînant la libération d'une molécule d'ion phosphate et l'apparition d'un groupe hydroxyle à l'endroit où que le groupe phosphate était estérifié. Ils appartiennent à la classe enzymatique EC 3.1.-.
Dosage de protéine phosphatase :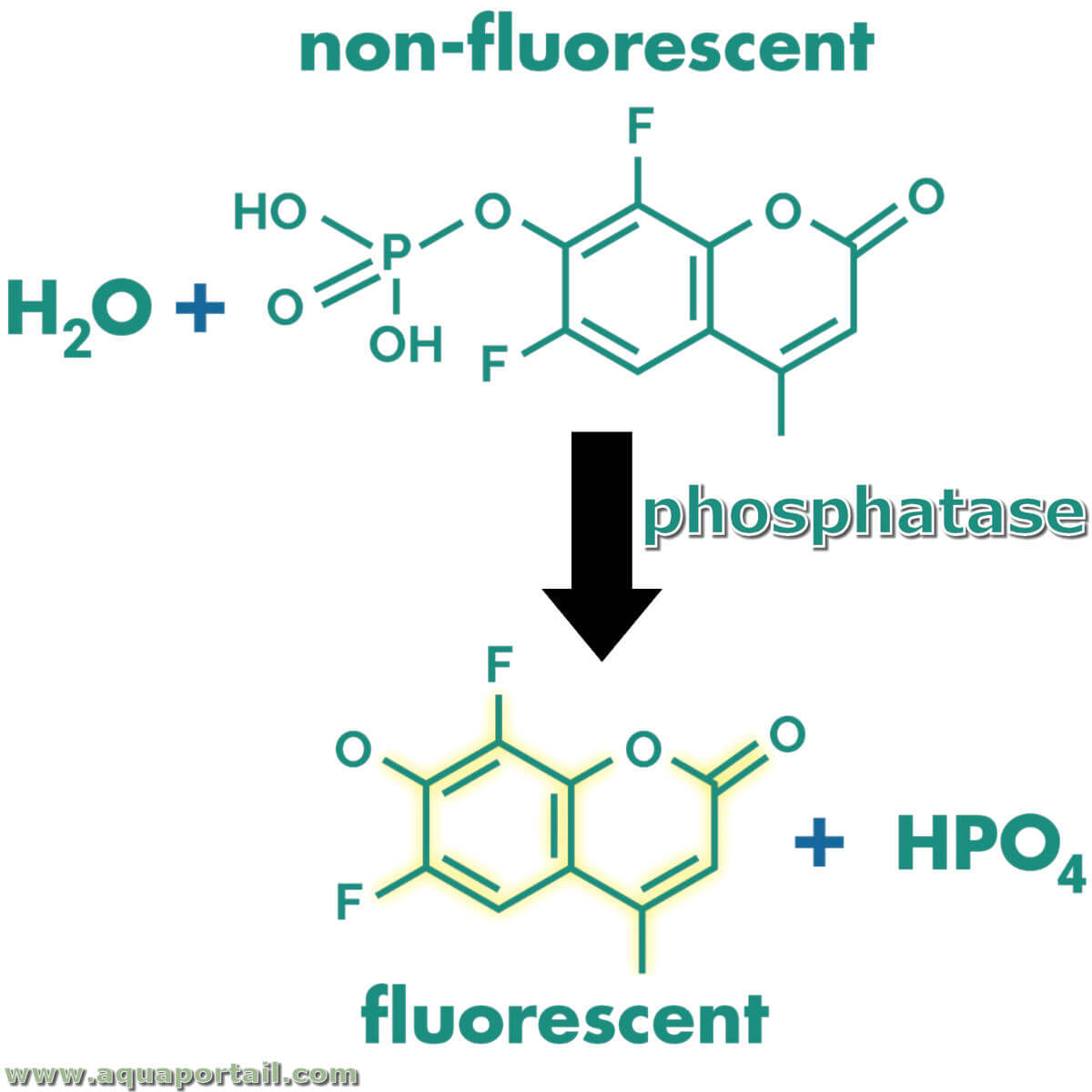
Le dérivé fluoré de phosphate de méthylumbelliféryle (MUP) est utilisé comme substrat pour une large gamme de dosages de protéine phosphatase. Le produit de réaction de DiFMUP est fluorescent après déphosphorylation.
Explications
es phosphatases sont un groupe d'enzymes qui séparent l'acide phosphorique par hydratation à partir d'esters d'acide phosphorique ou de polyphosphates. Elles effectuent la réaction inverse d'une kinase. Les représentants les plus connus de ce groupe sont les enzymes appelées phosphatases acides et phosphatases alcalines, nommées d'après leur pH optimal. Le plus souvent, les nucléases clivant les acides nucléiques qui dépolymérisent l'ADN ou l'ARN (démontage en fragments).
Cette réaction, la déphosphorylation est opposée à celle de la phosphorylation (réalisée par les enzymes kinases). La classe enzymatique est EC 3.1.3.
Voir aussi l'acide phosphatidique.
Classification des phosphatases
Les phosphatases peuvent être classées en deux groupes, selon leur structure protéique : les phosphatases dépendantes de la cystéine (elles ont besoin de cet acide aminé dans le centre actif pour être fonctionnelles) et les métallophosphatases (métalloenzymes nécessitant donc des molécules métalliques pour catalyse).
Les phosphatases à double spécificité sont subdivisées en trois groupes, DSP1, DSP2, DSP4 et DSP5 dans le groupe I, DSP6, DSP7, DSP9 et DSP10 dans le groupe II et DSP8 et DSP16 dans le groupe III, où le groupe III possède des séquences PEST. Ci-dessous, localisez DSP1, DSP2, DSP4 et DSP5 dans le noyau, DSP6, DSP7 et DSP16 dans le cytosol, DSP8, DSP9 et DSP10 dans les deux compartiments et DSP18 et DSP21 dans les mitochondries. Les protéines phosphatases à double spécificité sont inhibées par l'orthovanadate.
Protéines phosphatases
Les protéines phosphatases éliminent les résidus de phosphate attachés par les protéines kinases aux résidus d'acides aminés (principalement la sérine et la thréonine ou la tyrosine). La phosphorylation et la déphosphorylation sont des composants importants de la transduction du signal, par exemple. Comme dans le métabolisme, les enzymes affectées sont ainsi modulées dans leur activité. Ainsi, toutes les enzymes impliquées dans la dégradation du glycogène (phosphorylase kinase, glycogène phosphorylase) sont actives à l'état phosphorylé, tandis que l'enzyme de synthèse (UDP-glycogène synthase) est inactive. Les phosphatases inversent ces conditions.
Près de 20 000 phosphoprotéines enregistrées avec plus de 206 000 sites de phosphorylation existent en 2013. Environ 86 % des phosphoprotéines de mammifères sont modifiées sur les sérines, environ douze pour cent sur les thréonines et environ deux pour cent sur les tyrosines. Un peu moins de quatre pour cent des protéines humaines sont des protéines phosphatases. Il existe quatre classes de protéines phosphatases, de phosphatases alcalines, de protéines phosphatases spécifiques à Ser/Thr, spécifiques à Tyr ou à double spécificité.
Les phosphatases alcalines sont les protéines de l'intestin, non seulement les déphosphorylates, mais aussi certaines isoenzymes sont inhibées par l'homoarginine ou le lévamisole et ses dérivés, d'autres par l'imidazole.
Les protéines phosphatases spécifiques Ser/Thr sont en outre subdivisées en type I ou type II. Les phosphatases de type I telles. Les protéines PP1 sont inhibées par les protéines inhibitrices thermostables 1 et 2 et déphosphorylent préférentiellement la sous-unité β de la phosphorylase kinase. Les phosphatases de type II se distinguent après activation spontanée (sous-type A), activation dépendante de Ca2+ ou Mg2+, et déphosphorylation préférentielle de la sous-unité a de la phosphorylase kinase. Les phosphatases spécifiques de Ser/Thr sont inhibées par l'acide okadaïque, la calyculine A, la cyclosporine, le FK-506, la microcystine-LR, la tautomycine, la fostriécine et la cantharidine, avec une activité variable contre les différentes isoformes.
Les protéines phosphatases spécifiques de Tyr ont un domaine de protéine catalytique partagé conservé, inhibé par l'orthovanadate, le peroxovanadate et le fluorure de sodium.
Clivage des têtes de phosphate
Les phosphatases d'acide phosphatidique sont une famille d'enzymes qui peuvent cliver les têtes de phosphate de LPA, PA et S1P. Les phosphatases acides phosphatidiques peuvent être divisées en deux familles d'enzymes, les LPP, qui clivent les têtes phosphate des lipides sur la face externe de la membrane plasmique, et les lipines, qui clivent l'AP de manière intracellulaire. Les phospholipases sont des régulateurs critiques de la libération de composés bioactifs contenus dans les phospholipides et de l'activité physiologique ultérieure de ces composés.
Phosphates lipidiques phosphatases (LPP)
Les phosphates lipidiques phosphatases (LPP) sont un groupe d'enzymes appartenant à la famille des phosphatases/phosphotransférases. Les LPP déphosphorylent l'acide phosphatidique, l'acide lysophosphatidique (LPA), la sphingosine-1-phosphate (S1P), la céramine-1-phosphate (C1P) et le pyrophosphate de diacylglycérol. Les LPP sont généralement localisées sur les membranes plasmiques, la feuille externe contenant le site actif. Les LPP peuvent également s'exprimer sur les membranes du réticulum endoplasmique (RE) et de l'appareil de Golgi, permettant le métabolisme des phosphates lipidiques internes.
Les LPP modifient les concentrations de phosphates lipidiques et de leurs produits déphosphorylés pour réguler la signalisation cellulaire. Les LPP régulent la signalisation cellulaire par la déphosphorylation des lipides bioactifs. Comme mentionné ci-dessus, les LPP déphosphorylent les produits lipidiques tels que le LPA, le S1P et le C1P. Le LPA active les PPAR et les récepteurs nucléaires LPA1, entraînant une augmentation des voies de transcription et de signalisation cellulaire telles que celles impliquées dans la prolifération cellulaire, la migration, la mobilisation du calcium, etc.
Synonymes, antonymes
Voir tous les synonymes pour "phosphatase".0 synonyme (sens proche) pour "phosphatase".
1 antonyme (sens contraire) :
- enzyme kinase
Les mots ou les expressions apparentés à PHOSPHATASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PHOSPHATASE est dans la page 3 des mots en P du lexique du dictionnaire.
Mots en P à proximité
phoque commun phoque gris phoque veau-marin phorésie phosphagènephosphatasephosphate phosphate bicalcique phosphate de sucre phosphate nitrique phosphatidylcholine
En rapport avec "phosphatase"
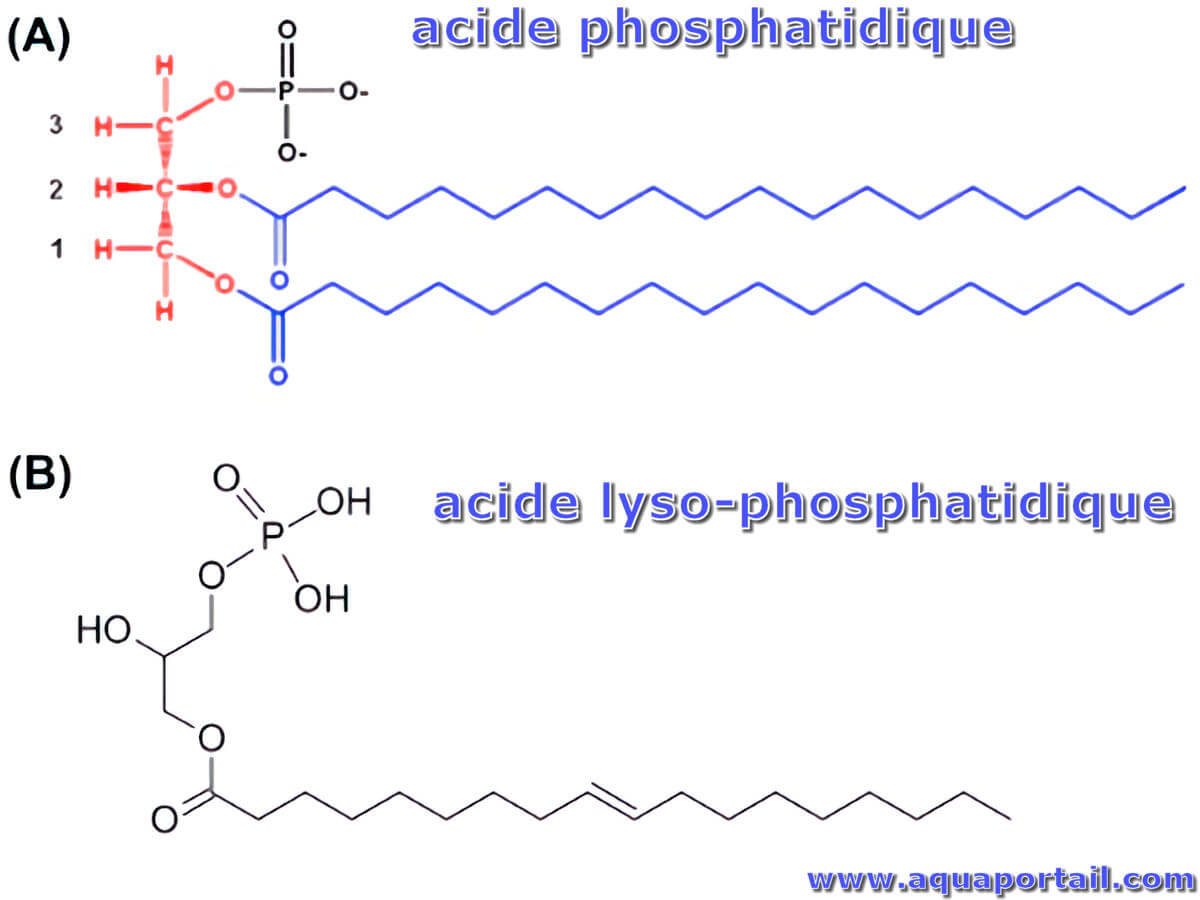
L'acide phosphatidique (PA) est un médiateur lipidique dans les fluides biologiques et les tissus.
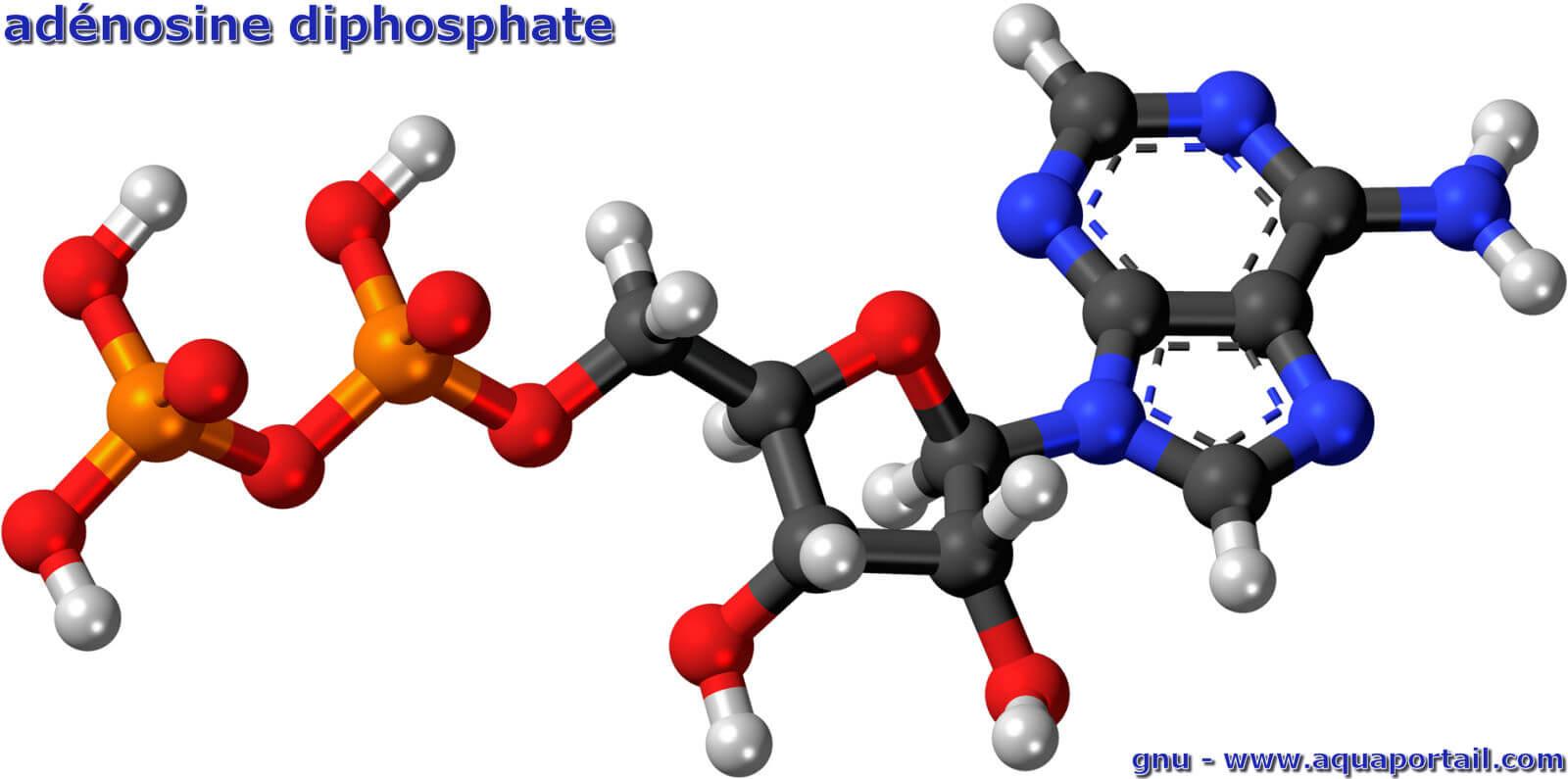
Une adénosine diphosphate, l'adénosine ADP, désigne une substance produite lorsqu'on hydrolyse de l'ATP (adénosine triphosphate) et que de l'énergie...
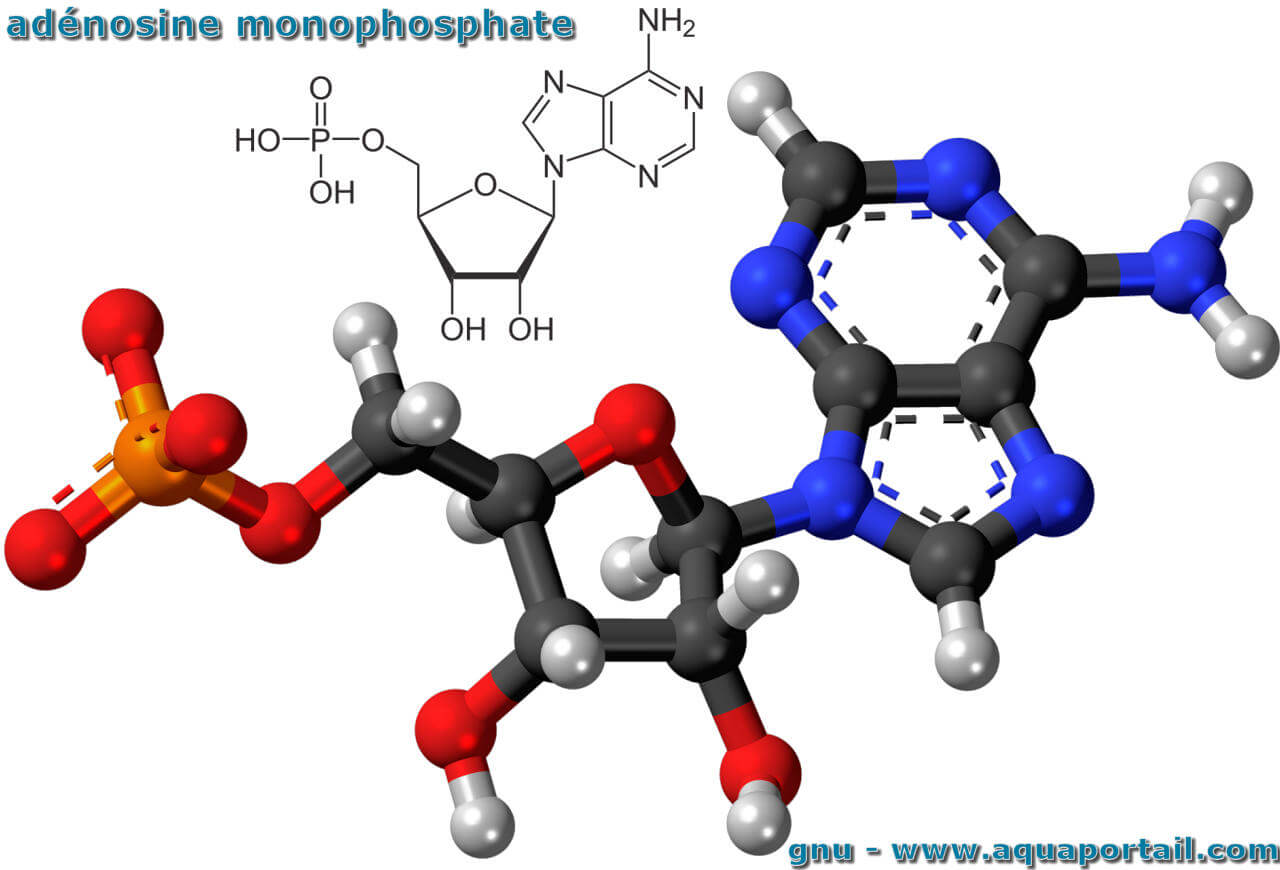
L'adénosine monophosphate, en abrégé AMP, est un ester de l'acide phosphorique avec un nucléoside, l'adénosine.

L'adénosine triphosphate (ATP) est une molécule qui transporte l'énergie à l'intérieur des cellules.
