Tyrosine
Définition
La tyrosine, Tyr ou Y, désigne un acide aminé hydrophile constitutif relativement grand avec une chaîne latérale aromatique, des protéines et précurseur des hormones thyroïdiennes et des catécholamines. Elle est formée par hydroxylation de la phénylalanine par une phénylalanine hydroxylase en présence d'une coenzyme, la bioptérine. Sa dégradation aboutit à l'acide fumarique et à l'acide acétylacétique.
Une molécule de L-tyrosine :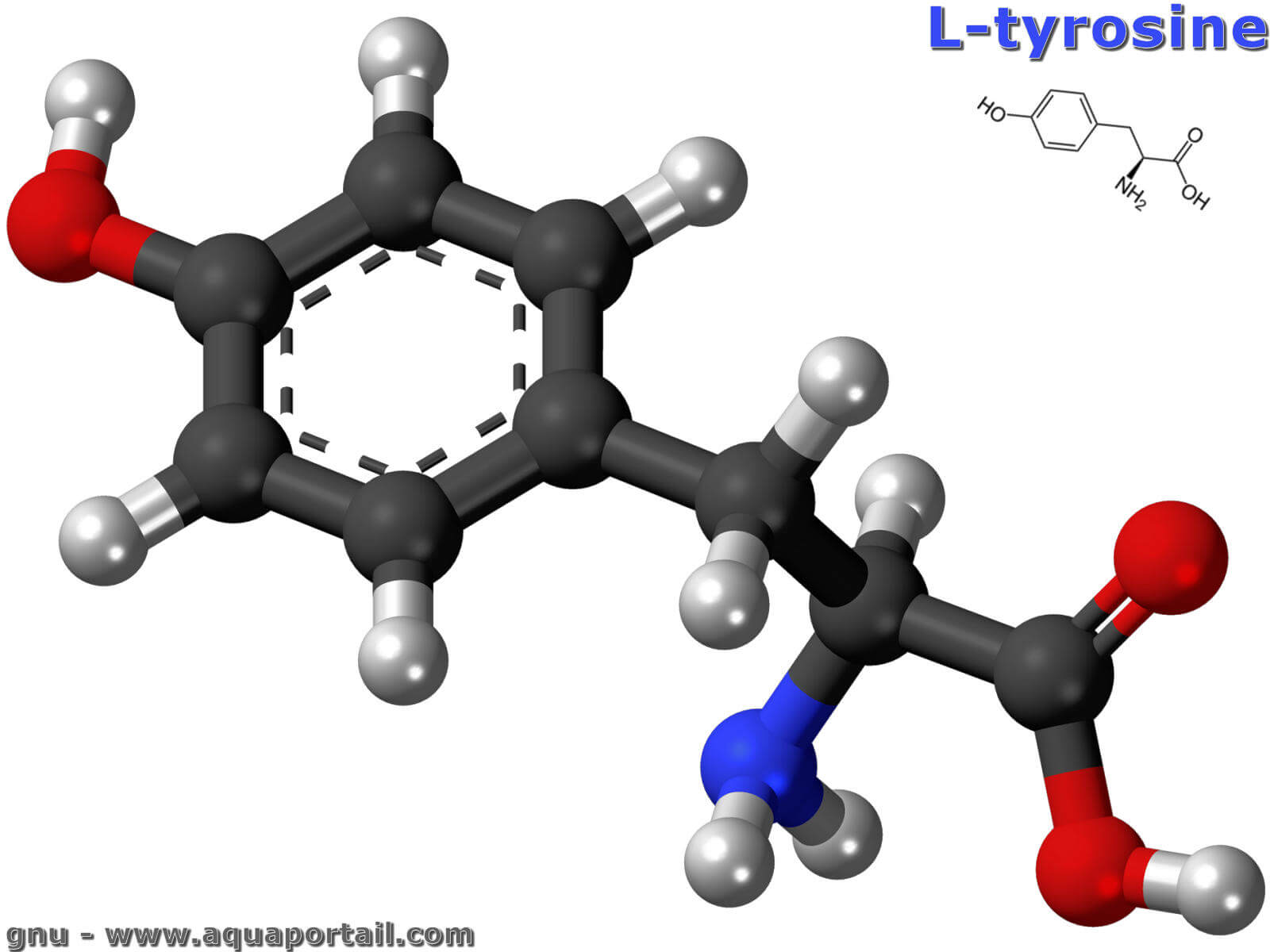
La tyrosine fait partie de presque toutes les molécules de protéines de toutes les formes de vie.
Explications
La tyrosine est l'un des 20 acides aminés qui forment les protéines. Il est classé comme acide aminé non essentiel chez les mammifères (humains et animaux) puisque sa synthèse provient de l'hydroxylation d'un autre acide aminé : la phénylalanine. Cela est utile tant que le régime alimentaire des mammifères contient un apport suffisant en phénylalanine. Par conséquent, l'acide aminé phénylalanine est essentiel.
Comme tous les acides aminés, elle est formée par un carbone central alpha lié à un atome d'hydrogène (-H), un groupe carboxyle (-COOH), un groupe amine (-NH2) et une chaîne latérale. Dans la tyrosine, la chaîne latérale est un groupe phénolique.
Le mot tyrosine (parfois appelée hydroxyphénylalanine) vient du grec tyros, qui signifie fromage. Elle porte le nom de cet acide aminé découvert par un chimiste allemand, Justus von Liebig, issu de la protéine de caséine présente dans le fromage.
On connaît trois isomères différents de l'acide aminé tyrosine : la para-tyrosine, la métatyrosine et l'ortho-tyrosine. Bien que la forme la plus connue et la plus étudiée soit la para-tyrosine ou encore appelée L-tyrosine. Les codons sont : UAU, UAC.
Iodotyrosine
Une iodotyrosine est un type de tyrosine combinée à un (mono-iodotyrosine) ou deux (di-iodotyrosine) atomes d'iode et formée lors de l'iodation de la thyroglobuline pour synthétiser les hormones thyroïdiennes. Le mono-iodotyrosine, plus connu sous le sigle MIT, est un dérivé mono-iodé de la tyrosine se formant dans le colloïde des follicules thyroïdiens.
Diiodotyrosine
Une diiodotyrosine est un produit intermédiaire de la synthèse des hormones thyroïdiennes, formé d'une tyrosine liée à deux atomes d'iode. Elle se lie à la mono-iodotyrosine pour former la triiodotyronine ou hormone T3 ou à une autre diiodotyrosine pour former la thyroxine ou hormone T4.
Pour la tyrosine kinase, voir protéine kinase.
Généralités
La tyrosine est le produit de départ pour la production d'un certain nombre d'hormones et de neurotransmetteurs importants. Ces molécules signal constituent une partie centrale du système nerveux sympathique et leurs concentrations dans le corps et le cerveau dépendent directement de l'absorption de tyrosine par les aliments ou de la biosynthèse. C'est également la matière première principale du pigment organique mélanine, responsable de la couleur des cheveux et de la peau. La tyrosine joue également un rôle important dans les processus de communication cellulaire (transduction du signal), par exemple en provoquant des modifications cellulaires dues au couplage d'une hormone à un récepteur membranaire ou en régulant l'activité enzymatique.
La tyrosine existe sous deux formes, les formes énantiomères L et D, dont seule la forme L est naturelle. En raison de la présence d'un groupe hydroxyle phénolique, il s'agit d'un acide aminé polaire. En raison de sa structure spéciale, la tyrosine a des propriétés à la fois hydrophiles et hydrophobes. Elle est appelée tyrosyle lorsqu'il est appelé groupe fonctionnel ou chaîne latérale.
Une pénurie de tyrosine (et de son précurseur phénylalanine) entraîne une pénurie de dopamine et de noradrénaline, qui s'accompagne, entre autres, de dépression et d'apathie. L'effet de la supplémentation en tyrosine a été étudié dans les états suivants : dépression, stress, symptômes de sevrage après l'arrêt de la cocaïne, maladie de Parkinson, phénylcétonurie et narcolepsie, dont l'efficacité n'a pas toujours été démontrée. La tyrosine est vendue comme complément alimentaire et est réglementée conformément aux directives européennes.
Un acide aminé protéinogène
La tyrosine est un acide aminé protéinogène : elle fait partie des vingt éléments constitutifs naturels des protéines. Les acides aminés sont de petites molécules organiques. Ils se lient en très grand nombre dans la cellule puis forment de longues chaînes d'acides aminés. Ces chaînes peuvent ensuite se plier, créant une protéine avec une structure spatiale spécifique. Les protéines régulent le métabolisme, le transport et la communication des cellules dans toutes les formes de vie : dans les plantes, les animaux, les champignons et les bactéries. Ils donnent forme et force aux cellules en vrac et les maintiennent ensemble dans un organisme multicellulaire. La tyrosine est impliquée directement et indirectement dans tous les processus de la vie.
Le mot tyrosine vient du grec tyros), qui signifie "fromage". La tyrosine a été isolée pour la première fois en 1846 par Justus von Liebig à partir de caséine, dans laquelle elle est présente en quantités relativement importantes. Le fromage (surtout la ricotta) et le lait (et d'autres dérivés) sont de bonnes sources de tyrosine. Les petites taches blanches parfois visibles sur le fromage sont des cristaux de tyrosine. Ils témoignent de la protéolyse (décomposition des protéines en acides aminés) lors de la maturation du fromage.
Les autres sources alimentaires de tyrosine sont des produits riches en protéines tels que les oeufs, le boeuf et le porc, la volaille, le poisson et les crustacés. La tyrosine est également commune dans les aliments végétaux riches en protéines tels que le germe de blé, les flocons d'avoine, les amandes, les pacanes, les graines de citrouille, les graines de sésame, les haricots de Lima, les avocats, les pois chiches, les lentilles, le soja et les graines de tournesol.
Propriétés biochimiques
La tyrosine est un solide inodore qui forme des cristaux et a généralement un aspect blanchâtre. Comme tous les acides aminés, la tyrosine est composée de cinq composants, à savoir un atome de carbone central portant quatre groupes différents : un groupe acide, un groupe amino, un atome d'hydrogène et un groupe variable, qui dans le cas de la tyrosine est un groupe méthylphénol. La formule générale de la tyrosine est R-CH(NH2)-COOH. Le R représente le groupe de résidus, où R = -CH2-p-Phényl-OH.
La tyrosine est un élément constitutif important des protéines. Dans les organismes, les acides aminés sont codés par trois bases consécutives (un codon), situées dans l'ARN messager. La tyrosine est codée par les codons UAC et UAU.
La tyrosine est souvent classée comme composé hydrophile par la présence du groupe hydroxyle polaire.Cependant, le noyau aromatique de la molécule est hydrophobe, la tyrosine pouvant alors présenter des propriétés à la fois hydrophiles et hydrophobes, selon les circonstances. Une combinaison de ces propriétés signifie que la tyrosine est peu soluble dans l'eau (479 mg / L). Ainsi, la tyrosine, avec le tryptophane, peut être considérée comme une molécule amphiphile.
Comme la plupart des autres acides aminés (sauf la glycine), la tyrosine présente une isomérie optique permettant deux configurations de la molécule de tyrosine : D (Dextro) et L (Laevo). Seule la forme L est physiologiquement active. La L-Tyrosine a une influence de la main gauche sur la lumière polarisée, ce qui est indiqué par (-). Selon les règles de priorité de Cahn, Ingold et Prelog (règles de CIP), la L-(-)- tyrosine est également (S)-(-)- tyrosine.
La tyrosine absorbe la lumière ultraviolette. L'absorption de la lumière (extinction) dépend notamment du coefficient d'extinction molaire. Cette quantité est liée au type de tissu et à la longueur d'onde de la lumière. La tyrosine a sa plus haute extinction à une longueur d'onde comprise entre 260 et 300 nm. À un pH élevé (pKa = 10), le groupe hydroxyle libère son proton, ce qui entraîne l'extinction de la tyrosine vers des longueurs d'onde plus élevées (vers le rouge).
Biosynthèse chez les plantes et les micro-organismes
Les plantes et la plupart des micro - organismes synthétisent la L-tyrosine via le prefenate, un produit intermédiaire de la voie de l'acide shikimique. Cette voie métabolique est une voie importante pour la synthèse des acides aminés, la coenzyme Q10, les tocophérols, les naphtoquinones (y compris les vitamines du groupe K), les alcaloïdes et les substances naturelles hétérocycliques. Shikimate est formé de précurseurs d'hydrates de carbone et converti en chorismate via une série de réactions enzymatiques. La chorismate mutase catalyse ensuite la conversion du chorismate pour préfener au point de ramification dans la biosynthèse des acides aminés aromatiques tels que la tyrosine et la phénylalanine. Le préphénate est décarboxylé par oxydation pour former du p- hydroxyphényl pyruvate. Le groupe hydroxyle est conservé. Cette molécule est ensuite transaminée en utilisant du glutamate comme source d'azote pour former éventuellement de la tyrosine et de l'α-cétoglutarate.
Biosynthèse chez l'animal et chez l'homme
Alors que les humains et les animaux peuvent synthétiser la plupart des autres acides aminés non essentiels à partir de glucose et d'ammoniac, la tyrosine ne peut être synthétisée qu'à partir de l'acide aminé essentiel phénylalanine dérivé de l'alimentation. La phénylalanine et la tyrosine sont des acides aminés très similaires, à la différence que la tyrosine (également appelée para- hydroxyphénylalanine) contient un groupe hydroxyle sur le noyau aromatique (en position para). En conséquence, la chaîne latérale (groupe résidu) de la tyrosine est moins hydrophobe que celle de la phénylalanine (qui n'a pas de groupe hydroxyle sur le cycle aromatique).
Dans la préparation de la tyrosine à partir de phénylalanine, un groupe hydroxyle est ajouté au cycle phényle de la L-phénylalanine en position para. La conversion a lieu dans le foie, les reins et le cerveau et, dans des conditions normales, la production est suffisante. L'enzyme qui catalyse la réaction est la phénylalanine hydroxylase. Cette enzyme fait partie du groupe plus large d'enzymes pouvant lier un groupe hydroxyle à des substrats : les mono-oxygénases. La bioptérine agit comme un cofacteur dans la réaction. La réaction est irréversible. la synthèse de phénylalanine à partir de tyrosine n'est pas possible.
Chez les enfants prématurés et chez les personnes atteintes d'une maladie du foie, cette conversion (enzymatique) est difficile. Chez les personnes atteintes de phénylcétonurie (PCU), une maladie métabolique, l'enzyme phénylalanine hydroxylase n'est pas du tout active. La tyrosine peut devenir un acide aminé essentiel dans ces circonstances.
Il existe trois isomères de la tyrosine. L'isomère para habituel pouvant être utilisé dans l'organisme provient de l'oxydation enzymatique. Dans des conditions de stress oxydatif, la tyrosine à partir de phénylalanine peut également se former par oxydation non enzymatique due à des radicaux hydroxyles. Cela aboutit aux rares isomères de la méta-tyrosine et de l'ortho-tyrosine.
Production industrielle
Les acides aminés peuvent être produits industriellement en dénaturant et en hydrolysant des sources de protéines. L'hydrolyse a lieu par des enzymes protéolytiques ou par des acides forts tels que l'acide chlorhydrique. Les acides aminés, les dipeptides, tripeptides et oligopeptides résultants peuvent être séparés par centrifugation, (ultra) filtration et chromatographie sur échangeur d'ions.
L'hydrolyse de protéines (contenant de la kératine) dans un environnement acide donne un hydrolysat de protéines après neutralisation, qui est constitué des 20 acides α-aminés utilisés pour la synthèse des protéines. À partir de là, une fraction riche en L- cystéine et L-tyrosine peut être récupérée de manière simple, notamment en séparant les acides aminés hautement solubles dans l'eau, car la L-cystéine et la L-tyrosine sont relativement peu solubles dans l'eau. À ce jour, la plus grande partie de la tyrosine est extraite commercialement par cette méthode de séparation simple. Cette méthode de production présente l'avantage de pouvoir utiliser comme matière première de la biomasse inutilisée riche en protéines et des résidus de différents procédés. Une autre méthode consiste à effectuer une fermentation bactérienne, l'acide aminé pouvant être purifié à partir du milieu de croissance.
Synonymes, antonymes
Voir tous les synonymes pour "tyrosine".1 synonyme (sens proche) de "tyrosine" :
- hydroxyphénylalanine
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TYROSINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot TYROSINE est dans la page 5 des mots en T du lexique du dictionnaire.
Mots en T à proximité
typhon typologietyramine tyroliennetyrosinase tyrosinetyxotrope
En rapport avec "tyrosine"
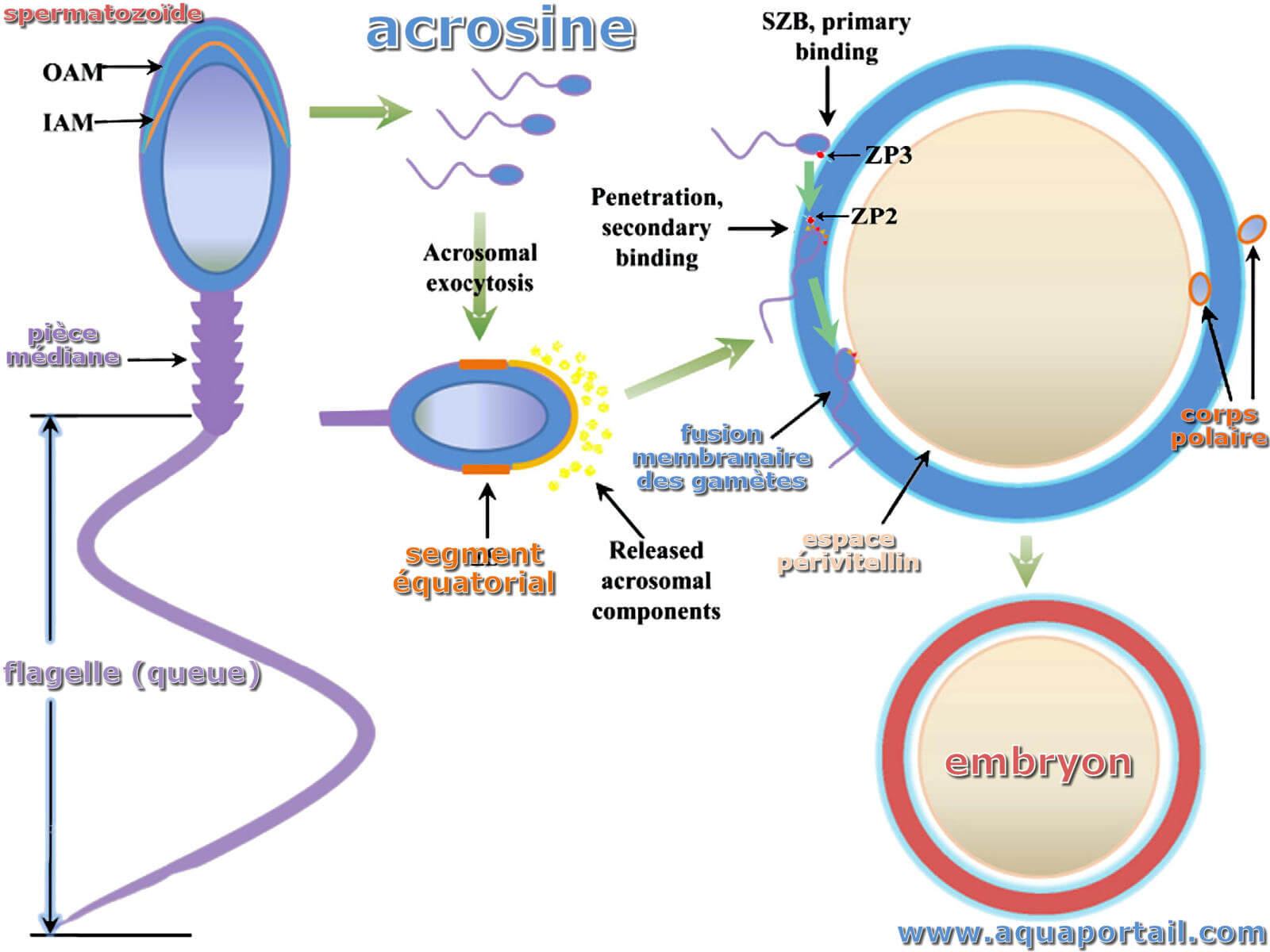
L'acrosine est une enzyme protéolytique (sérine protéase typique) de la membrane interne de l'acrosome dont le rôle est de digérer la membrane pellucide.
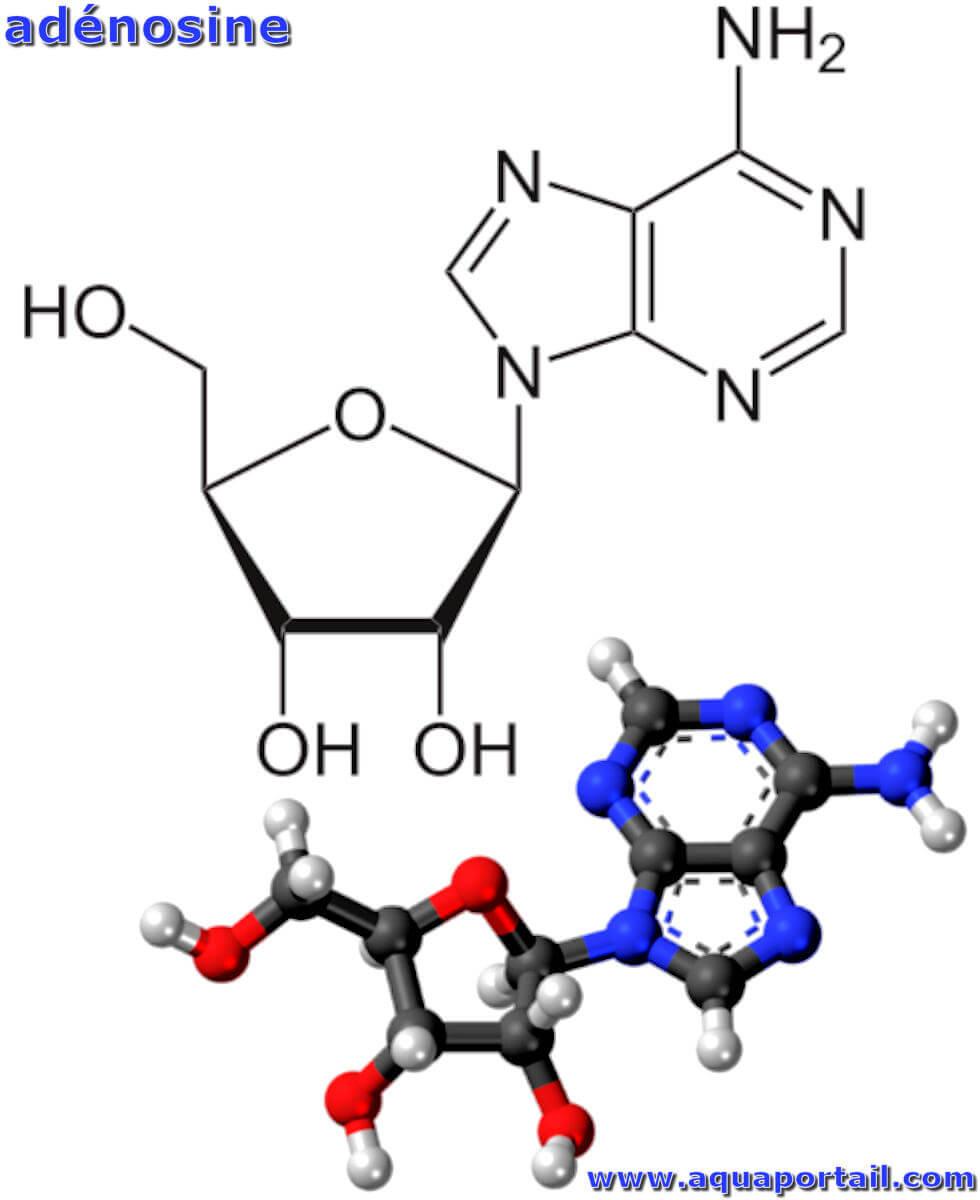
L'adénosine est un nucléoside formé par la liaison de l'adénine à un anneau de ribose (ribofuranose) par une liaison bêta-N₉ glycosidique.
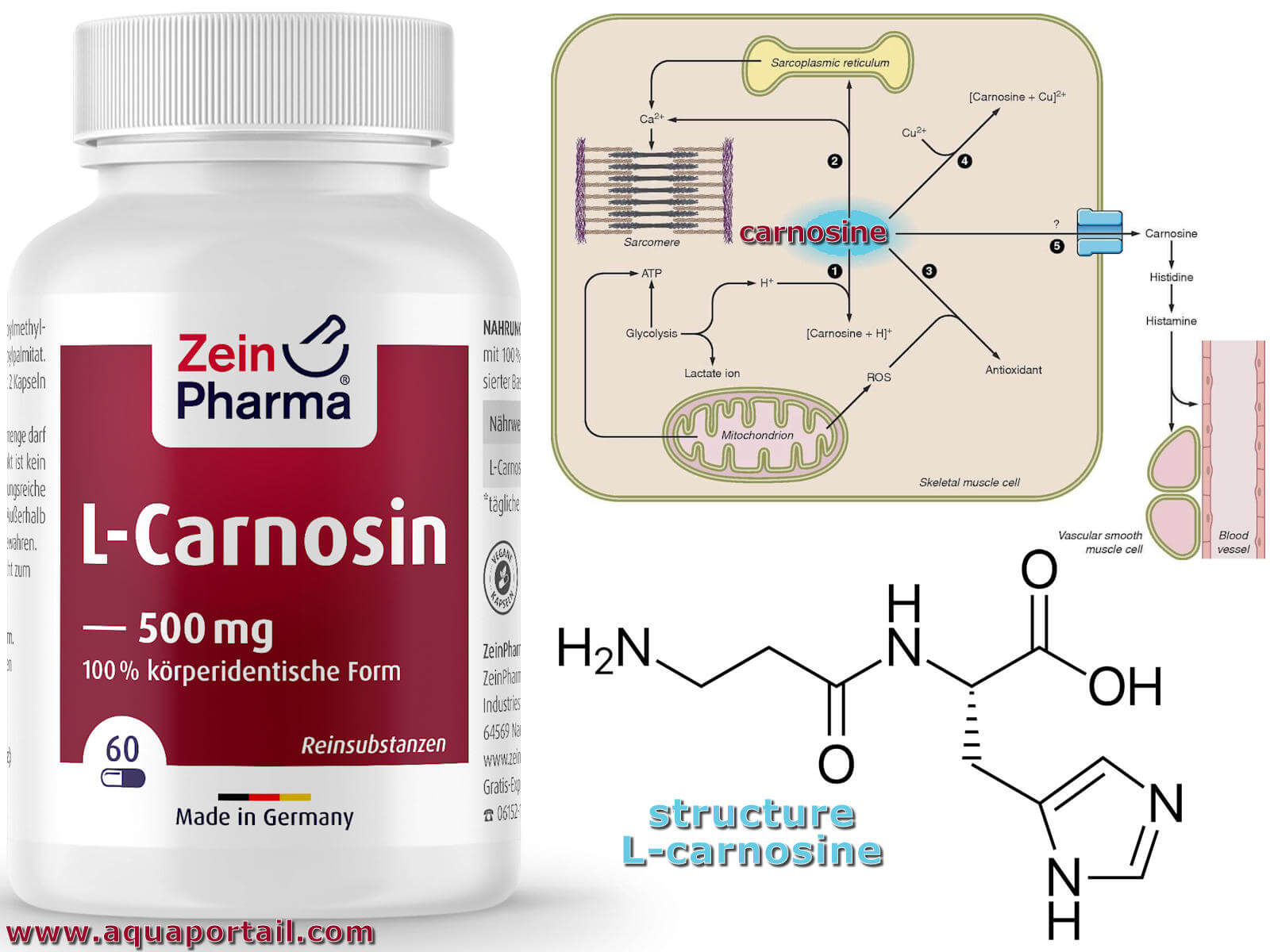
La carnosine est un dipeptide des muscles striés formé de β-alanine et d'histidine. Elle est un activateur d'enzymes musculaires. La carnosine est présente...

La chymosine (rennine) est l'enzyme gastrique des jeunes mammifères qui catalyse la transformation du caséinogène soluble du lait en caséine insoluble.
