Acide fort
Définition
Un acide fort a la capacité de s'ioniser complètement en solution aqueuse, approchant généralement les 100 % de dissociation. Les constantes de dissociation acide (Ka, pKa) ne sont pas intéressantes avec les acides forts. Tout acide organique qui ne se dissocie pas intégralement en ion hydronium (H3O+) dans l'eau est un acide faible.
Les acides forts :
Un acide fort se dissocie ou s'ionise complètement lorsqu'il est dissous dans l'eau, ce qui en fait un composé chimique ayant une forte tendance à libérer facilement des protons. Les 7 principaux acides forts sont l'acide chlorhydrique, l'acide nitrique, l'acide sulfurique, l'acide bromhydrique, l'acide iodhydrique, l'acide perchlorique et l'acide chlorique.
Explications
Il existe deux classes d'acides avec les acides forts et les acides faibles. Les acides forts s'ionisent (se décomposent en ions) complètement lorsqu'ils sont dissous dans l'eau. Ainsi, un acide fort est un bon donneur de protons.
Les constantes d'acidité sont à réserver aux acides faibles. Toutefois, pour les acides forts on peut indique : le pKa est négatif, généralement inférieur à -1,74, et le Ka est toujours positif, supérieur à 1.
Par exemple, l'acide chlorhydrique HCl est un acide fort car il cède tous ses protons dans l'eau : HCl + H2O → Cl- + H3O+.
Comme les acides forts s'ionisent complètement, la valeur de [H+] (ou [H3O+]) d'une solution est donc égale à sa molarité. Par exemple, une solution de HCl 0,1 M a une valeur de [H+] de 0,1, tandis qu'une solution de HCl 0,029 M a une valeur de [H+] de 0,029. Ceci s'applique tant que la molarité est supérieure à 10-7 M. Dans les solutions très diluées, où la valeur de [H+] de l'eau pure devient significative, il faut tenir compte de la valeur de [H+] de l'eau.
Force acide
La force d'un acide est définie par sa tendance à céder ou à perdre un proton, tandis que celle d'une base est caractérisée par sa capacité à arracher un proton à d'autres composés.
Les acides peuvent être classés selon trois définitions courantes :
- acide d'Arrhenius : substance qui augmente la concentration en ions hydronium H3O+ en solution.
- acide de Brønsted-Lowry : composé capable de céder un proton.
- acide de Lewis : molécule ou atome qui accepte une paire d'électrons.
La force d'un acide dépend de sa facilité à perdre ou à céder un proton en solution. Les acides forts se dissocient complètement en solution aqueuse, libérant la quasi-totalité de leurs protons.
En solution, les acides forts s'ionisent presque entièrement, ce qui signifie qu'une mole d'un acide fort comme HA produit une mole d'ions H+, une mole de base conjuguée A-, et il ne reste plus d'acide non protoné. En revanche, les acides faibles ne se dissocient que partiellement. À l'équilibre, leurs solutions contiennent à la fois l'acide non dissocié (HA) et sa base conjuguée, ainsi qu'une quantité moindre d'ions H+ libres que dans les acides forts.
Deux facteurs principaux influencent la force d'un acide :
- polarité moléculaire : le degré d'arrachement des électrons du proton au sein de la molécule. Une molécule fortement polaire augmente la charge positive partielle du proton, affaiblissant la liaison H-A et facilitant la dissociation.
- force de la liaison H-A : En fonction de la polarité moléculaire, plus la liaison qui maintient le proton est faible, plus il est facile pour ce dernier de se dissocier en solution.
La force d'un acide est également corrélée à la stabilité de sa base conjuguée : une plus grande stabilité de la base conjuguée indique souvent un acide parent plus fort.
Synonymes, antonymes
Voir tous les synonymes pour "acide fort".0 synonyme (sens proche) pour "acide fort".
3 antonymes (sens contraire) :
- acide faible
- base faible
- base forte
Les mots ou les expressions apparentés à ACIDE FORT sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE FORT est dans la page 1 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide domoïque acide faible acide férulique acide folique acide formique acide fortacide fulvique acide fumarique acide gallique acide gastrique acide glutamique
En rapport avec "acide fort"

L'acide chlorhydrique est une solution aqueuse incolore et fortement acide de chlorure d'hydrogène gazeux (HCl) dans l'eau.

Les acides faibles se dissocient partiellement en solution, libérant un nombre limité d'ions hydronium H₃O⁺.

L'acide nitrique (HNO₃) est un acide minéral, un liquide incolore, fumant et hautement corrosif, qui est un réactif de laboratoire courant et un produit...
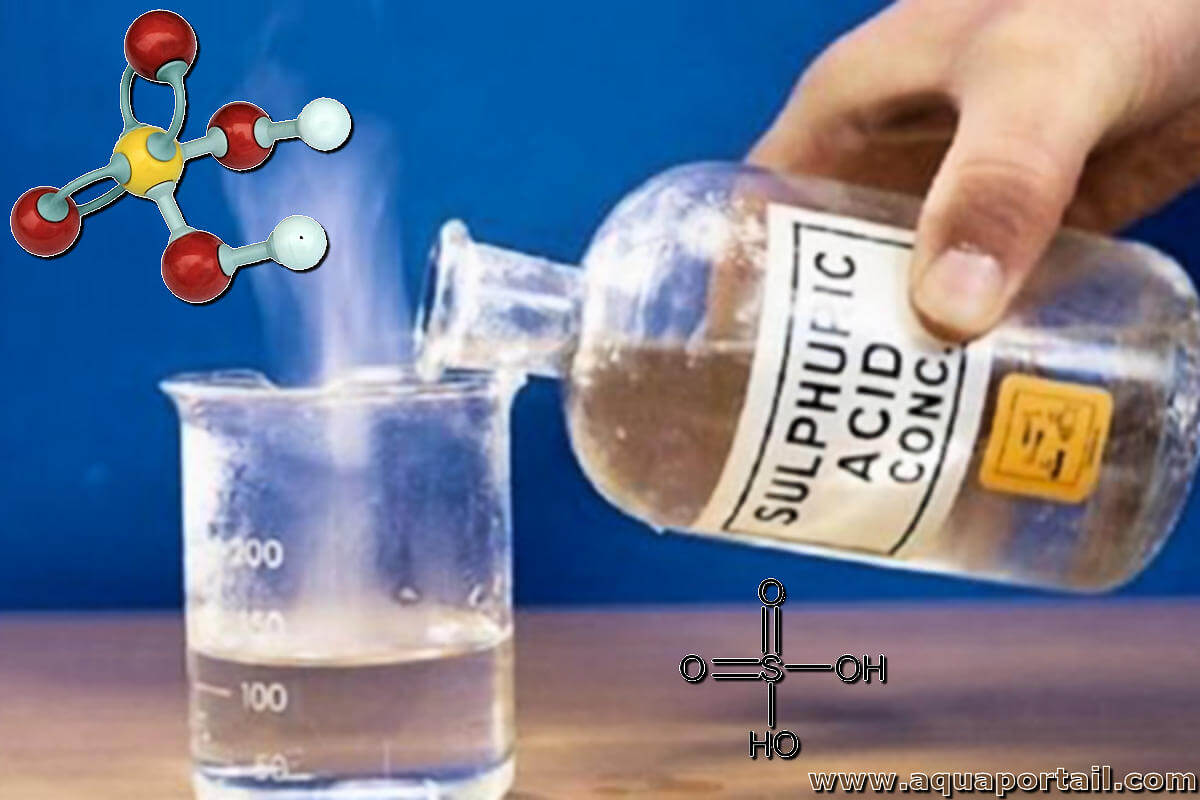
L'acide sulfurique est un composé acide extrêmement corrosif dont la formule est H₂SO₄.
