Acide organique
Définition
Un acide organique est un composé chimique comportant un ou plusieurs groupes fonctionnels ou d'autres éléments structurels qui subissent des réactions d'équilibre lors de la libération de protons avec de l'eau ou d'autres solvants protonables.
Les anions respectifs des acides organiques respectifs sont formés et les protons sont absorbés par le solvant, l'eau, qui joue le rôle d'accepteur de protons (base), formant des ions oxonium H3O+. La concentration en ions oxonium dans la solution est alors supérieure à la concentration en ions hydroxyde, de sorte que la solution devient acide.
Un acide organique avec l'acide acétique :
Le vinaigre balsamique est une forme d'acide organique, issu de l'acide acétique.
Explications
Outre les acides organiques, qui réagissent déjà avec l'eau en tant qu'acides, il existe une variété d'autres composés organiques, mais pas contre l'eau à faible accepteur de protons, mais contre les accepteurs de protons plus forts - tels que l'anion hydrure H- ou l'anion amide NH2- peut réagir comme un acide.
Dans les deux cas, aucun équilibre ne se crée, mais il s'agit de la formation d'hydrogène gazeux ou d'ammoniac qui s'échappe.
Même ces réactions sont des réactions acide-base, mais doivent être effectuées en l'absence d'eau et dans un solvant qui ne peut lui-même émettre de protons (par exemple dans l'éther diéthylique). Sinon, les très forts anions hydrure ou amide nécessaires seraient protonés par l'eau ou le solvant non approprié et seraient ainsi détruits.
Groupement d'acides organiques
Une mesure de l'acidité d'un composé chimique est la constante d'acide ou sa valeur de pKs. La valeur de la constante d'acide indique la force avec laquelle le composé réagit sous forme d'acide dans la réaction à l'équilibre ci-dessus avec de l'eau (protolysée), jusqu'où l'équilibre est déplacé vers le côté droit.
Plus la valeur de pKs est faible, plus l'acidité de l'acide organique est élevée.
Le terme acide organique est souvent assimilé prématurément et simplistiquement à acide carboxylique, c'est-à-dire à des composés qui portent un ou plusieurs groupes carboxy (-COOH).
Cependant, de nombreux composés organiques peuvent réagir comme des acides mais ne contenir aucun groupe carboxy, mais contenir d'autres groupes qui émettent également plus ou moins facilement un proton, il peut réagir aigrement.
Ceux-ci peuvent être des groupes tels que/en tant que groupe hydroxy dans les alcools R-OH, ou le sulfanyl -SH dans (thiols), ou le groupe -SO3H dans les acides organiques (sulfoniques).
La libération d'un proton est d'autant plus facile, d. h. Le composé est un acide plus puissant, mieux l'anion obtenu est stabilisé par mésomérie ou d'autres effets supplémentaires. Le composé acide ascorbique (vitamine C) en est un exemple particulièrement radical.
Il n'y a pas de groupe carboxy dans la structure moléculaire, et pourtant ce composé avec pKs 4,25 est un acide plus fort que l'acide acétique avec pKs 4,75 car l'anion de l'acide ascorbique est stabilisé en raison de la présence de groupes énol et d'effets tautomères possibles.
Il est important de noter que des protons liés à des atomes de carbone ou d'azote peuvent également être libérés si les anions résultants sont stabilisés mésomériquement. De tels composés sont également appelés composés CH-acides ou composés NH-acides. Dans ces composés, en l'absence d'eau comme solvant, la libération complète du proton peut être forcée par l'ajout du réducteur fort, le sodium, qui réduit les protons en hydrogène élémentaire et les prive ainsi d'équilibre. Des synthèses chimiques peuvent ensuite être effectuées avec les anions du composé acide CH ou NH ainsi préparé.
Acides carboxyliques
Les acides carboxyliques avec des valeurs de pKs de 3,8 (acide formique) et supérieures sont des acides significativement plus forts que les alcools avec des valeurs de pKs de 15,9 (éthanol) et plus.
La force d'acide des acides carboxyliques augmente encore davantage si, au voisinage du groupe carboxy (en position α, β ou γ), d'autres groupes attracteurs d'électrons sont présents. Alors que l'acide trifluoroacétique avec pKs 0,23 est déjà sous forme d'acide fort, surtout en comparaison avec l'acide acétique faible non substitué qui a un pKs de 4,75.
Les deux acides sont des acides plus forts que l'acide lactique de l'acide 2-hydroxypropionique avec pKs 3,9, qui n'est lui-même qu'un acide un peu plus fort que l'acide propionique normal avec pKs 4,1.
Alcools, phénols, énols
Les alcools non substitués (pK supérieurs à 16) n'ont que de très faibles acidités, alors que les phénols et les naphtols sont plus acides en raison de la stabilisation par mésomérisation des phénolates obtenus : le phénol est plus acide avec un pK de 9,9 par un facteur de 10 que l'éthanol (avec un pK de 16).
Les substituants sur les systèmes cycliques aromatiques des phénols qui exercent un effet -I ou M peuvent augmenter considérablement les forces acides des phénols et des naphtols en stabilisant la charge négative des anions résultants.
Si plusieurs de ces substituants sont présents, cela peut conduire à des composés fortement acides, tels que. Exemple, dans l'acide picrique (pK 0,3) avec trois groupes nitro (effet -M) sur le noyau aromatique, ou dans le pentachlorophénol (pK 4,7) (effet -I).
Le cas particulier de l'acide endiolascorbique, qui est plus acide avec les pKs de 4,2 que l'acide acétique (pKs 4,8), a déjà été signalé.
Thiols
Les thiols ont une acidité plus élevée que les alcools correspondants; les thiolates obtenus sont plus stables que les alcoolates. Cela est démontré par la comparaison des composés analogues éthanol (pK 16) et éthanethiol (également éthylmercaptan, pK 12).
Esters d'acide sulfurique et acides sulfoniques
Les monoesters d'acide sulfurique et les acides sulfoniques ont une valeur de pKs qui, en raison de sa structure similaire, est comparable à la valeur de pKs de la deuxième étape de dissociation de l'acide sulfurique (valeur de pK 1,9).
L'acide p-toluènesulfonique, par exemple, a un pK de 0,7. Le monoester d'acide sulfurique et d'alcool laurylique, appelé sulfate de lauryle, bien que plus acide que l'acide sulfonique, a un pK de -0,09 et est donc nettement moins acide que le proton du premier stade de dissociation de l'acide sulfurique (pKs - 3).
Esters d'acide phosphorique et acides phosphoniques
Les monoesters et diesters de l'acide phosphorique (ester d'acide phosphorique), ainsi que les dérivés organiques de l'acide phosphonique (communément appelés phosphonates) dépendent du degré de dissociation des acides modérés à faibles.
Modifier les composés acides CH et NH
De plus, les hydrocarbures sans groupe carboxy, hydroxy ou sulfanyle peuvent agir en tant qu'acides en raison de leur acidité CH ou NH. Ici, la présence de liaisons multiples et de groupes fonctionnels adjacents ou d'hétéroatomes est la cause de l'acidité.
Le composé acide chlorhydrique le plus connu est l'éthyne (acétylène), qui a une valeur pK de 25 en raison de la triple liaison (éthane : 50). D'autres exemples sont le nitroéthane (pKs 8,6) et le nitrocyclopentadiène, qui est plus acide (pKs 3,3) que l'acide formique (3,75).
Au cours de la déprotonation, le nitrocyclopentadiène forme un dérivé de l'anion cyclopentadiényle aromatique. Là encore, les effets mésomères et inductifs déterminent l'acidité des composés. L'acétonitrile est un autre exemple d'un simple composé d'acide chlorhydrique.
Les composés NH-acides connus sont le phtalimide (pKs 8,3) et les sulfonylurées (le tolbutamide a un pKs de 5,16).
Synonymes, antonymes
Voir tous les synonymes pour "acide organique".0 synonyme (sens proche) pour "acide organique".
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à ACIDE ORGANIQUE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression ACIDE ORGANIQUE est dans la page 2 des mots en A du lexique du dictionnaire.
Mots en A à proximité
acide N-acétylneuraminique acide nicotinique acide nitrique acide nucléique acide oléique acide organiqueacide orotique acide oxalique acide oxaloacétique acide pantothénique acide para-aminobenzoïque
En rapport avec "acide organique"

Un acide est une substance qui, lorsqu'elle est dissoute dans l'eau, produit une concentration accrue d'ions hydrogène.

L'acide 2,3-diphosphoglycérique, anciennement appelé diphosphoglycérate (DPG), est un métabolite intermédiaire du glucose synthétisé à partir de l'acide...
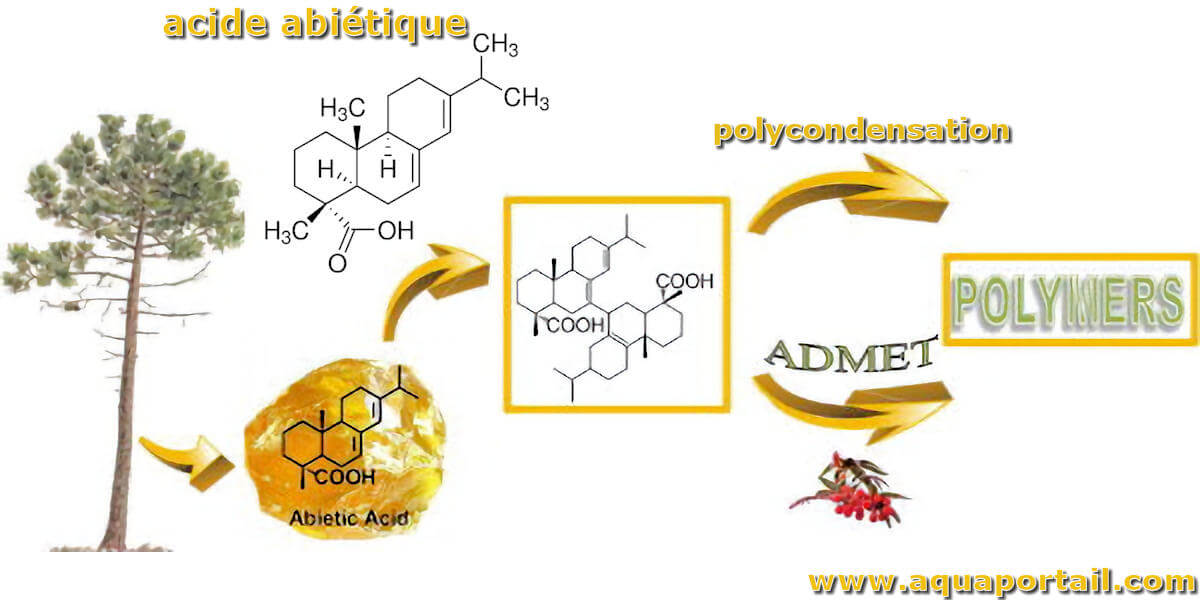
L'acide abiétique est une substance cristalline incolore obtenue à partir de l'oléorésine de quelques Gymnospermes, notamment des pins.
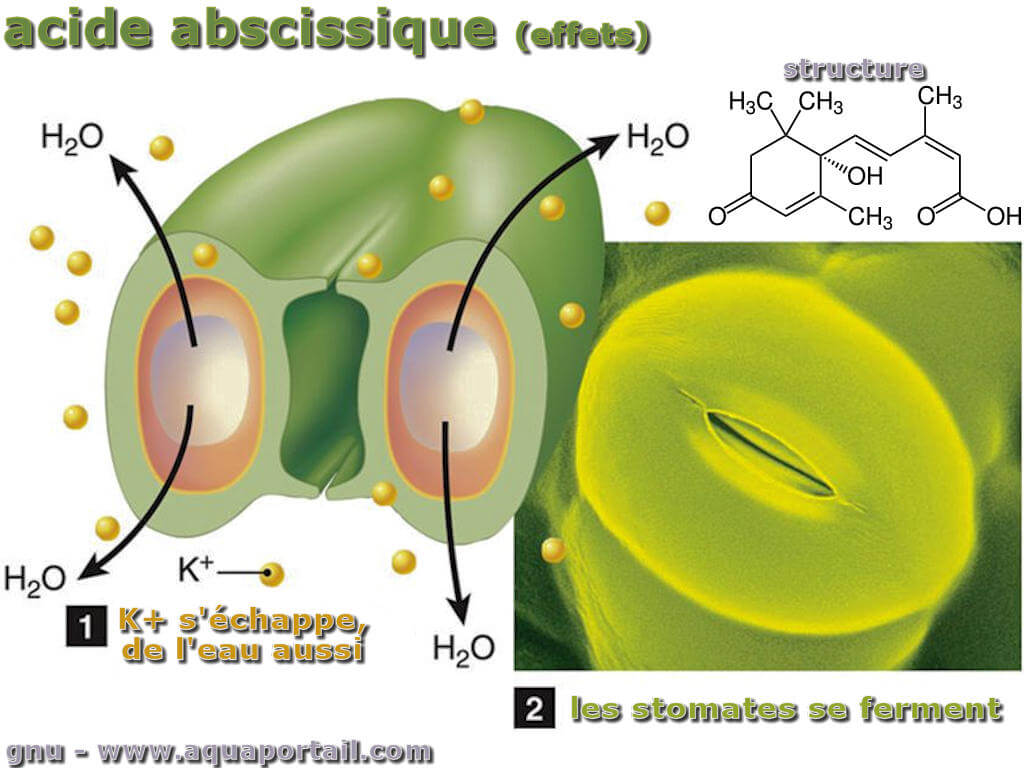
L'acide abscisique est une hormone présente dans les plantes qui joue un rôle essentiel dans la croissance et la régulation de différents processus végétaux.
