Structure moléculaire
Définition
La structure moléculaire définit la disposition spatiale des atomes et des liaisons chimiques entre les atomes dans une molécule. Elle est déterminée par résolution de l'équation de Schrödinger et la construction de structures de Lewis.
Plusieurs modèles de structures moléculaires (et géométrie) :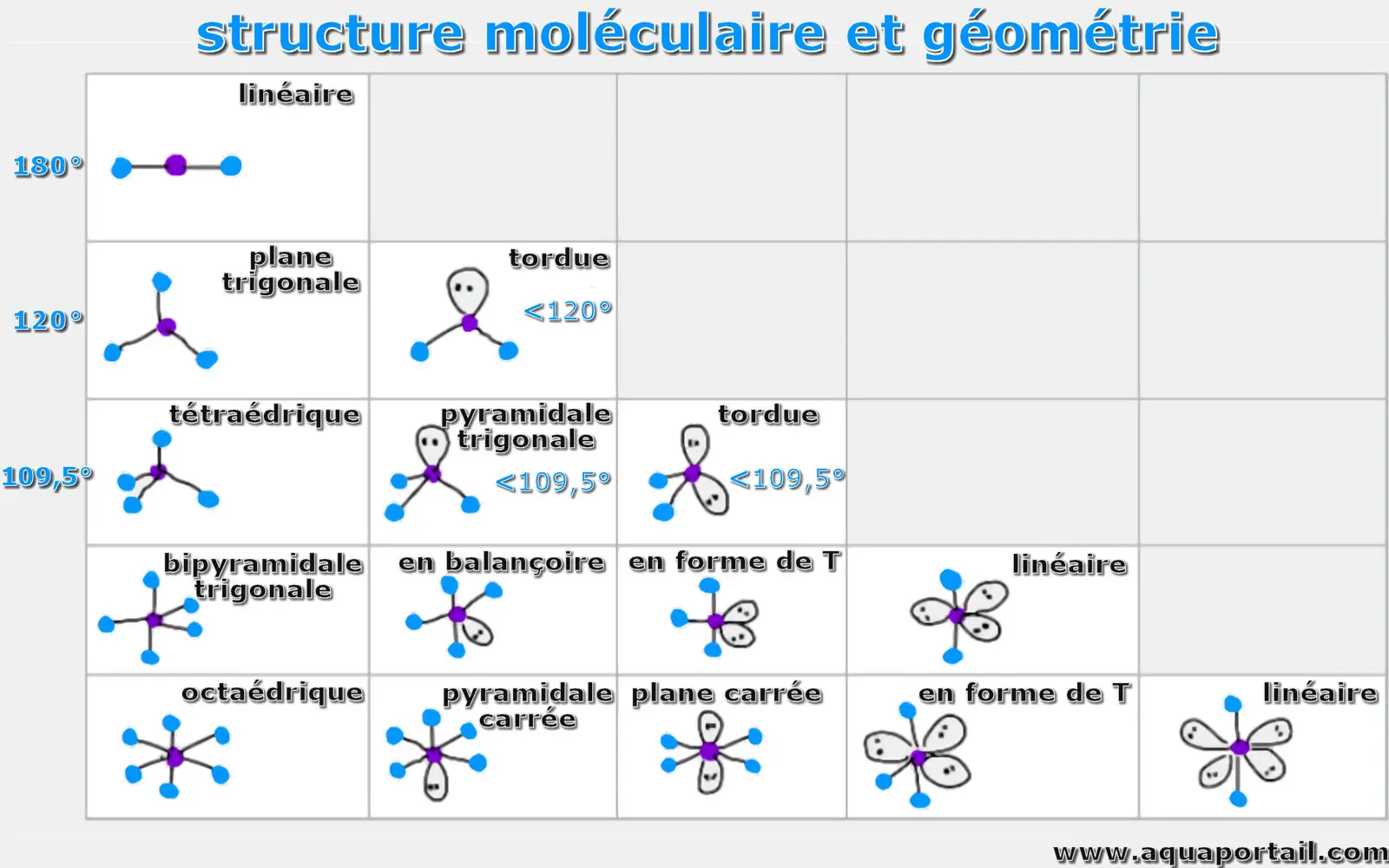
Les structures moléculaires de Lewis permettent de déterminer les propriétés structurelles et de liaison des molécules et des ions avec des liaisons covalentes.
Explications
Une molécule est une structure tridimensionnelle et bon nombre de ses propriétés, tant chimiques que physiques, sont dictées par cette structure. La structure de Lewis d'une molécule est une représentation bidimensionnelle qui peut être utilisée pour obtenir des informations sur sa structure tridimensionnelle.
La structure moléculaire est déterminée en résolvant l'équation de la mécanique quantique pour le mouvement des électrons dans le champ des noyaux (appelée équation de Schrödinger). Dans une structure moléculaire, les longueurs et les angles de liaison sont ceux pour lesquels l'énergie moléculaire est la plus faible.
Régions électroniques
Selon le modèle de répulsion des paires d'électrons dans la couche électronique, les électrons restent aussi éloignés les uns des autres dans une molécule. En plus des paires isolées, les liaisons covalentes sont constituées d'électrons. Les paires d'électrons s'éloigneront les unes des autres afin de réduire la répulsion dans la molécule et de la rendre plus stable. Ces formes sont très différentes de celles des orbitales électroniques en raison de l'hybridation.
Tout comme un plan bidimensionnel fournit des informations sur un bâtiment tridimensionnel, la structure de Lewis d'une molécule fournit des informations sur la structure tridimensionnelle d'une molécule. La transition d'une structure bidimensionnelle à une structure tridimensionnelle s'effectue avec le modèle de répulsion par paire d'électrons à couche de valence. Ce modèle repose sur le principe selon lequel les "groupes d'électrons" ou "régions d'électrons" autour d'un atome adoptent des positions qui minimisent les répulsions entre eux.
Chacun des éléments correspond à un groupe ou une région électronique :
- paire solitaire
- liaison simple
- double liaison
- triple liaison
Les liaisons doubles et triples représentent chacune un seul groupe électronique car les paires d'électrons dans les liaisons sont toutes limitées à la région de l'espace située entre les atomes liés. Ainsi, les paires d'électrons dans une région de liaison ne peuvent pas s'écarter, mais elles peuvent se déplacer comme un seul groupe électronique pour minimiser leurs interactions avec d'autres groupes électroniques. Les atomes obéissant à la règle de l'octet ne peuvent avoir que deux, trois ou quatre groupes électroniques.
Angles de liaison
Les angles entre les groupes électroniques s'appliquent uniquement aux situations dans lesquelles les quatre groupes électroniques sont identiques, ce qui n'est pas si courant. Ainsi, les angles entre les groupes électroniques autour d'un atome qui obéit à la règle de l'octet seront exactement de 180 ° pour deux groupes, mais ils ne seront proches que de 120 ° ou 109,5 ° pour trois ou quatre groupes, à moins que tous les groupes ne soient identiques.
L'écart par rapport aux angles prédits peut être causé par des différences dans la taille des atomes liés, car les gros atomes ont tendance à s'écarter pour éviter de se "cogner", et par des différences entre les interactions des paires libres et des paires de liaison, car les paires libres sont plus diffuses. que les paires isolées, ils sont donc plus grands et les autres régions électroniques ont tendance à s'en éloigner.
Ce qui suit donne les forces relatives des interactions : paire isolée-paire isolée → paire isolée-paire de liaison → paire de liaison-paire de liaison.
L'angle de liaison est l'angle formé par l'intersection de deux liaisons. Elles sont généralement réduites par rapport aux valeurs données par interaction avec des paires libres. En conséquence, les paires de liaisons s'éloignent des paires isolées en se rapprochant les unes des autres. L'écart par rapport aux angles prédits augmente avec le nombre de couples isolés.
Quand l'angle de liaison s'écarte de la valeur prédite, il est précisé avec un "~" devant l'angle. Ainsi, tous les angles de liaison autour des atomes comportant des paires isolées sont précédés d'un "~".
Formes moléculaires
Les formes présentées dans l'image au-dessus montrent les orientations qui peuvent être adoptées par les groupes électroniques entourant un atome central qui obéit à la règle de l'octet. Cependant, il est possible de déterminer les positions des atomes uniquement, pas des paires isolées, donc une forme moléculaire décrit la forme adoptée uniquement par les atomes et non par les groupes électroniques. Les paires isolées aident à établir quelle est cette forme, mais le nom de la forme s'applique uniquement à celle prise par les atomes.
Les principales formes moléculaires sont :
- linéaire : une simple molécule triatomique; les deux orbitales de liaison sont espacées de 180 °.
- plane trigonale : triangulaire et dans un seul plan, avec des angles de liaison de 120 °.
- tétraédrique : quatre liaisons sur un atome central avec des angles de liaison de 109,5 °.
- bipyramidale trigonale : cinq atomes autour de l'atome central; trois dans un plan avec des angles de liaison de 120 ° et deux aux extrémités opposées de la molécule.
- octaédrique : six atomes autour de l'atome central, tous avec des angles de liaison de 90 °.
Faire des dessins qui démontrent la géométrie autour des atomes avec seulement deux ou trois régions électroniques est facile car ils ne nécessitent qu'une et deux dimensions. Cependant, dans les cas où l'atome central possède quatre régions électroniques ou plus, vous devez être capable de représenter les trois dimensions dans un dessin 2D. Cela se fait souvent en utilisant des lignes pour représenter les régions dans le plan du papier, des coins pleins pour les régions qui s'étendent à partir du plan du papier et des coins en pointillés pour les régions qui s'étendent derrière le plan du papier.
Il existe deux autres représentations qui donnent une meilleure vue tridimensionnelle des molécules, notamment les plus grosses. Ce sont les modèles boule-et-bâton et remplissant l'espace.
Synonymes, antonymes
Voir tous les synonymes pour "structure moléculaire".3 synonymes (sens proche) de "structure moléculaire" :
- géométrie moléculaire
- structure chimique
- structure de Lewis
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à STRUCTURE MOLÉCULAIRE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression STRUCTURE MOLECULAIRE est dans la page 5 des mots en S du lexique du dictionnaire.
Mots en S à proximité
structure en canaux structure en piliers structure étoiléestructure fluidale structure grillagée structure moléculairestructures analogues structures homologues structures secondaires stupidocratiestygobiotique
En rapport avec "structure moléculaire"

Une espèce chimique est toute structure de nature chimique, quel que soit le nombre d'entités moléculaires identiques qui la composent.

La formule moléculaire est une représentation concise et détaillée de la composition atomique d'une molécule en indiquant les types et le nombre d'atomes...
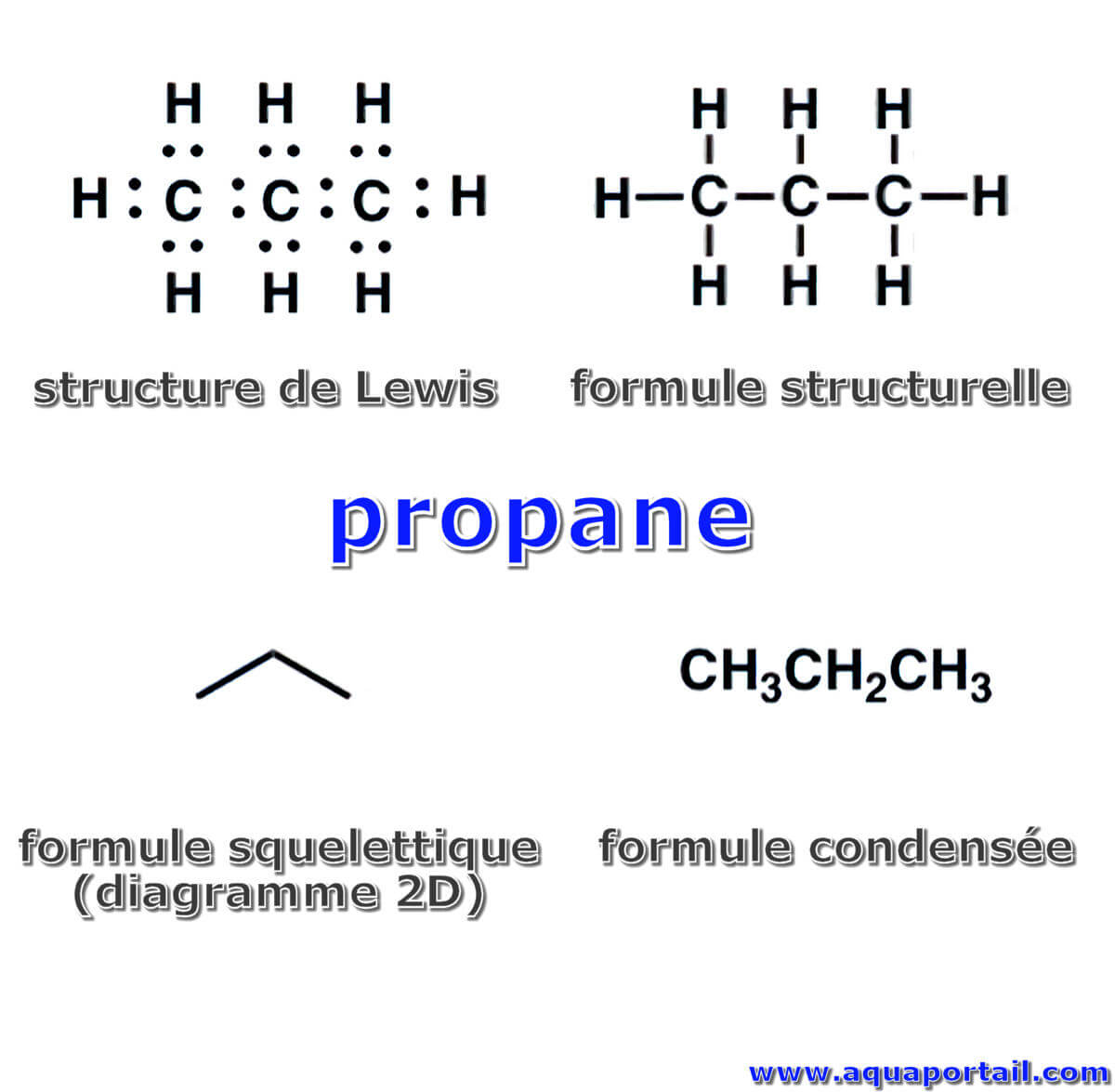
Une formule structurelle (ou structurale) est un type de formule chimique, une formule moléculaire développée montrant l'arrangement dans la molécule...

Une structure chimique d'une molécule comprend la disposition des atomes et les liaisons chimiques qui maintiennent les atomes ensemble.
