Formule structurelle
Définition
Une formule structurelle (ou structurale) est un type de formule chimique, une formule moléculaire développée montrant l'arrangement dans la molécule des atomes et des liaisons. Les atomes sont représentés par des symboles et la structure est indiquée en montrant les positions relatives des atomes dans l'espace et les liaisons entre eux.
Plusieurs formules du propane :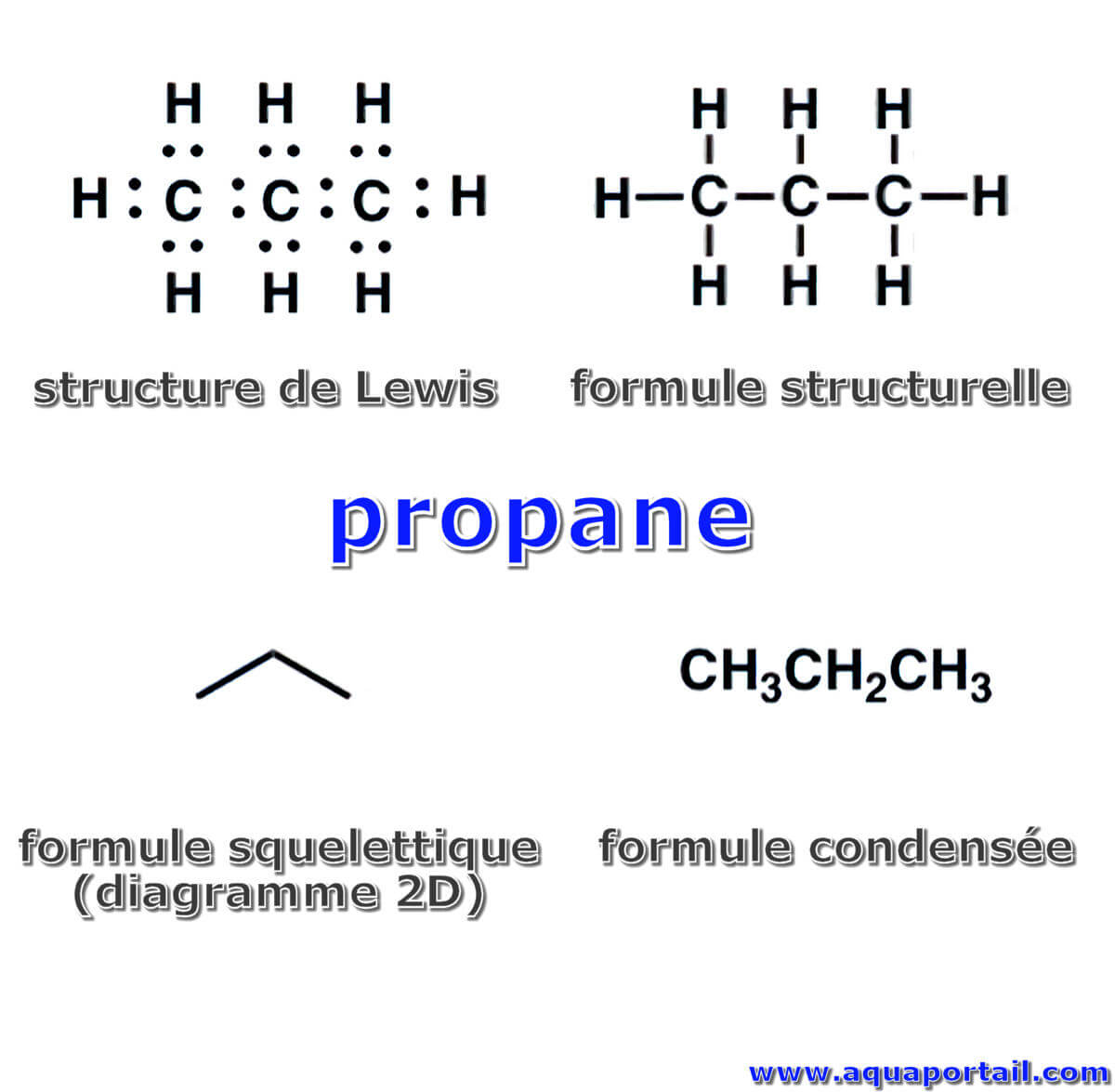
Si le plus haut niveau de détail est la structure de Lewis qui montre où se trouvent tous les électrons avec des points, le deuxième niveau de détail le plus élevé est la formule structurelle, qui remplace ces points par des lignes (structure 2D). Le formule condensée, même si elle n'offre plus les liaisons, est plus précise que la formule moléculaire ou formule brute.
Explications
Dans la description classique, une molécule organique est représentée par une formule structurelle. Il s'agit d'une collection de symboles atomiques (C, H, O, N, etc.) représentant des atomes (y compris leurs électrons de la couche interne mais à l'exclusion de leurs électrons de la couche de valence; les électrons d d'un atome de métal de transition sont inclus, bien qu'ils puissent participer au rapprochement). Au moins un, mais généralement plusieurs de ces atomes doivent être du carbone pour que la molécule soit qualifiée d'organique.
Les symboles atomiques sont reliés par un réseau de lignes simples, doubles et triples, qui représentent respectivement des liaisons covalentes simples, doubles et triples. Ceux-ci sont formés par le partage de paires d'électrons entre les atomes, une liaison représentant une paire. Le nombre de voisins les plus proches auxquels un atome est attaché est appelé son numéro de coordination.
De plus, des lignes courtes ou des paires de points peuvent être utilisées pour représenter des paires d'électrons non partagées (seules) sur un atome, mais elles sont fréquemment omises. Les points simples représentent des électrons impairs (non appariés) s'ils sont présents.
Les symboles C et H pour l'atome de carbone et les hydrogènes qui lui sont attachés, respectivement, sont également fréquemment omis. Les groupes d'atomes courants de structure interne bien connue sont souvent indiqués en indiquant le type et le nombre d'atomes impliqués (par exemple, C2H5 pour l'éthyle) ou par une abréviation (dans ce cas, Et).
Le nombre de liaisons formées par un atome (sa "covalence") est dicté par les règles de valence. Celles-ci stipulent que pour qu'une molécule organique ait une stabilité raisonnable dans des conditions ordinaires plutôt que d'apparaître uniquement comme un intermédiaire de réaction transitoire, voire pas du tout, les couches de valence de tous les atomes de la structure doivent contenir un certain nombre d'électrons : 2 pour l'hydrogène, 8 pour les autres éléments du groupe principal et 18 pour les éléments de métaux de transition. Le groupe de 8 électrons dans la couche de valence d'un atome est souvent appelé octet de valence.
Afin de déterminer le nombre d'électrons dans la couche de valence d'un atome, on compte tous les électrons non appariés ou électrons présents en paires isolées sur cet atome, plus deux électrons pour chaque liaison simple à laquelle l'atome participe (quatre pour une liaison double liaison, six pour une triple liaison).
Chaque type de liaison est associé à une contribution à l'énergie totale de la molécule, et ces contributions sont approximativement additives.
En plus des symboles atomiques et des symboles pour les liaisons, les paires isolées et les électrons non appariés, les formules structurelles classiques de la chimie organique indiquent également les charges atomiques.
L'intention principale de la vision structurelle de l'obligation est de conserver les informations explicatives fournies par les formules structurelles classiques. Lewis et Pauling travaillent dans ce sens, mais le rôle théorique des liaisons dans les formules structurales est antérieur à la découverte de l'électron et à l'avènement de la mécanique quantique. En outre, le point de vue doit être compatible avec les découvertes postérieures à Lewis et Pauling. Par conséquent, il ne doit pas incorporer trop étroitement les conceptions particulières de la base matérielle de la liaison proposées soit par Lewis (paires d'électrons partagés discrets) soit par Pauling (hybridation et résonance). Une façon de répondre à ces contraintes est que la vision structurelle identifie une fonction théorique pour les liaisons - continue avec celle des formules classiques - mais laisse à l'investigation empirique et théorique le soin d'identifier leurs réalisateurs physiques dans les états de la mécanique quantique des molécules. Par conséquent, du point de vue structurel, les liaisons chimiques sont, au moins pour les substances moléculaires, des parties matérielles de la molécule qui sont responsables des relations submoléculaires spatialement localisées entre les centres atomiques individuels.
L'atome d'hydrogène ne souffre pas de contraintes stériques dans son état univalent ordinaire, dans lequel il ne fait qu'une seule liaison. Il peut entrer dans un type spécial d'interaction hypervalente faible connue sous le nom de liaison hydrogène, qui l'attache à un deuxième atome porteur d'une paire isolée. La liaison hydrogène est indiquée par une ligne pointillée. Comme d'habitude pour les interactions hypervalentes, la liaison hydrogène est particulièrement importante si les voisins de l'atome d'hydrogène sont hautement électronégatifs.
Synonymes, antonymes
Voir tous les synonymes pour "formule structurelle".5 synonymes (sens proche) de "formule structurelle" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à FORMULE STRUCTURELLE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression FORMULE STRUCTURELLE est dans la page 3 des mots en F du lexique du dictionnaire.
Mots en F à proximité
formule développée formule empirique formule florale formule ionique formule moléculaire formule structurelleformyle fossé fosse Calypso fosse iliaque fosse océanique
En rapport avec "formule structurelle"

La formule brute d'un composé chimique est sa formule chimique ou formule ionique, exactement la même que la formule moléculaire non-développée.
Une formule chimique décrit la composition atomique des composés en donnant des informations sur le rapport numérique des atomes présents.

Une formule développée est un type de formule chimique, comme la formule structurelle, qui identifie l'emplacement des liaisons chimiques entre les atomes...

La formule empirique est la plus simple des types de formule chimique. Elle donne le plus petit rapport de nombre entier d'éléments dans un composé, tandis...
