Thiolate
Définition
Un thiolate est la base conjuguée d'un thiol. L'anion thiolate contient un atome de soufre avec trois paires isolées et une charge négative. Les thiolates sont des ligands puissants. Par exemple, une riche chimie de coordination avec le cobalt (III) existe.
L'ion thiolate :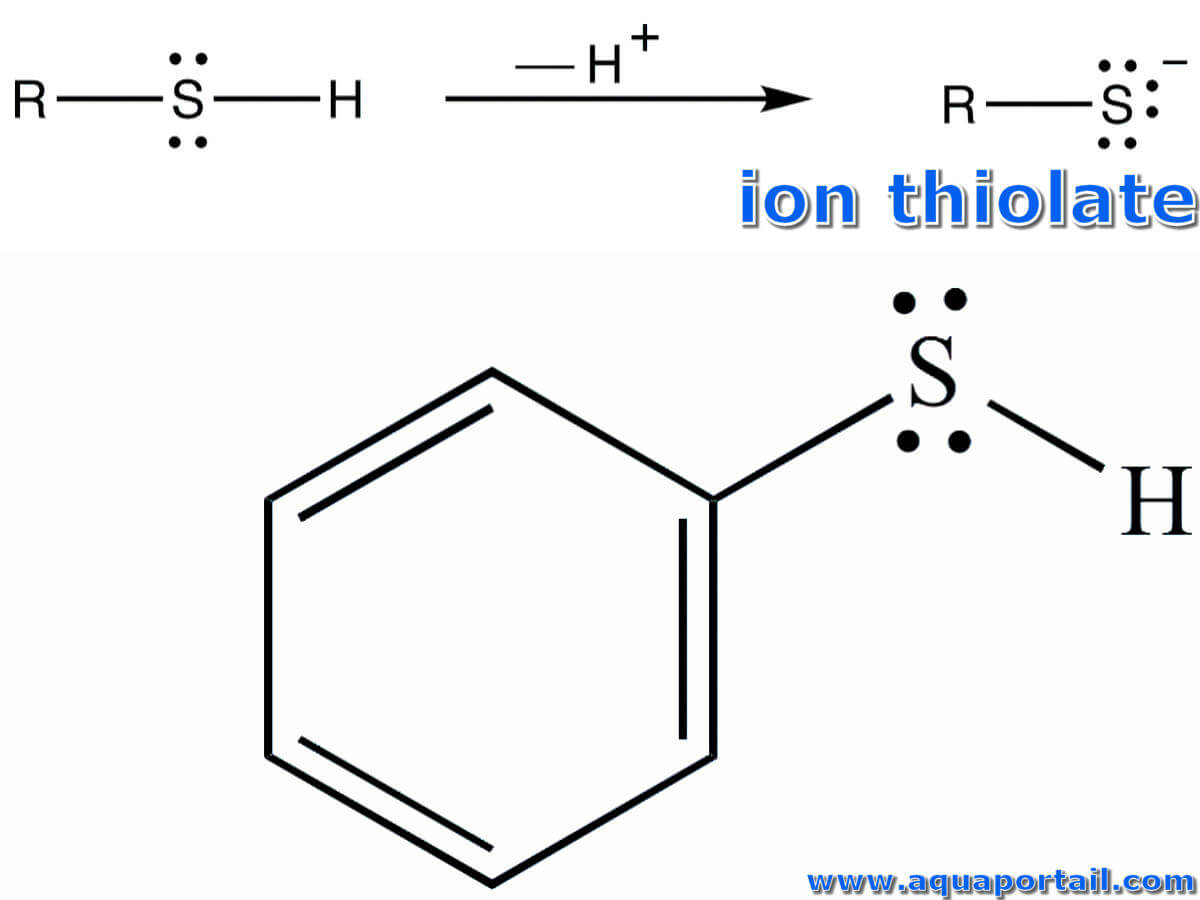
L'ion thiolate est la base conjuguée des thiols.
Explications
En chimie, les thiolates sont des sels de cations métalliques et d'anions thiolate, c'est-à-dire des anions avec du soufre lié à des résidus organiques. La formule générale est (RS)nMe (R = radical, S = soufre, Me = ion métallique; n correspond à la valence de cet ion métallique). Les ions thiolates sont formés par déprotonation des thiols (thioalcools → thioalcoolates, mercaptans → mercaptides).
Les thiolates trouvent une application dans la synthèse des thioéthers (sulfures, RSR). Ici (de manière analogue à la synthèse d'éther de Williamson), un haloalcane est mis à réagir avec un thiolate dans une substitution avec un nucléophile (substitution nucléophile).
Par exemple, le thiophénolate est la base conjuguée du thiophénol. La déprotonation du thiophénol avec un NaOH (une base forte) donne le thiophénolate (un thiolate), la base conjuguée du thiophénol.
Caractéristiques
Dans leur forme pure, les thiolates sont des solides hygroscopiques fortement basiques, c'est-à-dire qu'ils attirent l'humidité (l'eau) de l'air et déliquescent progressivement. Ils sont plus résistants à l'eau que les alcoolates. Les thiolates de plomb (II) et de mercure (II) sont peu solubles et, comme les autres captides de métaux lourds, sont des composés covalents.
Synthèse
Les thiolates peuvent être synthétisés en faisant réagir des métaux alcalins élémentaires avec des thioalcools (thiols). D'autres bases, telles que l'amidure de sodium, peuvent également être utilisées. Les thiolates peuvent même être produits en milieu aqueux, car l'ion hydroxyde est suffisamment basique pour déprotoner le groupe thiol, faisant ainsi réagir des hydroxydes alcalins avec des thioalcools. Par exemple, le thiophénolate de sodium est formé par l'action de la soude caustique sur le thiophénol.
Les imidazoles avec un groupe nitro dans le cycle sont facilement sujets à un déplacement d'halogénure par des anions thiolate, les composés 5-halogéno-4-nitro étant trois à dix fois plus réactifs que les 4-halogéno-5-nitroimidazoles.
Les dithiocarbonates de O,S-dialkyle peuvent être préparés par le déplacement du chlorure des chlorures d'alcoxy-thiocarbonyle par des anions thiolate. Par exemple, le dithiocarbonate de S-éthyl-O-méthyle a été obtenu en ajoutant de l'éthanethiolate de sodium à une solution de chlorure de méthoxythiocarbonyle dans de l'éther à une vitesse permettant de maintenir un léger reflux.
Synthèse de sulfures
Les sulfures peuvent être préparés par un procédé analogue à la synthèse de l'éther de Williamson. Le nucléophile est un anion thiolate plutôt qu'un alcoolate. Les ions thiolate, RS-, sont de meilleurs nucléophiles que les alcoxydes car le soufre est plus polarisable que l'oxygène. Ainsi, les ions thiolate déplacent les ions halogénure des halogénures d'alkyle par une réaction SN2 pour donner de bons rendements en sulfures.
Il existe deux différences importantes entre les réactions qui forment des éthers et celles qui forment des sulfures :
- Comme les thiolates sont de meilleurs nucléophiles et des bases plus faibles que les alcoxydes, les réactions d'élimination ne concurrencent pas beaucoup les réactions de substitution. Même les halogénures d'alkyle secondaires peuvent être utilisés pour former des sulfures.
- Parce que les thiols sont plus acides (pKa = 8) que les alcools (pKa = 16), ils sont transformés quantitativement en thiolates par l'hydroxyde de sodium.
Par conséquent, il n'est pas nécessaire de préparer le thiolate dans une réaction séparée avec une base forte, comme cela est requis dans la réaction des alcools avec l'hydrure de sodium. Les sulfures sont généralement préparés en ajoutant l'halogénure d'alkyle à une solution alcoolique basique du thiol.
Synonymes, antonymes
Voir tous les synonymes pour "thiolate".2 synonymes (sens proche) de "thiolate" :
- mercaptide
- thioalcoolate
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à THIOLATE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot THIOLATE est dans la page 2 des mots en T du lexique du dictionnaire.
Mots en T à proximité
thigmotropogenèse Thiobacillus thioester thiol thiolase thiolatethiophène thiorédoxine thiosulfate d'ammonium thixotrope thixotropie
En rapport avec "thiolate"
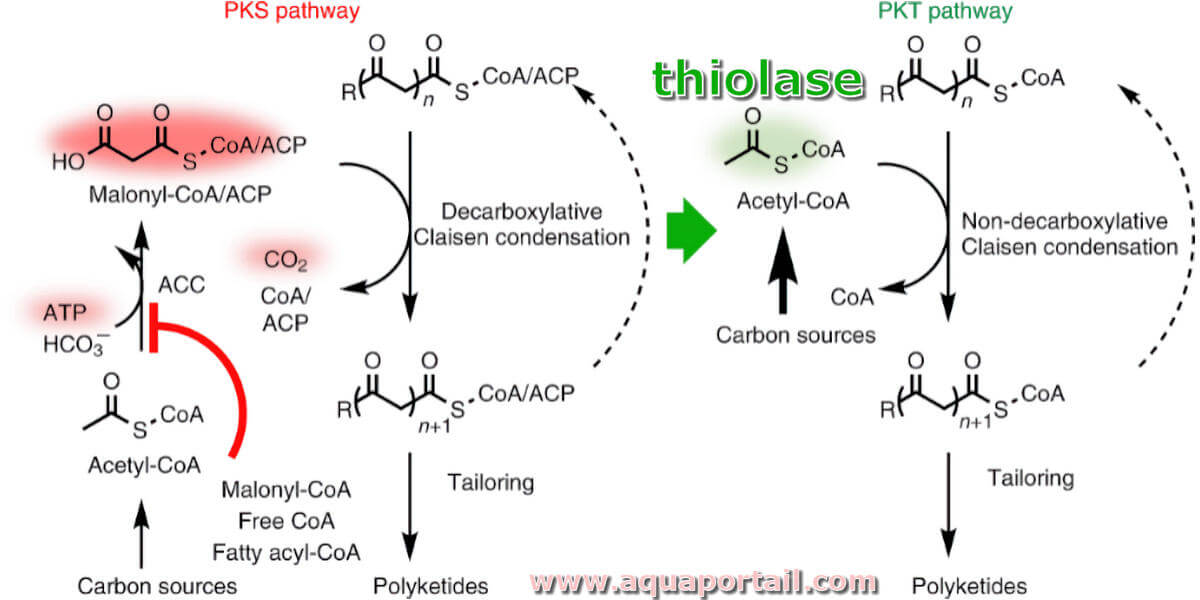
La thiolase est une enzyme qui catalyse la scission d'un composé par un thiol. Le clivage thiolytique du thioester est catalysé par la bêta-cétoacyl...
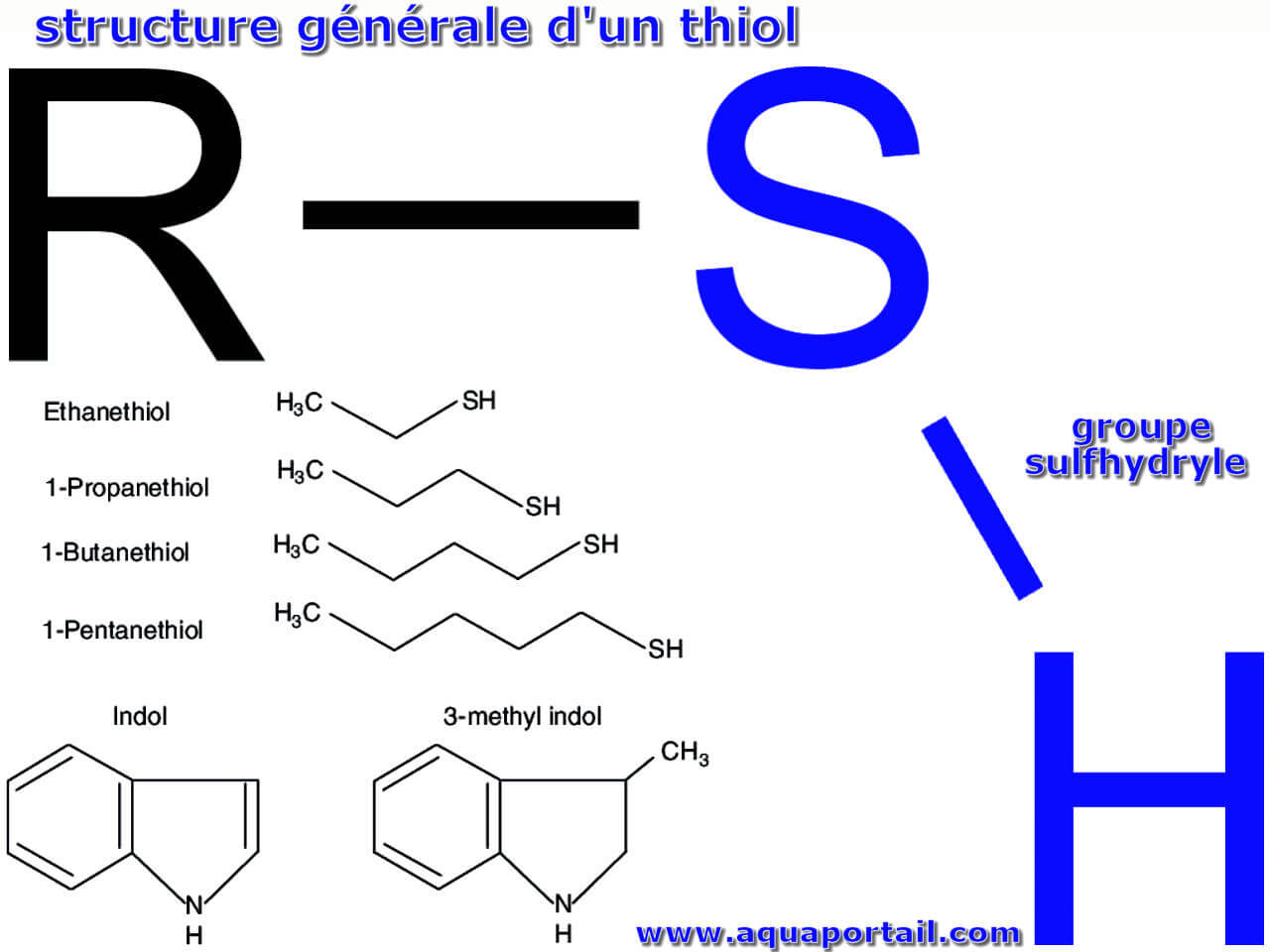
Un thiol est un composé chimique organique similaire à un alcool et à un phénol (organooxygénés) mais un atome de soufre (organosulfuré, R–SH) remplace...
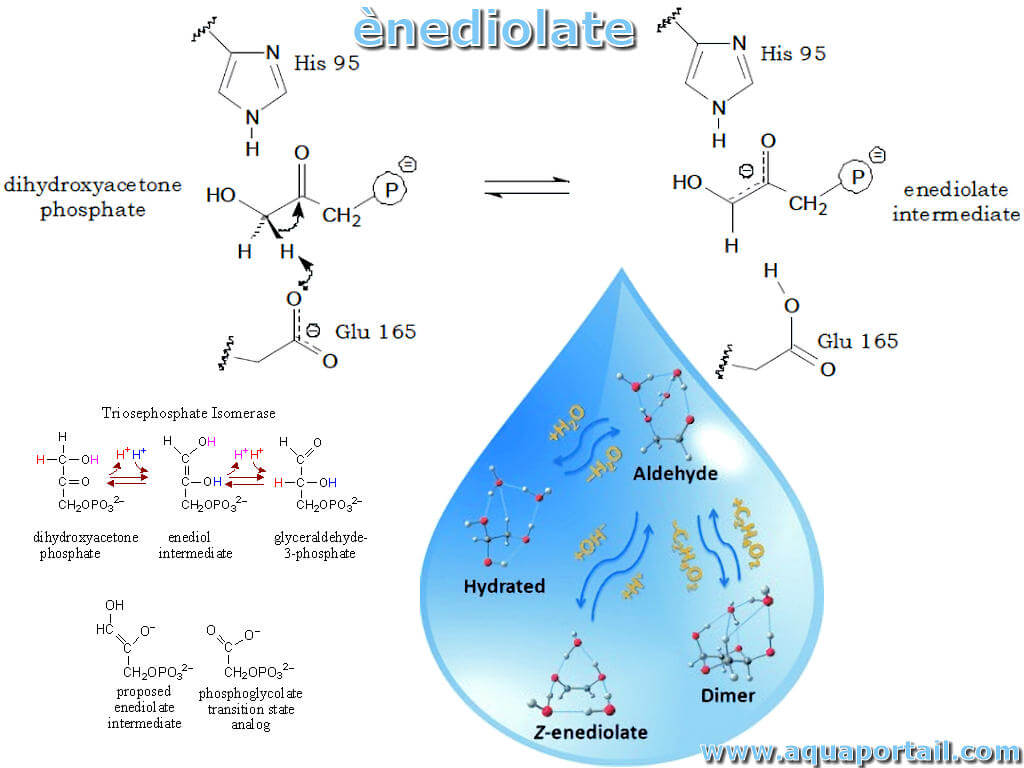
Un ènediolate est tout composé dans lequel un métal remplace un atome d'hydrogène hydroxy d'un énediol.
Les glucosinolates (GLS) sont un grand groupe de composés contenant du soufre et de l'azote avec une structure commune qui comprend un groupe β-d-thioglucose...
