Concentration
Définition
La concentration (géographique) est le regroupement de nombreux éléments au centre d'un même lieu.
La concentration (mentale) est l'action de focaliser son attention intellectuelle sur une chose ou une tâche.
La concentration (chimique) est la quantité relative d'une substance donnée contenue dans un volume particulier.
Des concentrations croissantes :
La concentration massique - comme la concentration molaire, la molalité, la fraction massique - est une quantité permettant de mesurer la concentration d'un soluté dans la solution. C'est le rapport de la masse d'un soluté présent dans la solution au volume de la solution. Il nous indique combien de soluté est présent dans un volume donné de la solution.
Explications
La concentration chimique est l'action de renforcer une solution par l'élimination de l'eau ou d'un autre agent diluant, ou par l'accumulation sélective d'atomes ou de molécules. Une concentration élevée d'une substance dans une solution signifie qu'elle est importante par rapport au volume. Dans un liquide, la concentration est la quantité de soluté par unité de volume de solution. Voir aussi la concentration molaire.
La concentration intellectuelle est la capacité mentale de réfléchir attentivement à ce que l'on fait et à rien d'autre. Dire que vous avez de bonnes capacités de concentration signifie que vous êtes attentif.
La concentration géographique est un rassemblement compact en un même "centre" d'individus, le regroupement serré d'objets, l'agglomération d'idées ou l'agrégation de castes en même lieu (la concentration du pouvoir).
lire plus de détails pour la concentration chimique...
Synonymes, antonymes
Voir tous les synonymes pour "concentration".6 synonymes (sens proche) de "concentration" :
- agglomération
- agrégation
- amas
- Voir la suite...
3 antonymes (sens contraire) :
- dilution
- distraction
- inattention
Les mots ou les expressions apparentés à CONCENTRATION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CONCENTRATION est dans la page 6 des mots en C du lexique du dictionnaire.
Mots en C à proximité
compressibilité comptage de cellules compte-gouttes concaulescence concave concentrationconcentration de fondconcentration molaire conceptacle conchospore conchylicole
En rapport avec "concentration"

En écologie, l'agrégation est un regroupement dense d'organismes de la même espèce ou d'espèces différentes vivant étroitement ensemble mais moins intégrés...

La concentration molaire (M ou c) d'une espèce chimique, ou molarité, est la quantité de moles d'un soluté par litre de solution.
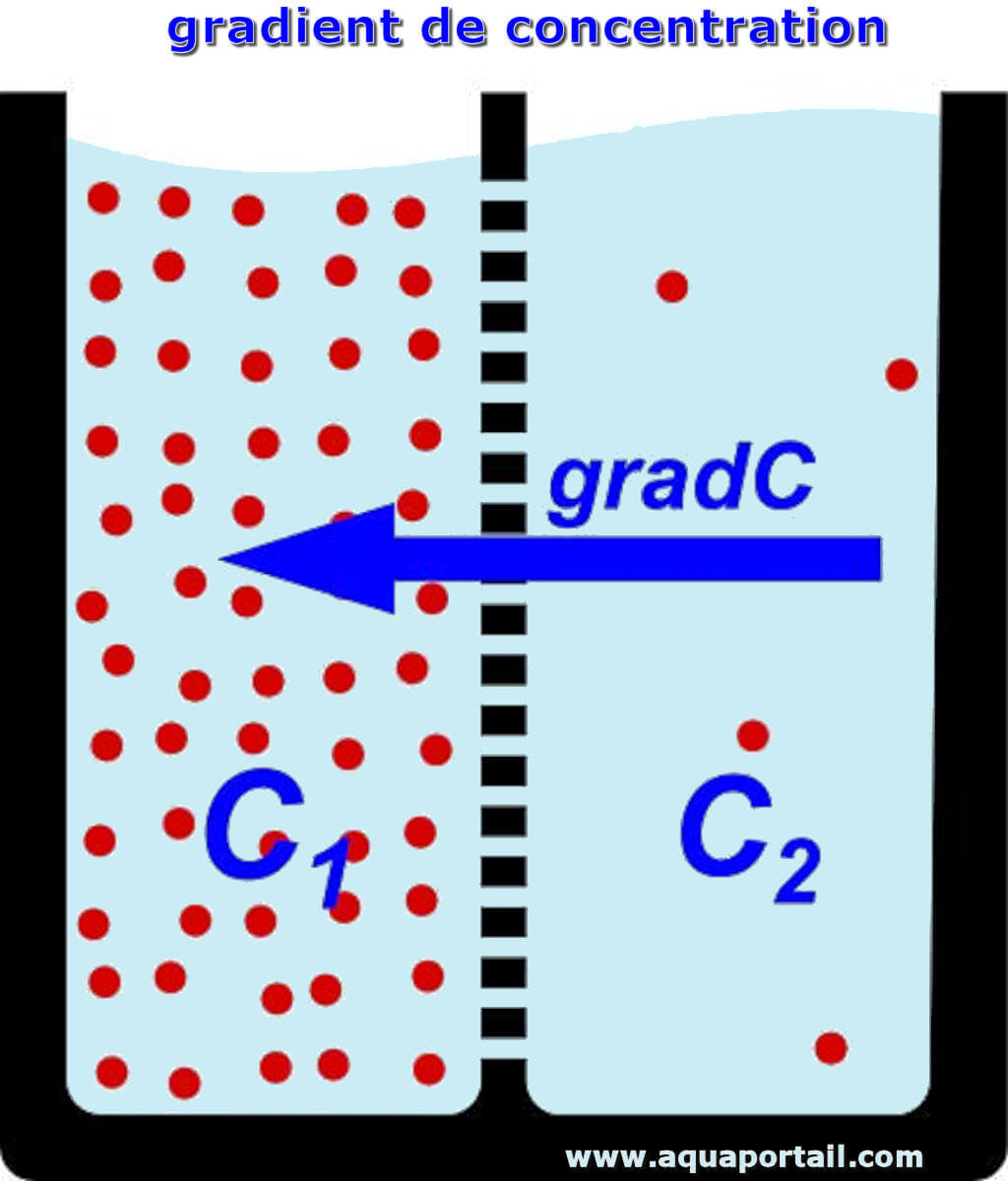
En chimie, le gradient de concentration est le changement progressif de la concentration de solutés dans une solution en fonction de la distance à travers...

L'osmolarité est la pression osmotique générée par les solutés présents dans 1 litre de solution.
