Théorie de Brønsted-Lowry
Définition
La théorie de Brønsted-Lowry est la théorie des protons des acides et des bases qui stipule qu'un acide donne un proton (ion hydrogène, H+), tandis qu'une base accepte un proton. La réaction forme la base conjuguée de l'acide et l'acide conjugué de la base.
Schéma de la théorie de de Brønsted-Lowry :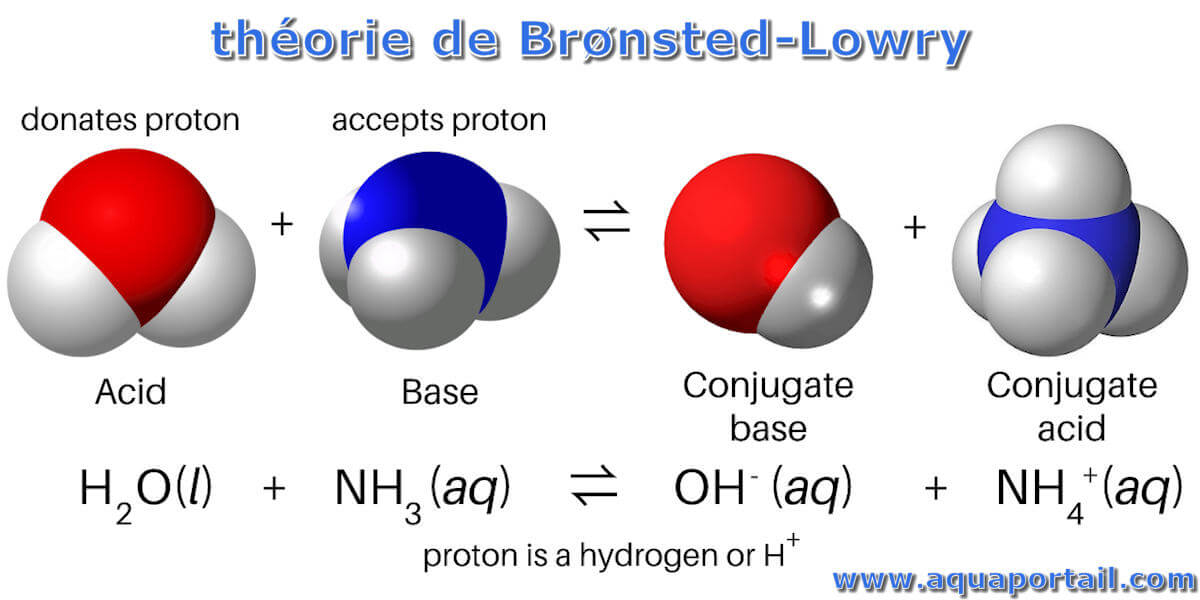
La détermination d'une substance en tant qu'acide ou base de Brønsted-Lowery ne peut se faire qu'en observant la réaction. Dans le cas du HOH il s'agit d'une base dans le premier cas et d'un acide dans le second cas. Notez que l'acide d'origine se transforme en base conjuguée une fois la réaction terminée.
Explications
En 1923, les chimistes Johannes Nicolaus Brønsted et Thomas Martin Lowry ont développé indépendamment des définitions des acides et des bases basées sur la capacité des composés à donner ou à accepter des protons (ion hydronium H+). Elle est une généralisation de la théorie d'Arrhenius des acides et des bases.
Dans cette théorie, les acides sont définis comme des donneurs de protons, tandis que les bases sont définies comme des accepteurs de protons. Un composé qui agit à la fois comme acide et base de Brønsted-Lowry est appelé amphotère.
Pour déterminer si une substance est un acide ou une base, comptez les hydrogènes sur chaque substance avant et après la réaction. Si le nombre d'hydrogènes a diminué, cette substance est l'acide (donne des ions hydrogène). Si le nombre d'hydrogènes a augmenté, cette substance est la base (accepte les ions hydrogène). Ces définitions sont normalement appliquées aux réactifs de gauche.
Si la réaction est vue à l'envers, un nouvel acide et une nouvelle base peuvent être identifiés. Les substances du côté droit de l'équation sont appelées acide conjugué et base conjuguée par rapport à celles de gauche.
Théorie des acides et bases
La théorie de Brønsted-Lowry des acides et des bases a poussé la définition d'Arrhenius un peu plus loin, car une substance n'avait plus besoin d'être composée d'ions hydrogène (H+) ou hydroxyde (OH-) pour être classée comme acide ou base. Par exemple, considérons l'équation chimique suivante : HCl(aq) + NH3(aq) → NH4+(aq) + Cl-(aq).
L'acide chlorhydrique (HCl) "donne" un proton (H+) à l'ammoniac (NH3) qui "l'accepte", formant un ion ammonium chargé positivement (NH4+) et un ion chlorure chargé négativement (Cl-). Par conséquent, HCl est un acide de Brønsted-Lowry (donne un proton) tandis que l'ammoniac est une base de Brønsted-Lowry (accepte un proton).
Aussi, Cl- est appelé la base conjuguée de l'acide HCl et NH4+ est appelé l'acide conjugué de la base NH3 :
- un acide de Brønsted-Lowry est un donneur de proton (ion hydrogène).
- une base de Brønsted-Lowry est un accepteur de proton (ion hydrogène).
Dans cette théorie, un acide est une substance qui peut libérer un proton (comme dans la théorie d'Arrhenius) et une base est une substance qui peut accepter un proton. Un sel basique, tel que Na+ F-, génère des ions OH- dans l'eau en prenant des protons de l'eau elle-même (pour fabriquer du HF).
Lorsqu'un acide de Brønsted se dissocie, il augmente la concentration d'ions hydrogène dans la solution, H+; à l'inverse, les bases de Brønsted se dissocient en prélevant un proton du solvant (l'eau) pour générer OH-.
Synonymes, antonymes
Voir tous les synonymes pour "théorie de Brønsted-Lowry".1 synonyme (sens proche) de "théorie de Brønsted-Lowry" :
- théorie des protons
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à THÉORIE DE BRØNSTED-LOWRY sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression THEORIE DE BRONSTED-LOWRY est dans la page 2 des mots en T du lexique du dictionnaire.
Mots en T à proximité
théodolite théophylline théorème de Pythagore théorie acide-base théorie cellulaire théorie de Brønsted-Lowrythéorie de Darwin théorie de l'endosymbiose théorie de l'évolution théorie de la récapitulation théorie des causes finales
En rapport avec "théorie de Brønsted-Lowry"

Un proton est une particule subatomique avec une charge électrique élémentaire positive, égale en valeur absolue et en signe opposé à celle de l'électron.

La théorie des collisions établit que les réactions chimiques surviennent lorsque des molécules réactives entrent en collision avec une énergie suffisante...

Un acide est une substance qui, lorsqu'elle est dissoute dans l'eau, produit une concentration accrue d'ions hydrogène.
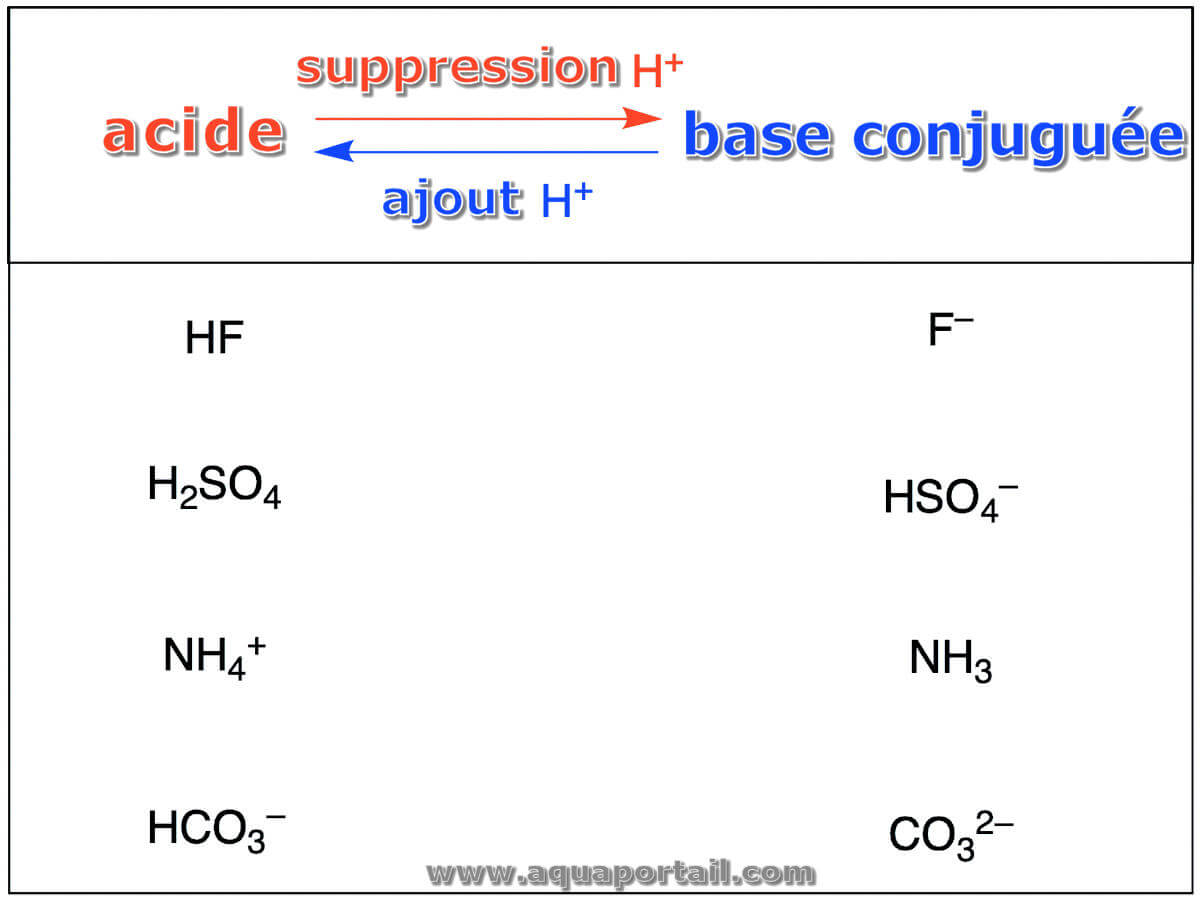
Une base conjuguée est une base, X⁻, issue d'une paire de composés qui se transforment l'un en l'autre en gagnant ou en perdant un proton.
