Cystéine
Définition
La cystéine (Cys ou C) est un acide alpha-aminé soufré constitutif des protéines, de formule chimique HS-CH2-CH(NH2)-COOH, portant un groupement thiol (-SH). Ce dernier permet la formation de ponts disulfure entre deux chaînes polypeptidiques. Les codons qui codent pour la cystéine sont UGU et UGC.
Structure moléculaire de la cystéine :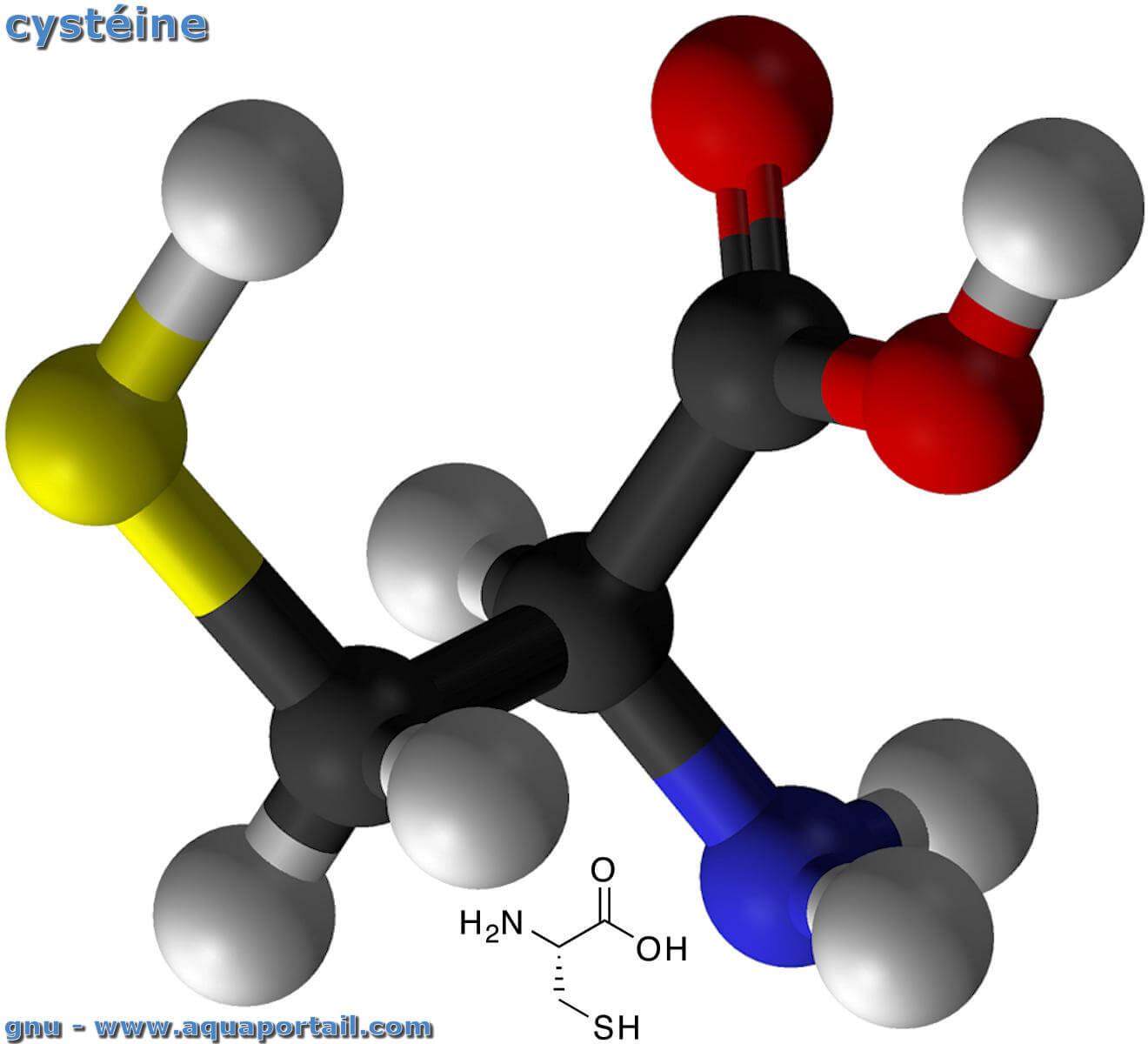
La cystéine, ou acide 2-amino-3-sulfanylpropanoïque, a pour formule moléculaire (formule brute) C3H7NO2S. La masse molaire est 121,16 g/mol avec un point de fusion à 513,15 K (240 °C). La solubilité dans l'eau est de 280 g/l.
Explications
Une cystéine est un acide aminé non essentiel, ce qui signifie qu'il peut être synthétisé par l'homme. La cystéine contient un groupe thiol (-SH-) dans sa chaîne latérale qui fait de cet acide aminé, dans son intégralité, être considéré comme polaire et hydrophile. La partie thiol de la chaîne participe généralement à des réactions enzymatiques, agissant en tant que nucléophile. Le thiol est sujet à l'oxydation pour donner des ponts disulfures dérivés de la cystéine qui jouent un rôle structurel important dans de nombreuses protéines.
La cystéine est aussi appelée cystine, mais cette dernière est un dimère de deux cystéines liées par un pont disulfure.
La cystathionine (un métabolite de la méthionine) se rompt grâce à la cystathionase en cystéine et acide a-cétobutyrique. Une cystathionine est un acide aminé soufré qui résulte de la condensation de la serine et de l'homocystéine grâce à la cystathionine synthétase. La cystathionase permet de rompre la liaison dans un acide aminé de la cystathionine. La "cystathionine synthétase" permet de lier deux composés en un acide aminé qui est la cystathionine.
Source de nourriture fournie par la L-cystéine
Bien qu'elle soit classée comme acide aminé non essentiel, la cystéine peut dans certains cas être essentielle pour les bébés, les personnes âgées et les personnes souffrant de certaines maladies métaboliques ou souffrant de syndromes de malabsorption. La cystéine est normalement synthétisée par le corps humain dans des conditions physiologiques normales, à condition qu'il y ait suffisamment de méthionine.
La cystéine est potentiellement toxique et catabolisée dans le système digestif et le plasma sanguin. La cystéine se déplace en toute sécurité dans le système digestif et le plasma et se réduit rapidement aux deux molécules de cystéine qui pénètrent dans la cellule. La cystéine contient la plupart des aliments riches en protéines, tels que :
- Ressources animales : porc, viande de saucisse, poulet, dinde, canard, charcuterie, oeufs, lait, fromage cottage, yaourt.
- Ressources végétales : poivrons rouges, ail, oignons, chayotte, brocoli, chou de Bruxelles, muesli, germe de blé.
Comme les autres acides aminés, la cystéine a un caractère amphotère.
Pour sa synthèse, la cystéine bêta synthétase catalyse la réaction supérieure et la cystathionine gamma-lyase catalyse la réaction inférieure. Chez les animaux, la biosynthèse commence par la sérine, un acide aminé.
Le soufre est dérivé de la méthionine qui est convertie en homocystéine par l'intermédiaire de la S-adénosylméthionine, après quoi la cystathionine bêta-synthétase associe l'homocystéine et la sérine pour former le thioéthercystathionine asymétrique. L'enzyme cystathionine gamma-lyase convertit la cystathionine en cystéine et en alpha-cétobutyrate.
Chez les plantes et les bactéries, la biosynthèse de la cystéine commence également à partir de la sérine, qui est convertie en O-acétyl-sérine par l'action de l'enzyme sérine acétyltransférase (EC 2.3.1.30). L'enzyme O-acétylsérine (thiol)-liase ((OAS-TL; EC 2.5.1.47), utilisant du soufre sous forme d'hydrogène sulfuré, convertit cet ester en cystéine par déplacement de l'acétate.
Fonctions biologiques
Le groupe thiol de la cystéine est nucléophile et facilement oxydable. La réactivité augmente lorsque le thiol est ionisé et que les résidus de cystéine dans les protéines ont des valeurs de pH proches de la neutralité, de sorte que les thiols se révèlent souvent réactifs dans la cellule. En raison de sa haute réactivité, le groupe thiol de la cystéine a de nombreuses fonctions biologiques.
En raison de la capacité des thiols à subir des réactions d'oxydo-réduction, la cystéine a des propriétés antioxydantes. Ces propriétés antioxydantes de la cystéine sont principalement exprimées dans le tripeptide glutathion, produit à la fois par l'homme et par d'autres organismes. La disponibilité systématique de glutathion par voie orale (GSH) est insignifiante; par conséquent, il doit être biosynthétisé à partir des acides aminés qui le constituent, tels que la cystéine, la glycine et l'acide glutamique.
L'acide glutamique et la glycine sont abondamment présents dans la plupart des régimes occidentaux. La disponibilité de la cystéine peut donc être le substrat limitant.
La cystéine est une source importante de soufre dans le métabolisme humain. Le soufre des groupes fer-soufre et azote est extrait de la cystéine et se transforme en alanine au cours du processus.
Outre les protéines fer-soufre, de nombreux autres cofacteurs métalliques dans les enzymes sont des liaisons pour le substituant thiol des résidus de cystéine. Des exemples en doigts en sont le zinc dans les doigts de zinc et l'alcool déshydrogénase; cuivre dans les protéines bleues cuivreuses, fer dans le cytochrome P450; et nickel dans la [NiFe] -hydrogénase. Le groupe thiol a également une grande affinité pour les métaux lourds. Par conséquent, les protéines contenant de la cystéine, telles que la métallothionine, se lient aux métaux tels que le mercure, le plomb et le cadmium fort.
Outre son oxydation en cystine, la cystéine participe à de nombreuses modifications post-traductionnelles. Le groupe thiol nucléophile permet à la cystéine de conjuguer d'autres groupes, tels que la prénylation, l'ubiquitine ligase, le transfert de l'ubiquitine à ses pendentifs, les protéines et les caspases qui participent à la protéolyse dans le cycle apoptotique.
Les entines (introns protéiques) agissent normalement comme aide à la cystéine catalytique. Ces rôles de la cystéine sont généralement limités au milieu intracellulaire, où le milieu est réduit et la cystéine n'est pas oxydée en cystine.
Protéase à cystéine et régulateur enzymatique
Les protéases à cystéine (CP) sont responsables de nombreux processus biochimiques intervenant dans les organismes vivants. Elles ont été impliquées dans le développement et la progression de plusieurs maladies qui impliquent un renouvellement anormal des protéines.
Le rôle physiologique principal des protéases à cystéine est la dégradation métabolique des peptides et des protéines. L'activité des protéases à cystéine est régulée entre autres par leurs inhibiteurs spécifiques : les cystatines. Voir aussi le rôle de la cathepsine.
Les protéases à cystéine jouent des rôles à multiples facettes, pratiquement dans tous les aspects de la physiologie et du développement. Les protéases à cystéine sont responsables de la sénescence et de l'apoptose, des réponses immunitaires du CMH de classe II, du traitement des prohormones et du remodelage de la matrice extracellulaire important pour le développement osseux.
La capacité des macrophages et d'autres cellules à mobiliser les cystéine protéases élastolytiques à leur surface dans des conditions spécialisées peut également conduire à une dégradation accélérée du collagène et de l'élastine au niveau des sites d'inflammation dans des maladies telles que l'athérosclérose et l'emphysème. Plusieurs virus expriment tout leur génome sous forme d'une polyprotéine massive unique et utilisent une protéase pour la cliver en unités fonctionnelles.
En tant que deux grandes familles de cystéine protéases, les caspases sont cytosoliques, spécifiques de l'asparate et impliquées dans l'apoptose tandis que les cathepsines sont principalement lysosomales, actives dans des conditions acides et impliquées dans la dégradation des protéines.
Autres métabolites
Le produit de décarboxylation de la cystéine est la cystéamine, une amine biogénique qui est un composant fondamental de la coenzyme A. Le produit de la transamination de la cystéine est le mercaptopyruvate, qui peut être dégradé en pyruvate ou réduit en mercaptolactate par diverses voies possibles, en fonction de l'organisme.
De nombreux microorganismes et plantes fixent les anions cyanure par substitution nucléophile par sulfhydryle pour donner le produit cyanoalanine pouvant être hydrolysé en aspartate.
Le soufre de la cystéine peut être méthylé pour obtenir un homologue de la méthionine appelé S-méthylcystéine. Il existe un groupe de métabolites provenant de l'oxydation de l'atome de soufre de la cystéine. Deux exemples de ces métabolites sont la taurine et l'acide cystéique.
La cystéine peut être conjuguée à un groupe allyle (d'origine biosynthétique non encore décrite) pour donner de la S-allylcystéine qui, lorsqu'elle est oxydée dans l'atome de soufre, génère l'alliine, précurseur des disulfures d'allyle et des sulfoxydes d'allyle qui donnent leur arôme à l'oignon et l'ail.
Applications
La cystéine, principalement sous forme d'énantiomère L, est un précurseur utilisé dans l'industrie alimentaire, l'industrie pharmaceutique et l'industrie des soins personnels. Une de ses plus grandes applications est la production de saveurs. Par exemple, la réaction de la cystéine avec les sucres dans la réaction de Maillard produit des arômes de la viande. Dans le domaine des produits de soins personnels, la cystéine est utilisée de manière permanente, principalement en Asie, car elle permet de rompre les ponts disulfures présents dans la kératine capillaire. La cystéine est une cible très populaire dans les laboratoires lorsqu'elle étudie des structures biomoléculaires.
En 1994, des études effectuées dans cinq des principales sociétés productrices de tabac ont montré que la cystéine était l'un des 599 additifs contenus dans les cigares. Comme de nombreux additifs pour le tabac, son utilisation à dessein est inconnue.
Cas spécifique des ovins (moutons)
Les moutons ont besoin de la cystéine pour produire la laine. Pour eux, c'est un acide aminé essentiel qui doit être ingéré en mangeant de l'herbe. En conséquence, pendant les phases de sécheresse, les moutons cessent de produire de la laine. Cependant, des moutons transgéniques ont été développés pour produire leur propre cystéine.
Réduction des effets toxiques de l'alcool
La cystéine a été proposée en tant que prévention ou antidote à certains des effets négatifs de l'alcool, notamment des dommages au foie ou la gueule de bois. La cystéine neutralise les effets nocifs de l'acétaldéhyde, principal produit du métabolisme de l'alcool et à l'origine de la plupart des effets tardifs de l'alcool et des dommages à long terme associés à la consommation d'alcool (mais pas pour des effets immédiats tels que l'ivresse). La cystéine est la prochaine étape du métabolisme, qui consiste à convertir l'acétylaldéhyde en acide acétique relativement nocif.
Dans les études sur les rongeurs, les animaux testés ont reçu des doses LD50 d'aldéhyde (la quantité qui tue normalement la moitié des animaux). Ceux ayant reçu de la cystéine avaient un taux de survie de 80 %, tandis que ceux qui avaient été ajoutés thiamine, a survécu dans son intégralité. Il n'y a toujours pas de preuve claire de son efficacité chez les humains qui consomment de l'alcool à des taux normaux.
N-acétylcystéine (NAC)
La N–cétyl-L-cystéine (NAC) est un dérivé de la cystéine dans laquelle le groupe acétyle est lié à l'atome d'azote. Ce composé peut être considéré comme un complément alimentaire, bien que ce ne soit pas une voie idéale, car il est catabolisé dans l'intestin. Le NAC est généralement utilisé comme médicament contre la toux, car il rompt les ponts disulfure dans la muqueuse en le liquéfiant, facilitant ainsi son expulsion. Cette action de rupture des ponts disulfures rend également le NAC très utile pour réduire les anomalies dans l'épaisseur de la muqueuse chez les patients atteints de fibrose kystique.
Le NAC est également utilisé comme antidote spécifique en cas de surdosage de paracétamol.
Histoire
Le chimiste suédois, le comte Morner, réalisa le premier isolement de la protéine cystéine en 1899. Auparavant, le professeur Eugen Baumann avait également réussi à réduire la cystine.
Synonymes, antonymes
Voir tous les synonymes pour "cystéine".1 synonyme (sens proche) de "cystéine" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CYSTÉINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CYSTEINE est dans la page 9 des mots en C du lexique du dictionnaire.
Mots en C à proximité
cypris cypsela cypsèle cyste cyste germinal cystéinecysticercoïde cysticerque cystide cystidiole cystine
En rapport avec "cystéine"
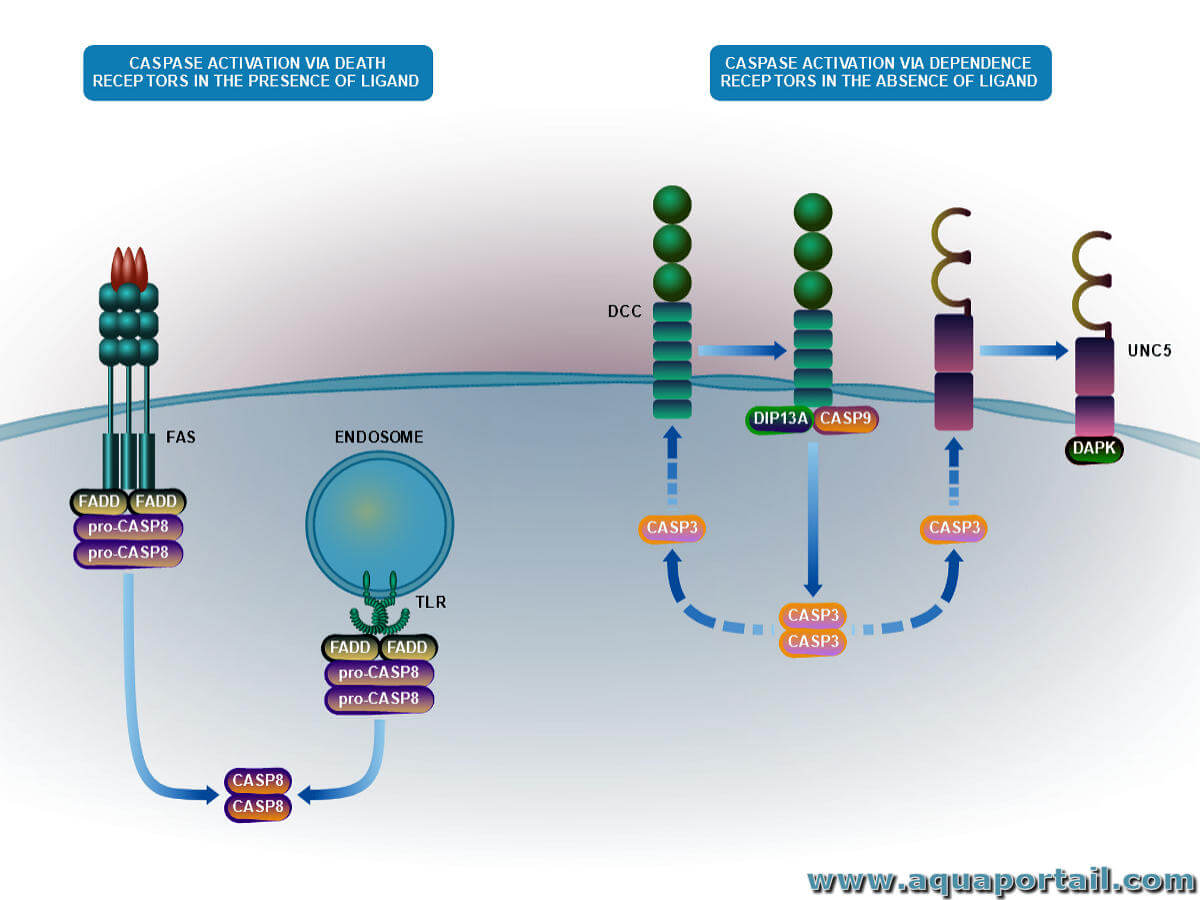
Une caspase est une protéase à cystéine. Les caspases clivent des protéines telles que la cytokine pro-IL-1β qui est ensuite sécrétée du cytoplasme cellulaire...
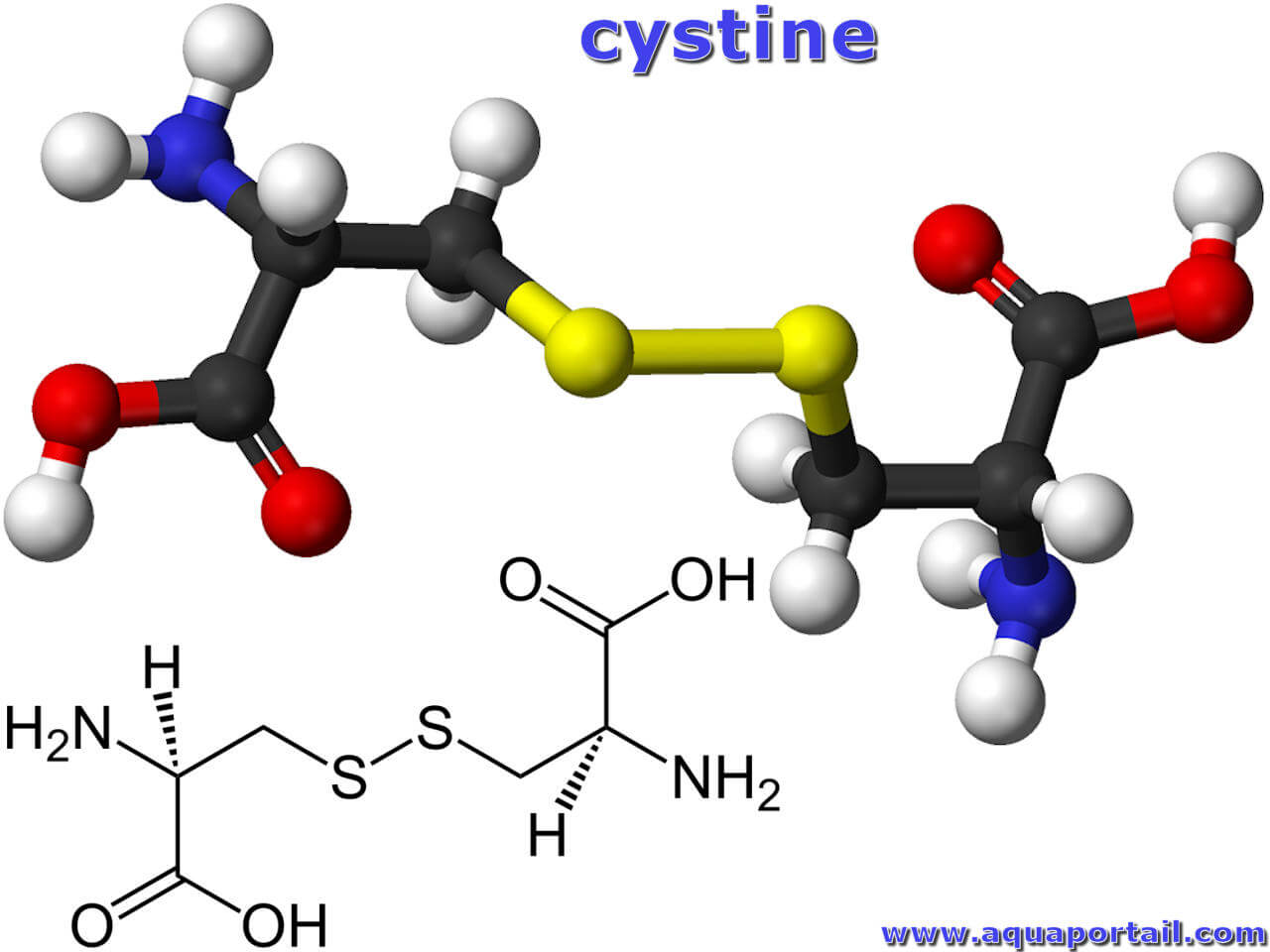
Une cystine est un acide aminé formé de deux molécules de cystéine unies par une liaison disulfure, jouant un rôle important dans la formation de la structure...
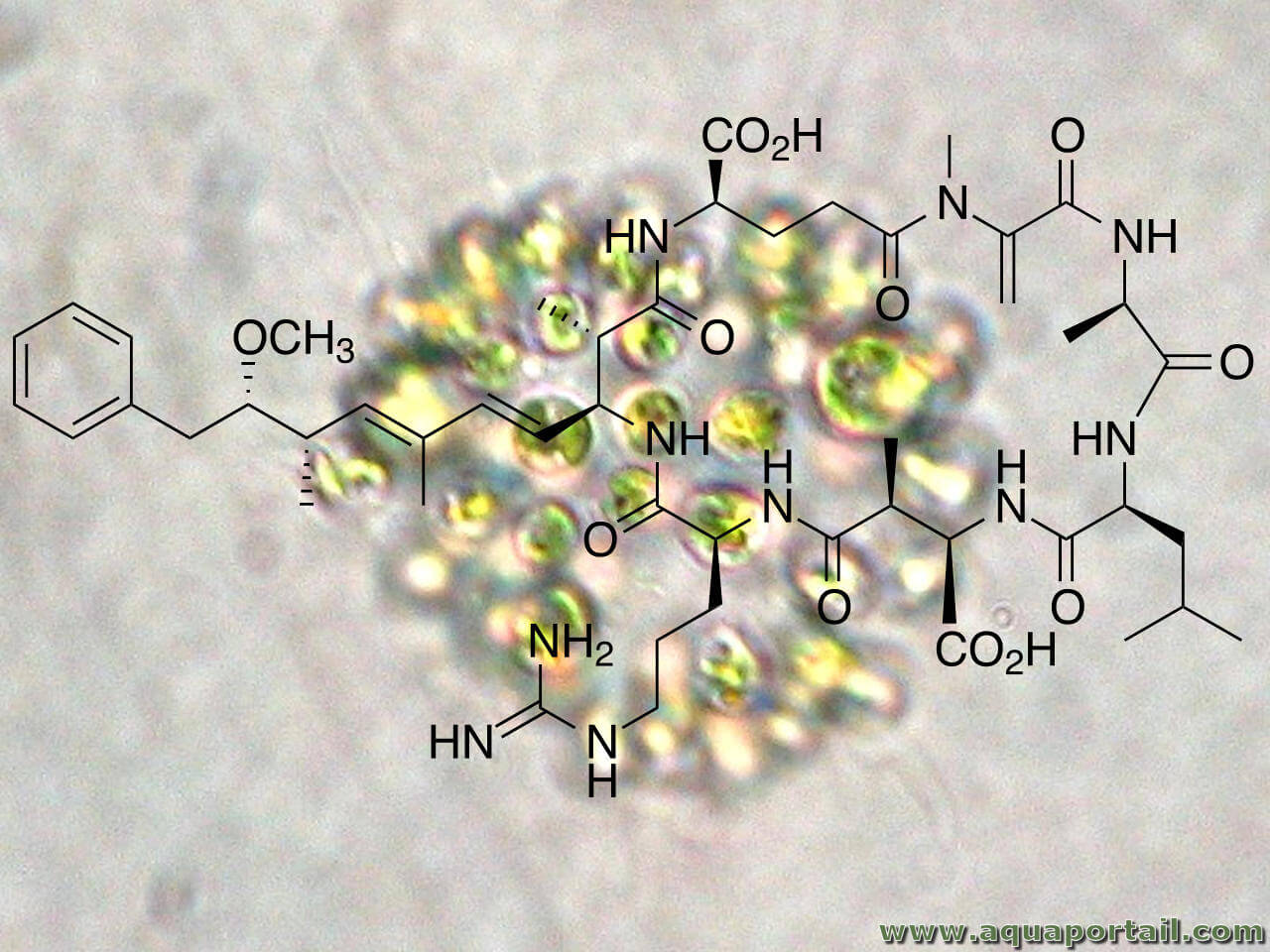
La microcystine est une cystine, un polypeptide cyclique toxique produit par des cyanobactéries connues sous leur nom populaire du genre Microcystis...

Une apolipoprotéine est une protéine qui contient et transporte des lipides dans le sang. Elle est une hétéroprotéine amphipathique avec un groupe prosthétique...
