Glutathion
Définition
Le glutathion (GSH) est un important tripeptide composé des acides aminés cystéine, acide glutamique et glycine. Largement présent dans les tissus des mammifères, il joue un rôle multifonctionnel comme puissant antioxydant, piégeur de radicaux libres et agent détoxifiant.
La structure du glutathion :
Le glutathion (GSH) est un tripeptide non protéique formé d'un acide glutamique, le glutamate, d'une cystéine et d'une glycine (cas de la forme réduite GSH), intervenant dans des réactions diverses. Le glutathion contient une liaison peptidique inhabituelle entre le groupe amine de la cystéine et le groupe carboxyle de la chaîne latérale du glutamate.
Explications
Structurellement, le glutathion est constitué d'acide glutamique lié par sa chaîne latérale à l'extrémité N-terminale de la cystéinylglycine, ce qui lui confère des propriétés biochimiques distinctes. Il est reconnu pour ses divers rôles biologiques, comme agent éclaircissant de la peau, métabolite humain, métabolite murin, métabolite d'Escherichia coli, agent anti-âge (géroprotecteur), antioxydant et cofacteur.
Le glutathion est nucléophile dans le soufre et attaque les accepteurs conjugués électrophiles toxiques. Les groupes thiol sont maintenus dans un état réduit à une concentration d'environ 5 mM dans les cellules animales. En effet, le glutathion réduit toute liaison disulfure formée au sein des protéines cytoplasmiques de la cystéine en agissant comme donneur (d'électrons). Dans le processus, le glutathion est converti en sa forme oxydée, appelée disulfure de glutathion (GS-SG). Dans les cellules, le glutathion se trouve principalement à l'état réduit (GSH) et, dans une bien moindre mesure, à l'état oxydé (GS-SG).
C'est le cas puisque l'enzyme qui "réduit" le tripeptide de sa forme oxydée, la glutathion réductase, est constitutivement active et inductible en situation de stress oxydatif. En fait, le rapport GSH/GS-SG dans les cellules est souvent utilisé comme "indicateur" de l'état oxydant et de la toxicité cellulaire de la cellule
Sous la forme oxydée, deux glutathions sont réunis par une liaison disulfure entre les deux cystéines (GS-SG). Une enzyme à sélénium, la glutathion peroxydase, catalyse la réduction des radicaux libres et des peroxydes grâce à la déshydrogénation du glutathion.
Le glutathion n'est pas un nutriment essentiel, car il peut être synthétisé à partir des acides aminés L- cystéine, acide L-glutamique et glycine. Le sulfhydryle (thiol), groupe (SH) de la cystéine, sert de donneur d'électrons et est responsable de l'activité biologique du glutathion. La fourniture de cet acide aminé est le facteur limitant dans la synthèse du glutathion dans les cellules, car la cystéine est rare dans les produits alimentaires. D'autre part, si elle est libérée, en tant qu'acide aminé libre, la cystéine est toxique et se catabolise spontanément dans le tractus gastro-intestinal et le plasma sanguin.
Rôles
Le glutathion est le principal antioxydant des cellules, il est omniprésent et aide à les protéger des espèces d'oxygène réactives, telles que les radicaux libres et les peroxydes.
Le glutathion participe à divers processus physiologiques, notamment comme cofacteur de l'enzyme glutathion peroxydase, favorisant l'absorption des acides aminés et contribuant à la synthèse des leucotriènes. En tant que substrat de la glutathion S-transférase, il réagit avec des substances chimiques nocives telles que les halogénures, les époxydes et les radicaux libres, les transformant en sous-produits inactifs et inoffensifs. Dans les globules rouges, ces réactions sont importantes pour réduire les dommages oxydatifs en neutralisant la méthémoglobine et les peroxydes.
De plus, le glutathion intervient dans la formation et la stabilisation des liaisons disulfures dans les protéines et facilite le transport des acides aminés à travers les membranes cellulaires.
Synthèse
Classé comme tripeptide, thiol et dérivé de la L-cystéine, il remplit de multiples fonctions métaboliques. De plus, il existe sous forme d'acide conjugué du glutathionate(1-).
Le glutathion est synthétisé en deux étapes dépendant de l'adénosine triphosphate :
- Tout d'abord, la gamma-glutamylcystéine est synthétisée à partir de L-glutamate et de cystéine par l'intermédiaire de l'enzyme gamma-glutamylcystéine synthétase (également connue sous le nom de glutamate-cystéine ligase (GCL) ligase). Cette réaction est l'étape limitante dans la synthèse du glutathion.
- Deuxièmement, la glycine est ajoutée à l'extrémité C-terminale de la gamma-glutamylcystéine, via l'enzyme glutathion synthétase.
Le glutathion est vendu en comprimés :
La supplémentation en glutathion a été difficile, car les recherches suggèrent que le glutathion par voie orale n'est pas bien absorbé par le tractus gastro-intestinal. Cependant, les concentrations plasmatiques et hépatiques de glutathion peuvent être récupérées avec l'administration orale de S-adénosyl méthionine.
Chez les animaux et les insectes, la glutamate de cystéine ligase (GCL) est une enzyme hétérodimère composée d'un catalyseur (GCLC) et d'une sous-unité modulante (GCLM). La chromatographie en phase gazeuse représente toute l'activité enzymatique, tandis que la technologie GCLM augmente l'efficacité catalytique de la chromatographie en couche mince Les souris sans GCLC (c.-à-d. Toutes les nouvelles synthèses de GSH) meurent avant la naissance. Les souris dépourvues de GCLM ne présentent pas de phénotype, mais présentent une diminution marquée du GSH et une sensibilité accrue à la toxicité.
Bien que toutes les cellules du corps humain soient capables de synthétiser du glutathion, il a été démontré que la synthèse du glutathion par le foie est essentielle. Après la naissance, les souris atteintes de CPGLC induisent une perte génétique (c'est-à-dire la synthèse de GSH) seulement dans le foie meurent dans le mois qui suit la naissance.
La glutamate de cystéine ligase (GCL) végétale est une enzyme redox homodimère sensible, conservée dans le règne végétal. Dans un environnement oxydant, des ponts disulfures intermoléculaires sont formés et l'enzyme passe à l'état dimère actif. Le potentiel critique moyen de la cystéine parella est de -318 mV.
Outre le contrôle redox, il existe une enzyme GCL inhibée par le GSH. La GCL ne se trouve que dans les plastides et la glutathion synthétase dans les plastides et le cytosol; Par conséquent, ils sont exportés (GSH et gamma-glutamylcystéine) à partir de plastides. Les deux biosynthèses des enzymes glutathion sont essentielles chez les plantes.
La voie de biosynthèse du glutathion est présente dans certaines bactéries, telles que les cyanobactéries et les protéobactéries, mais elle est absente dans de nombreuses autres. La plupart des organismes eucaryotes synthétisent du glutathion, y compris les humains, mais pas tous, comme les légumineuses, Entamoeba et Giardia.
Synonymes, antonymes
Voir tous les synonymes pour "glutathion".0 synonyme (sens proche) pour "glutathion".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à GLUTATHION sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot GLUTATHION est dans la page 2 des mots en G du lexique du dictionnaire.
Mots en G à proximité
glutamate glutamate monosodique glutaminase glutamine glutamine synthétase glutathionglutathion peroxydase glutéline gluten glycane glycémie
En rapport avec "glutathion"
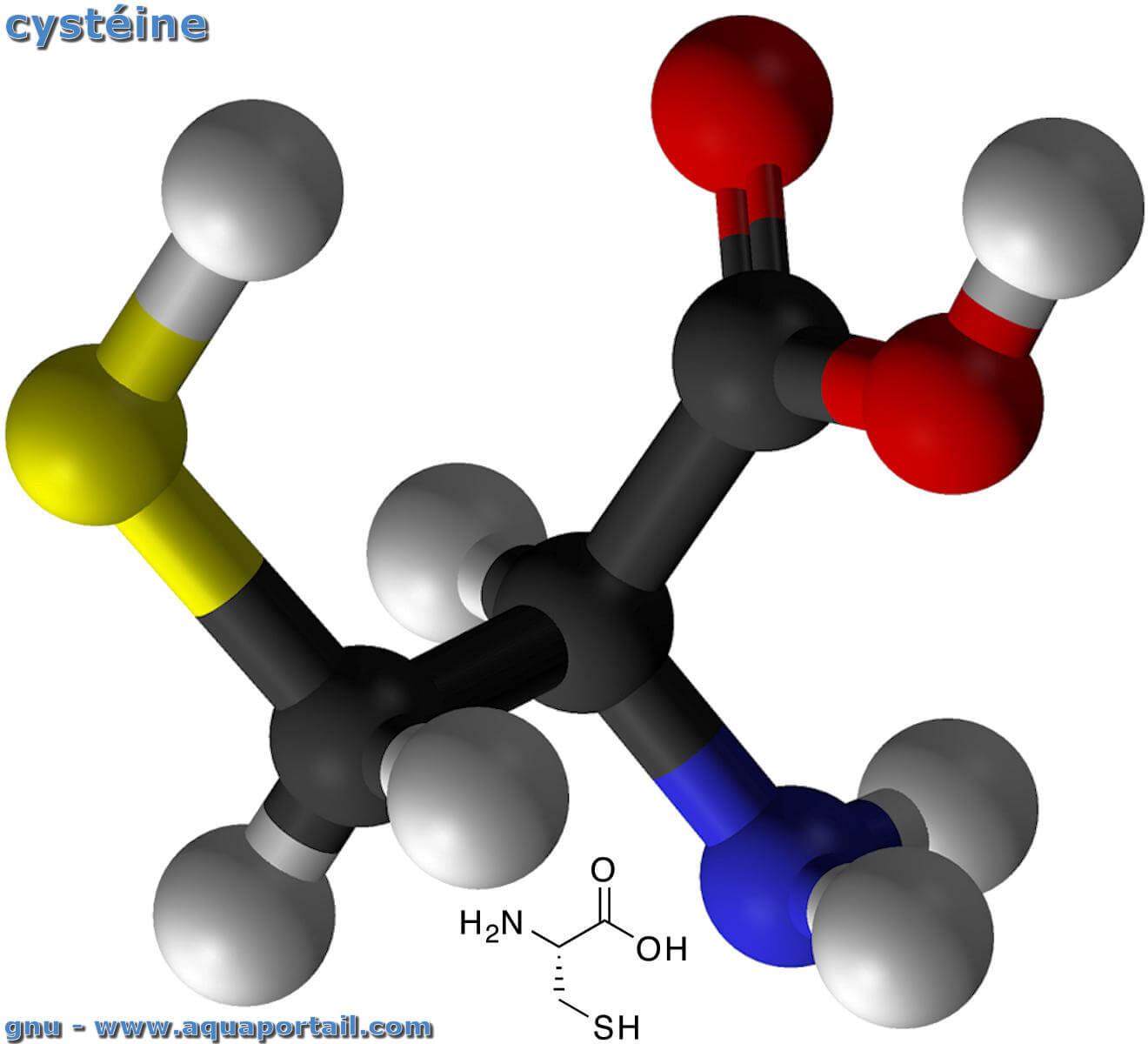
La cystéine (Cys ou C) est un acide alpha-aminé soufré constitutif des protéines, de formule chimique HS-CH₂-CH(NH₂)-COOH, portant un groupement thiol (-SH).
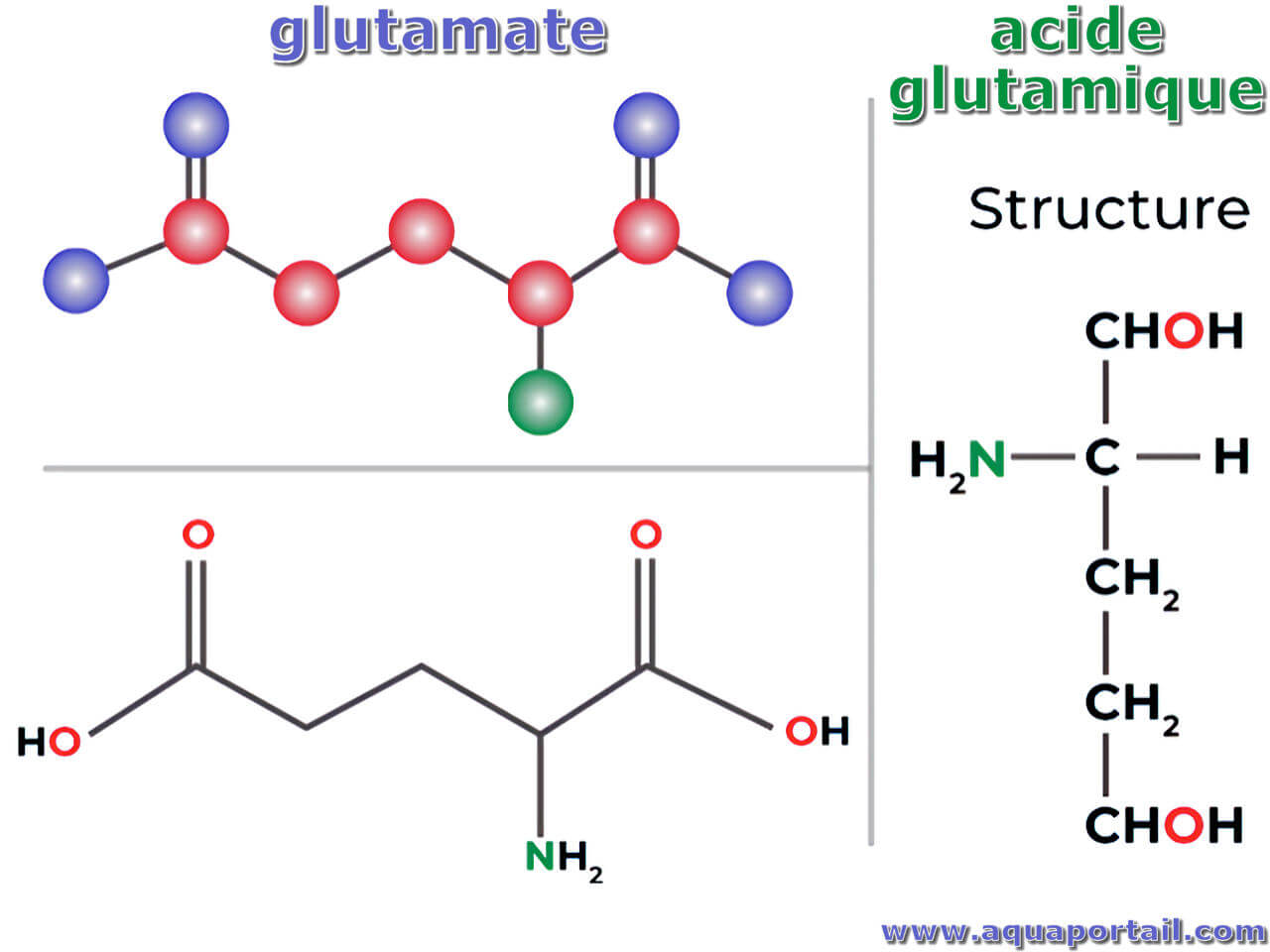
Le glutamate, la forme ionique de l'acide glutamique, est un puissant neurotransmetteur excitateur qui est libéré par les cellules nerveuses du cerveau.

Le glutamate monosodique (MSG) est un sel de sodium de l'acide glutamique. Il est utilisé comme exhausteur de goût, souvent ajouté aux aliments...

La glutathion peroxydase (GPx) est un type d'enzymes antioxydantes qui protègent les cellules du stress oxydatif en convertissant les peroxydes nocifs, comme...
