Peroxyde
Définition
Un peroxyde, de la classe de désinfectants utilisés pour la stérilisation, agit par oxydation. Il est un composé organique ou minéral contenant deux atomes d'oxygène adjacents. La solution aqueuse du peroxyde d'hydrogène est communément appelée eau oxygénée.
Les peroxydes sont des oxydes qui ont une plus grande quantité d'oxygène qu'un oxyde normal et dans leur structure ils montrent une simple liaison covalente entre l'oxygène et l'oxygène.
Des peroxydes :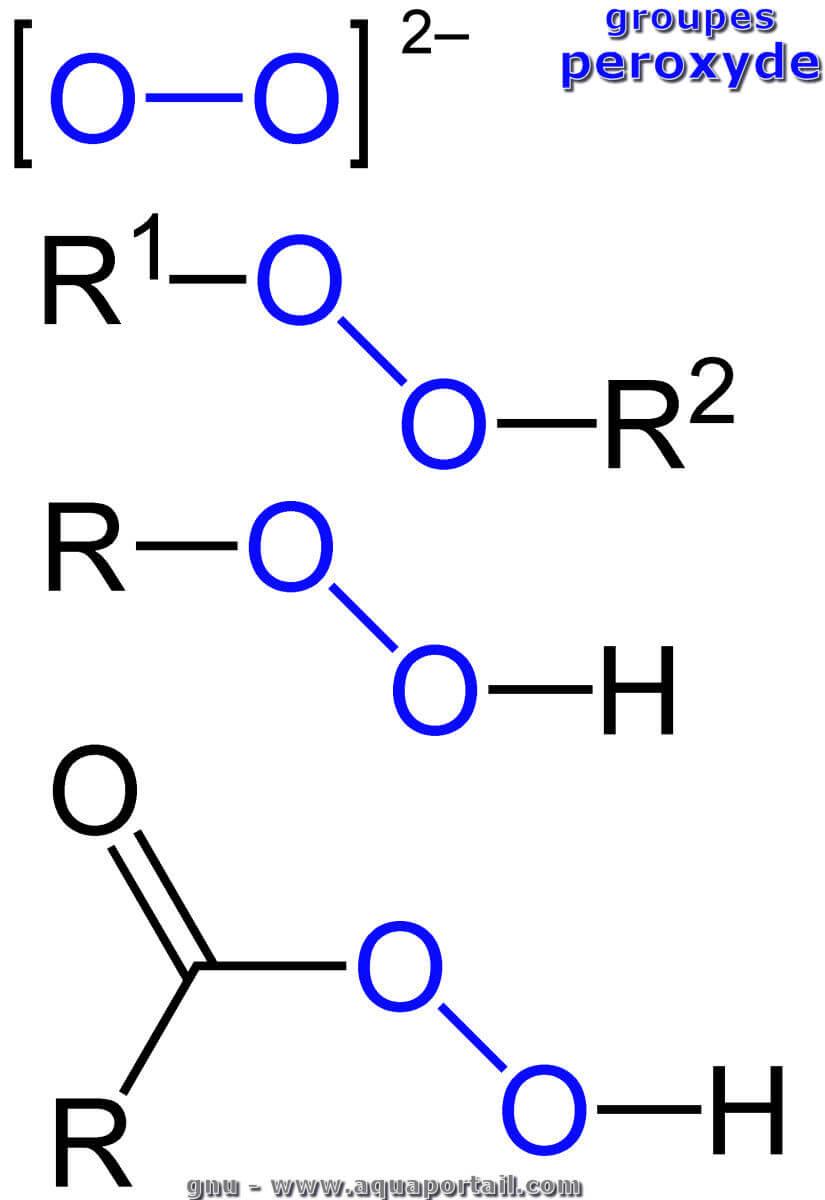
Le groupe peroxyde marqué en bleu dans (de haut en bas) l'anion peroxyde, et les peroxydes souvent instables au sens strict, les hydroperoxydes et les acides peroxycarboxyliques. R, R1 et R2 sont des radicaux organyle (radical alkyle, radical aryle, radical alkylaryle, etc.).
Explications générales
Les peroxydes sont des substances qui ont une liaison oxygène-oxygène et qui contiennent de l'oxygène à l'état d'oxydation -1. La formule générale des peroxydes est Métal + (O-1)2-2. Ils se comportent généralement comme des substances oxydantes.
Le contact avec des matériaux combustibles peut provoquer des incendies ou même des explosions. Cependant, contre les oxydants forts tels que le permanganate, ils peuvent agir comme un réducteur, en s'oxydant en oxygène élémentaire. Il est important de souligner que le peroxyde a une charge.
Le peroxyde le plus connu et le composé de départ principal dans la synthèse d'autres peroxydes est le peroxyde d'hydrogène H2O2. De nos jours, il est généralement obtenu par auto-oxydation de la naphtohydroquinone. Dans le passé, on utilisait la formation de peroxyde de baryum ou l'hydrolyse de persulfates qui, à leur tour, étaient générés par électrolyse de sulfates en solution aqueuse avec des densités de courant élevées par surface d'électrode.
De nombreuses substances organiques peuvent être converties en hydroperoxydes dans des réactions d'auto-oxydation en présence de lumière et d'oxygène atmosphérique. La formation d'éthers est particulièrement dangereuse car ils se transforment très facilement et les peroxydes sont généralement enrichis dans le résidu d'une distillation ultérieure. Là, ils peuvent produire des explosions très fortes. Beaucoup des accidents de laboratoire les plus tragiques sont dus à ce type de réaction. Par conséquent, avant de distiller de plus grandes quantités de ces solvants, la présence de peroxydes doit être testée avec du papier imprégné d'iodure de potassium et d'amidon. La formation d'une couleur bleuâtre ou foncée indique la présence de peroxyde. (Le peroxyde oxyde l'iodure en iode élémentaire qui, à son tour, forme un complexe d'inclusion de la couleur foncée caractéristique avec l'amidon).
Souvent, les peroxydes sont instables, donc pas stockables et parfois des substances dangereuses. Par conséquent, ils sont souvent produits sur place (in situ) et immédiatement mis en oeuvre.
Le groupe de composés peroxydiques peut initialement être grossièrement subdivisé en peroxydes inorganiques et organiques, les composés inorganiques ayant souvent un caractère semblable à un sel, tandis que les composés organiques portent des groupes peroxy liés par covalence. La liaison oxygène-oxygène des peroxydes est labile et sujette à un clivage homolytique pour former des radicaux réactifs. Pour cette raison, les peroxydes se trouvent dans la nature seulement en petites quantités, y compris dans l'eau et l'atmosphère (atmosphère terrestre) et en petites quantités dans les organismes végétaux, animaux et humains.
Utilisations et applications
Dans l'industrie alimentaire, le peroxyde est utilisé comme paramètre pour mesurer la qualité des huiles et des graisses, qui sont susceptibles de devenir rances ou décomposées, au moyen de la technique de mesure de l'indice de peroxyde (ou indice de peroxydation); la peroxydation étant l'une des causes qui provoque des caractéristiques rejetables dans la qualité des aliments (tels que les huiles, entre autres).
De même, les applications de peroxydes sont très polyvalentes (de la coiffure où elles sont utilisées dans les colorants pour éclaircir les cheveux même dans les carburants).
Dans l'industrie chimique, ils sont utilisés dans la préparation d'époxydes, dans diverses réactions d'oxydation, comme initiateurs de réactions radicalaires, par exemple pour durcir des polyesters ou dans la fabrication de glycérol à partir d'alcool hydroxypropylène. L'acide peroxytrifluoroacétique (F3C-C(=O)-O-O-H) est un désinfectant très puissant et est utilisé tel quel dans l'industrie pharmaceutique. En dentisterie, il est utilisé pour le blanchiment des dents, appliqué en gel ou dans des bandes imprégnées de peroxyde à des concentrations de 9 %, 16 % et 25 %.
Une importance industrielle est donnée aux peroxydes par leur action de blanchiment vis-à-vis des substances organiques. Ils sont donc ajoutés aux détergents, y compris sous le nom d'oxygène actif, ou utilisés dans les produits de teinture capillaire. D'autres domaines d'application comprennent l'industrie chimique, où les peroxydes sont utilisés pour la synthèse ou les intermédiaires, et les médicaments. Le peroxyde d'hydrogène est le composé de peroxyde le plus important économiquement avec un volume de production annuel de plus de 2000 000 de tonnes.
État d'oxydation
L'état d'oxydation de l'oxygène dans les groupes peroxyde est -1.
Les peroxydes donnent une coloration orange avec des solutions d'oxyde de titane dans de l'acide sulfurique concentré.
Avec le dichromate de potassium, ils forment le peroxyde de chrome (VI) de couleur bleue qui peut être extrait avec de l'éther éthylique.
Peroxydes inorganiques
Le groupe des peroxydes inorganiques est divisé en classes de peroxydes ioniques et en peroxydes d'acides inorganiques qui portent des motifs peroxyde liés de manière covalente. Alors que depuis la première classe, les peroxydes des métaux alcalins et alcalino-terreux ont une importance technique, le représentant le plus important du peroxyde d'hydrogène covalent. En outre, un certain nombre de peroxydes d'acides minéraux tels que l'acide de Caro et l'acide percarbonique sont importants. Contrairement au caractère purement ionique des peroxydes de métaux alcalins, les peroxydes des métaux de transition ont un caractère plus covalent, en raison de leur plus grande électronégativité.
Les peroxydes sont des oxydants forts et peuvent être utilisés pour l'oxydation d'autres composés.
Les peroxydes de métaux alcalins peuvent être utilisés pour synthétiser des peroxydes organiques. Un exemple est la réaction du peroxyde de sodium avec le chlorure de benzoyle pour donner du peroxyde de dibenzoyle.
De nombreux peroxydes inorganiques sont utilisés comme agents de blanchiment dans l'industrie textile ainsi que dans l'industrie du papier. L'utilisation croissante de procédés de blanchiment sans danger pour l'environnement a considérablement augmenté l'utilisation de composés contenant du peroxyde et a largement déplacé l'ancienne approche basée sur le composé à base de blanchiment. Les usages domestiques incluent les détergents. Dans le passé, des perborates étaient utilisés à cette fin, qui étaient en grande partie remplacés par des percarbonates en raison de l'augmentation des concentrations de bore dans l'environnement. L'utilisation de composés de peroxyde dans les détergents est également reflétée dans leurs noms commerciaux. Ainsi, le nom du détergent Persil est composé des mots Per borate et silicate.
Par réaction avec le dioxyde de carbone, l'oxygène peut être libéré de certains sels peroxydiques pour former des sels de carbonate. Ceci est exploité dans les générateurs d'oxygène, par exemple dans les respirateurs, les sous - marins ou les capsules spatiales. Pour la génération d'oxygène dans ce cas, le dioxyde de carbone indésirable dans l'haleine, qui est libéré comme un produit métabolique dans l'environnement, a réagi et libéré l'oxygène requis. Dans la plupart des cas, le peroxyde de sodium est utilisé pour cela, mais dans les capsules spatiales on utilise du peroxyde de lithium, car il a une masse molaire inférieure et est capable de produire un volume relativement important d'oxygène par unité de poids.
Le peroxyde de baryum a toujours été utilisé pour produire de l'oxygène pur à partir de l'air. À cet effet, l'équilibre dépendant de la température entre l'oxyde de baryum et le peroxyde a été exploité. Par la réaction de l'oxyde de baryum avec l'air, le peroxyde de baryum s'est d'abord formé à 500 °C. Cela libère de l'oxygène à des températures supérieures à 700 °C avec la formation d'oxyde de baryum.
Peroxydes organiques
Le groupe des peroxydes organiques est essentiellement divisé en deux classes de composés, les acides peroxycarboxyliques et les peroxydes organiques ou hydroperoxydes. La première classe dérive des acides carboxyliques, la seconde provient formellement des éthers ou des alcools.
Les acides peroxycarboxyliques sont généralement des acides plus faibles que leurs acides carboxyliques sous-jacents. Comme la plupart des composés de peroxyde, ils ont tendance à être explosifs en forte concentration et à des températures plus élevées.
En présence de composés oxydables, ils peuvent fonctionner comme agents oxydants.
Les peracides organiques peuvent être utilisés pour synthétiser des époxydes. Cela arrive dans la réaction de Prileschaev. Le réarrangement de Baeyer-Villiger pour la synthèse de lactones à partir de cétones cycliques est un autre domaine d'application pour les peroxydes organiques. Dans les deux cas, les acides peroxycarboxyliques pauvres en électrons conviennent particulièrement bien à la réaction. Un peracide couramment utilisé est l'acide méta-chloroperbenzoïque (m CPBA).
L'hydroperoxyde de tert-butyle hydroperoxyde est utilisé dans l'époxydation de Sharpless pour la synthèse énantiosélective d'époxydes, pour lequel, entre autres, le prix Nobel de chimie 2001 a été décerné à Barry Sharpless, en tant qu'agent oxydant.
L'acide peracétique est utilisé comme désinfectant dans le domaine médical et dans l'industrie alimentaire. En outre, des solutions contenant du peroxyde pour nettoyer les lentilles de contact sont disponibles dans le commerce.
Le peroxyde de dibenzoyle est utilisé comme initiateur de radicaux dans les applications de laboratoire et industrielles. La liaison peroxydique faible peut être facilement clivée par homolyse pour former des radicaux benzoyle réactifs. Ceux-ci peuvent être utilisés à l'échelle industrielle pour la polymérisation de plastiques tels que le polyéthylène.
D'importance industrielle est la synthèse de l'ε-caprolactame nécessaire à la production de plastiques. Dans ce but, l'ε-caprolactone est formée par un réarrangement de Baeyer-Villiger de cyclohexanone avec de l'acide peracétique, qui est ensuite mis à réagir avec de l'ammoniac en lactame.
Les résines industrielles à base d'acrylates et / ou de méthacrylates sont invariablement produites par polymérisation radicalaire avec des peroxydes organiques à des températures élevées. Par un choix approprié de la température et du type de peroxyde, la vitesse de polymérisation peut être ajustée.
Il pourrait être produit peu d'agents peroxydiques. Ceux-ci comprennent, par exemple, l'artésunate et l'artémisinine. Leur mode d'action est basé sur la formation de radicaux aux sites désirés dans l'organisme.
En raison de l'effet explosif de nombreux peroxydes, des explosifs initiaux à base de peroxyde ont également été développés et utilisés. Parmi les plus connus sont le peroxyde d'acétone (apex) et l'hexaméthylène triperoxyde diamine (HMTD).
Anion peroxyde
Un anion peroxyde est un anion oxygène formé de deux atomes d'oxygène O22-. L'ion peroxyde a une seule liaison covalente oxygène-oxygène et un état d'oxydation de -1 sur les atomes d'oxygène. L'ion (anion) peroxyde est un puissant accepteur d'ions hydrogène, faisant des peroxydes des métaux alcalins et des métaux alcalino-terreux des bases fortes.
Les composés contenant l'anion O22-, tels que H2O2 et BaO2, sont des peroxydes (un peroxyde est défini comme un anion polyatomique) et non des hyperoxydes (ou superoxydes O2-). Voir aussi un dioxyde.
Les composés sont généralement classés comme ioniques ou covalents ou organiques ou inorganiques. Le groupe O-O est appelé groupe peroxo ou groupe peroxyde. Le peroxyde fait également référence à tout composé contenant l'anion peroxyde.
Mesures de sécurité
Les peroxydes sont des composés labiles et peuvent présenter un comportement explosif, en particulier à des concentrations plus élevées et à une température élevée. En outre, ils favorisent le feu et peuvent réagir avec des substances oxydables (y compris le coton et la cellulose) pour développer le feu. Pour cette raison, un certain nombre de précautions de sécurité devraient être prises en travaillant avec des peroxydes :
- La décomposition des peroxydes pour former des radicaux est favorisée par l'augmentation de la température et de la lumière. Pour cette raison, les composés de peroxyde doivent être conservés au frais dans des récipients opaques.
- Les substances qui ont tendance à former des peroxydes par auto-oxydation, comme l'éther diéthylique ou le tétrahydrofurane (THF), doivent être conservées dans des flacons sombres ou opaques sur de l'hydroxyde de sodium.
- Si des peroxydes sont suspectés, la présence de peroxydes doit être vérifiée avant de chauffer ou de concentrer une solution réactionnelle.
- De petites quantités de peroxydes provenant des réservoirs de stockage ou de réaction doivent être détruites par compensation avec des agents réducteurs tels que le sulfate ferreux. C'est seulement alors que la contamination peut être absorbée avec du papier.
La manipulation industrielle sûre de peroxydes exige des mesures de sécurité étendues. Les peroxydes organiques sont produits industriellement dans des structures cellulaires (protection contre les explosions). L'appareil est généralement dans des cellules en béton avec des fenêtres en aluminium pour le soulagement de la pression en cas d'explosion. D'autres mesures de sécurité comprennent des tranchées remplies d'eau devant les cellules de production, qui peuvent être inondées avec la solution réactionnelle en cas d'emballement thermique. Après la production et le remplissage de petits contenants, les composés de peroxyde doivent être rapidement transférés dans des entrepôts frigorifiques.
Les règles détaillées de prévention des accidents sont ancrées dans le cadre du règlement de l'association professionnelle DGUV règlement 13.
Synonymes, antonymes
Voir tous les synonymes pour "peroxyde".1 synonyme (sens proche) de "peroxyde" :
- eau oxygénée
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PEROXYDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PEROXYDE est dans la page 3 des mots en P du lexique du dictionnaire.
Mots en P à proximité
perméase perméat Permien peroxydase peroxydation des lipides peroxydeperoxyde d'hydrogène peroxynitrite peroxysome persicaire persistant
En rapport avec "peroxyde"

Le dioxyde est un anion de double oxyde, un composé chimique avec deux atomes d'oxygène, de formule O₂⁻ dans chaque molécule.

Le peroxyde d'hydrogène (H₂O₂) est un puissant agent oxydant, mais qui présente une faible acidité (acide dibasique) lorsqu'il est dissous dans l'eau.
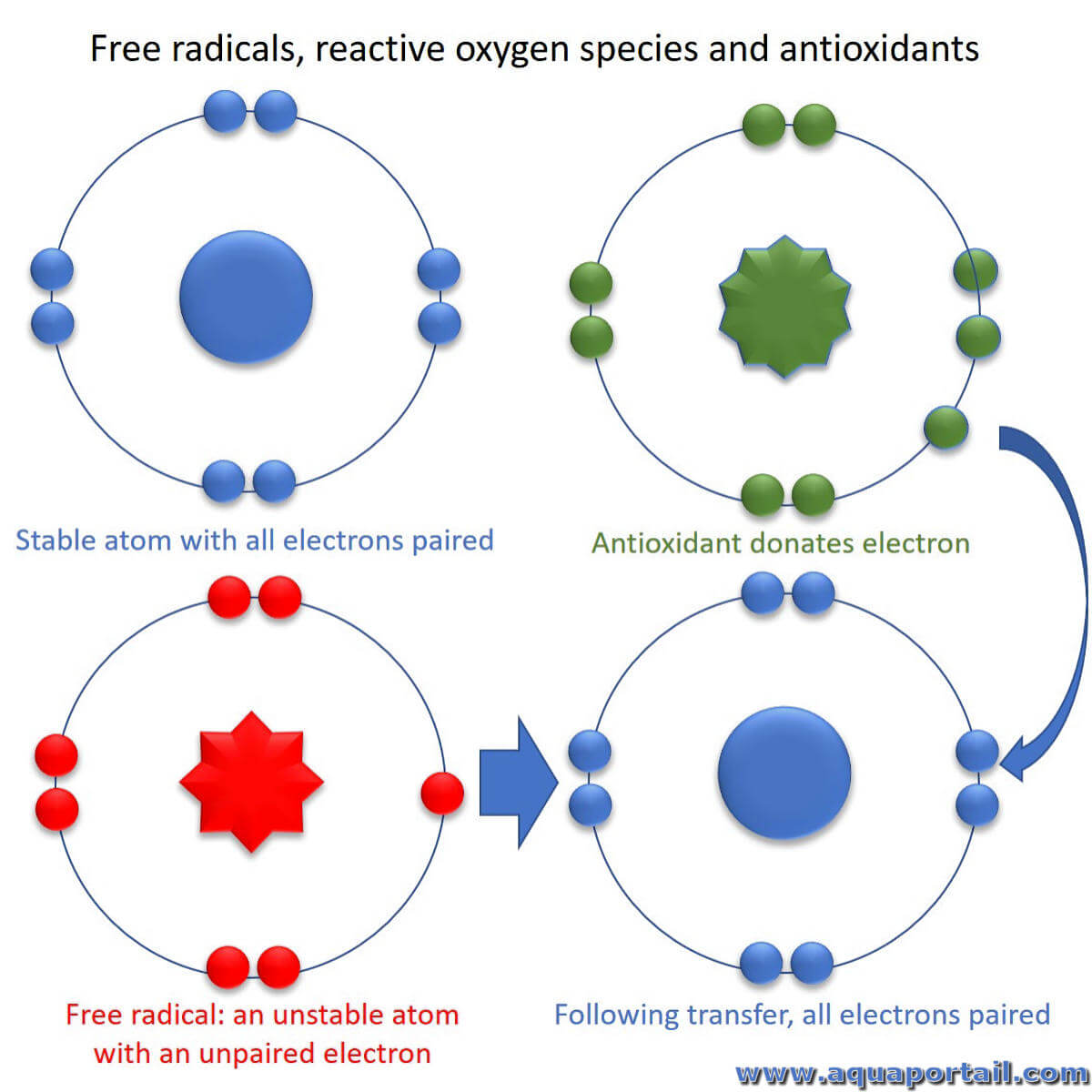
Un radical libre est un type de molécule instable qui est fabriquée au cours du métabolisme cellulaire normal avec les modifications chimiques...

Un superoxyde, ou un hyperoxyde, est un composé chimique contenant l'anion dioxyde O₂⁻• dérivé de l'oxygène.
