Tripeptide
Définition
Un tripeptide est un groupe de trois molécules d'acides aminés liées par l'élimination de l'eau et la formation de deux liaisons amide (H–N–C=O). Les tripeptides interviennent dans la régulation de l'activité fonctionnelle des cellules sanguines. Un oligopeptide est un tripeptide.
Deux tripeptides linéaires :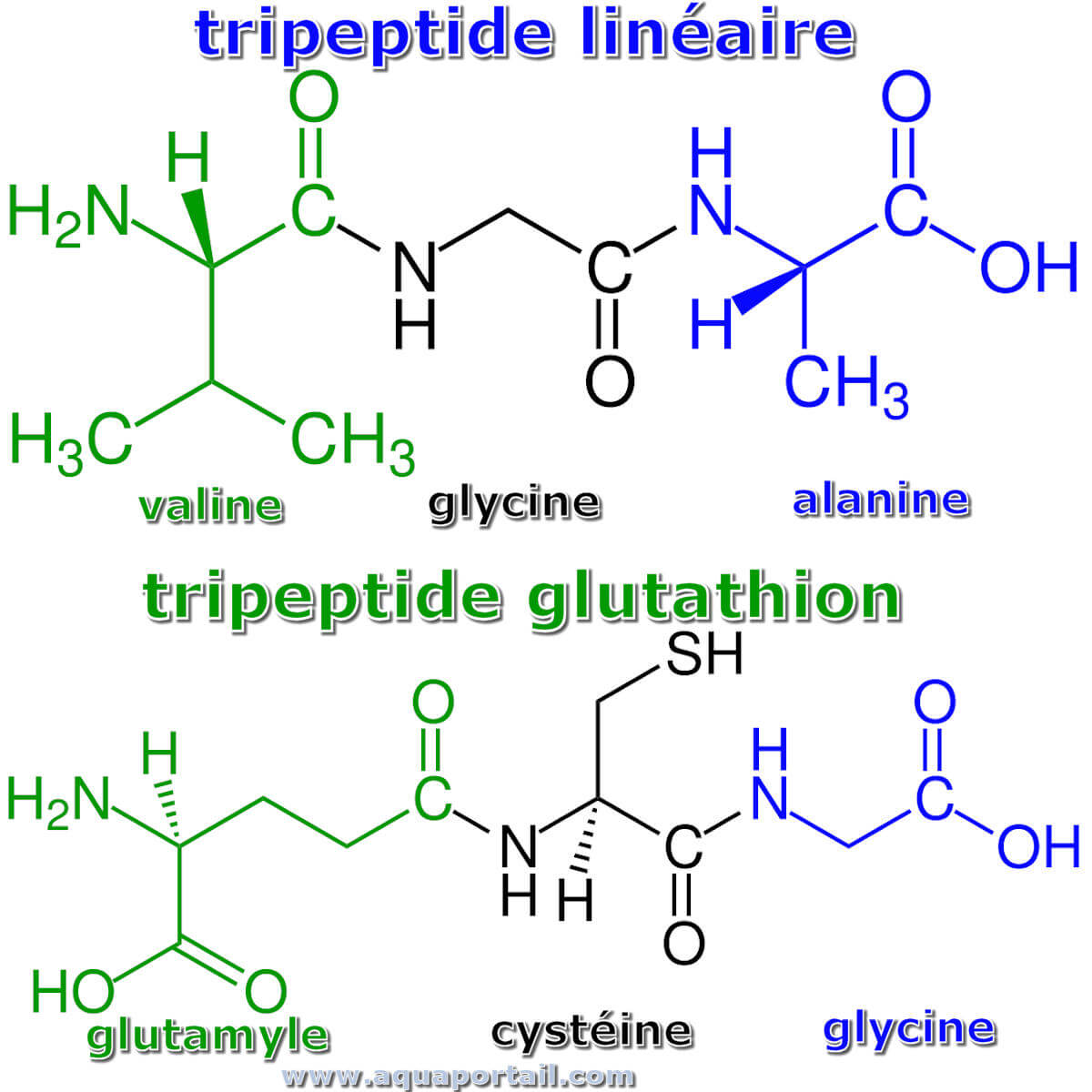
En haut, un tripeptide linéaire (tel que val-Gly-Ala) avec le résidu d'acide α-aminé N-terminal marqué en vert (L-valine) et le résidu d'acide α-aminé C-terminal marqué en bleu (L-alanine). En bas, le glutathion est un tripeptide avec le résidu γ-L-glutamyle N-terminal marqué en vert et le résidu glycyle C-terminal marqué en bleu.
Explications
L'effet des petits tripeptides (qui sont des fragments de nombreux composés naturels tels que le collagène et les neurohormones) est régulateur sur l'état d'agrégation des cellules sanguines. La structure des tripeptides est d'une importance fondamentale comme première étape pour comprendre leur rôle dans les mécanismes de formation et les fonctions biochimiques des protéines.
Les activités biologiques de dipeptides et tripeptides naturels ont des applications dans l'industrie alimentaire. Actuellement, la recherche se poursuit pour identifier de nouvelles sources de peptides bioactifs, ainsi que des méthodes de préparation, de biodisponibilité, d'activité biologique et de mécanismes d'action.
La plupart des protéines, après digestion, sont absorbées à travers les membranes luminales des cellules épithéliales intestinales sous forme de dipeptides, de tripeptides et de quelques acides aminés libres. La capacité des cellules absorbantes de l'intestin grêle à capter des dipeptides et tripeptides intacts n'a pas été appréciée pendant longtemps. Les preuves fonctionnelles de l'absorption des peptides dans l'intestin grêle provenaient à l'origine d'études in vivo de patients souffrant de défauts génétiques d'absorption des acides aminés.
Dipeptides, tripeptides et tétrapeptides
L'absorption apicale des dipeptides, tripeptides et tétrapeptides intervient via un cotransporteur piloté par H+. Pratiquement tous les produits protéiques absorbés sortent de la cellule épithéliale villeuse et pénètrent dans le sang sous forme d'acides aminés individuels. Des portions substantielles de ces acides aminés sont libérées dans la lumière de l'intestin grêle par les protéases luminales et les peptidases de la bordure en brosse et, comme nous le verrons ci-dessous, se déplacent à travers les membranes apicales des entérocytes via plusieurs systèmes de transport d'acides aminés. Cependant, des quantités importantes de protéines sont absorbées à partir de la lumière intestinale sous forme de dipeptides, de tripeptides ou de tétrapeptides, puis hydrolysées en acides aminés par des peptidases intracellulaires.
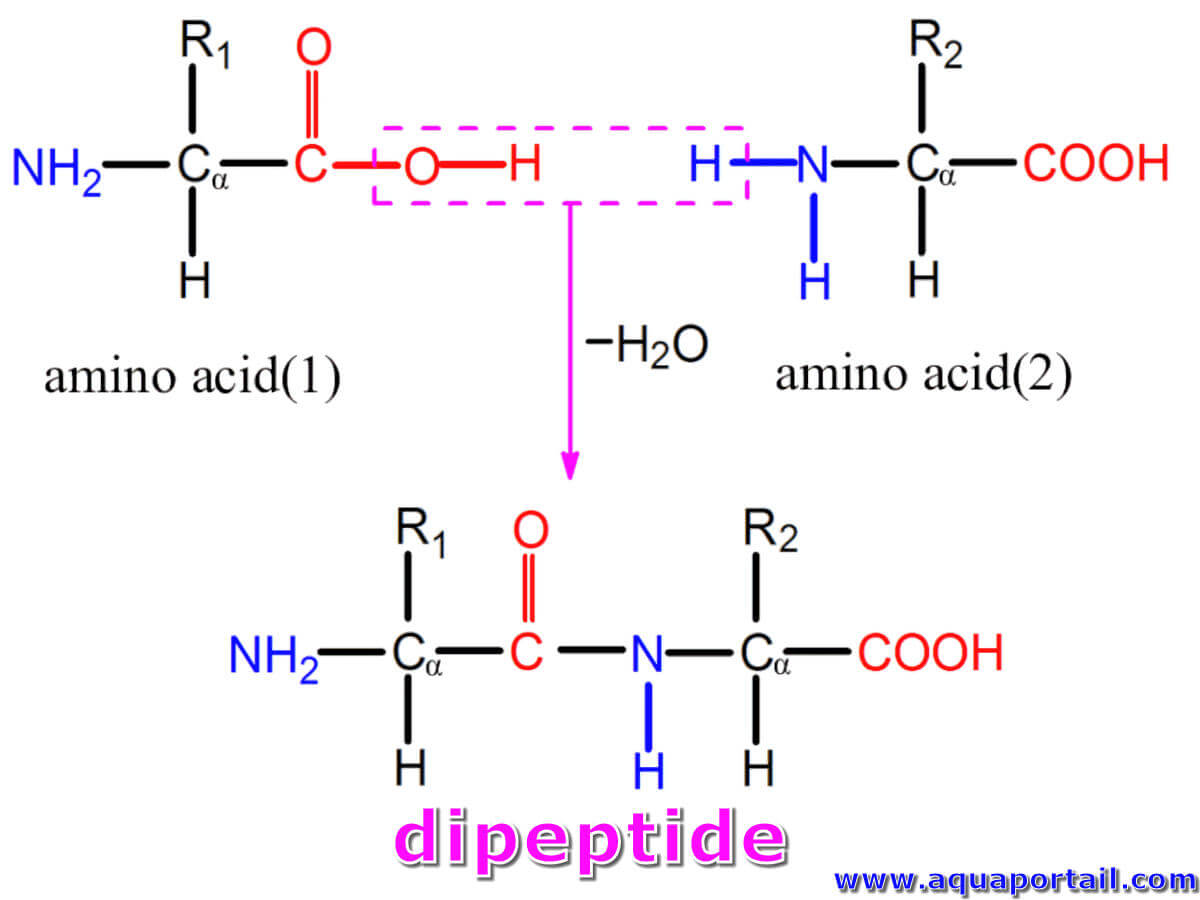
Comparaison dipeptide et tripeptide :
Comparaison des structures moléculaire d'un dipeptide et d'un tripeptide.
La preuve d'un processus de transport spécifique pour les dipeptides, les tripeptides et les tétrapeptides provient de mesures directes du transport des oligopeptides, de l'identification moléculaire du transporteur et des études des troubles héréditaires du transport des acides aminés, de la cystinurie et de la maladie de Hartnup.
Tripeptide glutathion
Le tripeptide glutathion (γ-Glu-Cys-Gly) est le thiol soluble le plus abondant dans les cellules animales. Il existe une quantité substantielle de glutathion dans la lumière intestinale, mais il ne provient pas de protéines alimentaires. Le glutathion luminal provient principalement des sécrétions biliaires.
Le tripeptide glutathion se trouve dans pratiquement tous les tissus de mammifères. Il contient un groupe thiol nucléophile réactif et l'une de ses fonctions semble être celle de piégeur de composés électrophiles nocifs ingérés ou produits par le métabolisme.
L'intérêt actuel pour le transport intestinal du glutathion découle des observations suivantes : le glutathion fonctionne comme un antioxydant important protégeant les molécules cellulaires, en particulier les lipides membranaires, des électrophiles réactifs; le glutathion est absorbé intact dans une mesure appréciable à travers l'intestin; la manipulation des niveaux de glutathion dans la lumière intestinale module les niveaux plasmatiques de ce tripeptide, et peut donc s'avérer utile dans la prévention des dommages cellulaires impliquant les radicaux libres et les lésions oxydatives; le glutathion est essentiel pour la fonction intestinale normale et pour la prévention de l'absorption des hydroperoxydes lipidiques; et les niveaux de glutathion sont diminués dans l'intestin dans des conditions pathologiques telles que la colite ulcéreuse et la maladie de Crohn.
Les caractéristiques des systèmes de transport du glutathion présents dans la bordure en brosse intestinale et les membranes basolatérales sont connues. Ces systèmes de transport sont uniques et différents des systèmes disponibles pour les petits peptides issus de protéines alimentaires. Le glutathion, bien qu'un tripeptide, contient une liaison amide qui est formée par le groupe γ-carboxyle du glutamate plutôt que par le groupe α-carboxyle. Les systèmes de transport du glutathion présents dans les deux pôles de l'entérocyte ne reconnaissent pas les dipeptides et tripeptides normaux comme substrats. De même, le système de transport intestinal des peptides n'accepte pas le glutathion comme substrat.
Les xénobiotiques qui sont conjugués au tripeptide glutathion sont soit hautement électrophiles en tant que tels, soit sont d'abord métabolisés en un produit électrophile avant la conjugaison. La toxicité peut résulter de la réaction des nucléophiles cellulaires avec les métabolites électrophiles si le glutathion n'intercepte pas d'abord ces composés réactifs.
Synonymes, antonymes
Voir tous les synonymes pour "tripeptide".1 synonyme (sens proche) de "tripeptide" :
2 antonymes (sens contraire) :
- dipeptide
- tétrapeptide
Les mots ou les expressions apparentés à TRIPEPTIDE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot TRIPEPTIDE est dans la page 4 des mots en T du lexique du dictionnaire.
Mots en T à proximité
trioïque triops Triopsidés trioxyde de soufre tripartite tripeptidetriple liaison triploblastique triploïde tripton triquètre
En rapport avec "tripeptide"
Un dipeptide est une molécule composée de deux peptides, la forme la plus simple d'un polypeptide de type oligopeptide.

Le glutathion (GSH) est un important tripeptide composé des acides aminés cystéine, acide glutamique et glycine.

La glutathion peroxydase (GPx) est un type d'enzymes antioxydantes qui protègent les cellules du stress oxydatif en convertissant les peroxydes nocifs, comme...

Un oligopeptide détient peu de peptides, mais en possède quand même, avec un faible nombre d'acides aminés.
