Peptidase
Définition
Une peptidase est une hydrolase liant les peptides, une enzyme capable de cliver des protéines ou des peptides. Les peptidases catalysent l'hydrolyse des liaisons peptidiques. Elles sont également souvent appelées protéases, protéinases ou enzymes protéolytiques, en particulier lorsque des protéines plus grosses sont clivées.
Mécanismes des peptidases et protéases :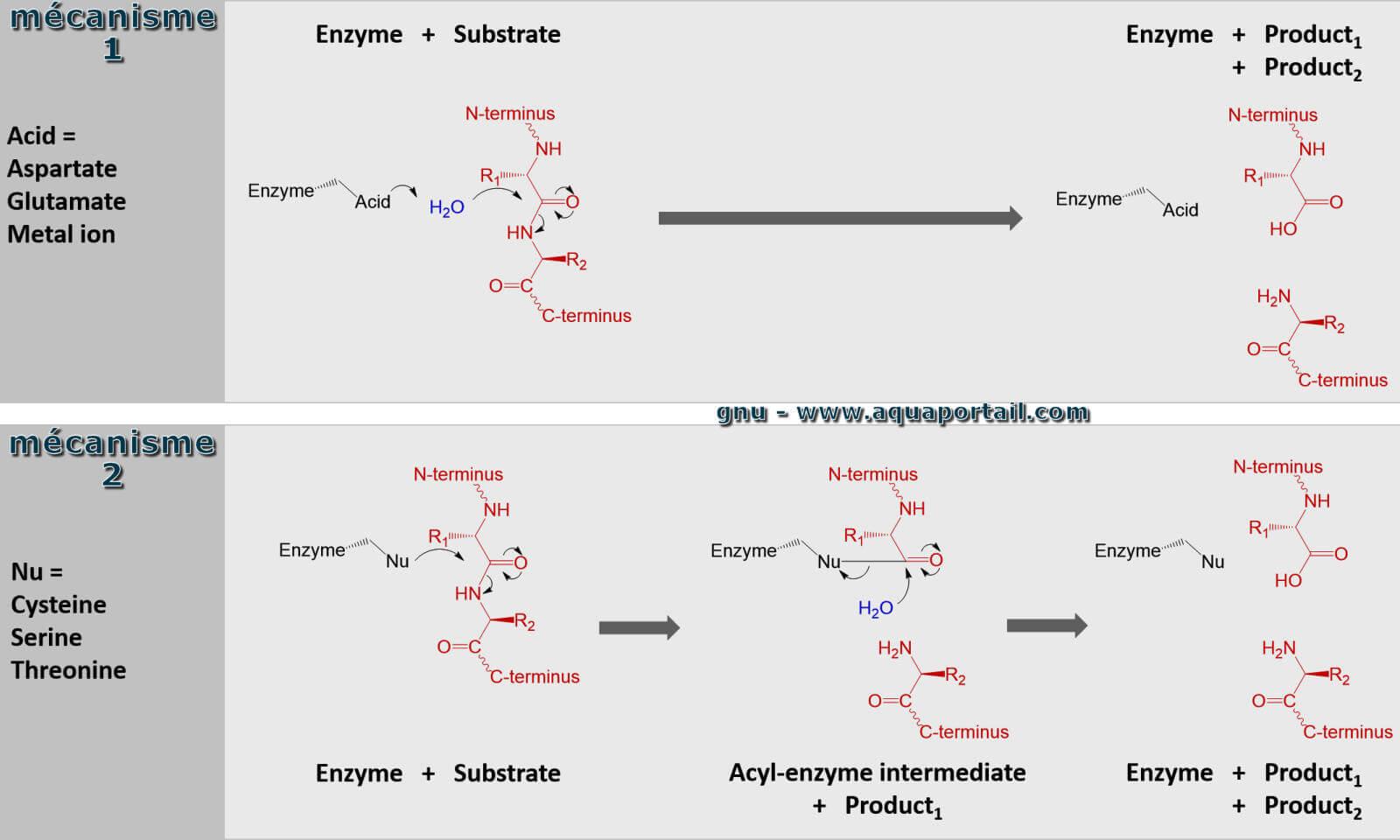
Dans une comparaison des deux mécanismes utilisés pour la protéolyse avec des peptidases-protéases, l'enzyme est représentée en noir, la protéine du substrat en rouge et l'eau en bleu. Le panneau supérieur montre l'hydrolyse en une étape lorsque l'enzyme utilise un acide pour polariser l'eau, puis hydrolyse le substrat. Le panneau inférieur montre l'hydrolyse en 2 étapes où un résidu de l'enzyme est activé pour agir en tant que nucléophile (Nu) et attaquer le substrat. Cela forme un intermédiaire où l'enzyme est liée de manière covalente à la moitié N-terminale du substrat. Dans une seconde étape, de l'eau est activée pour hydrolyser cette catalyse intermédiaire et complète. D'autres résidus d'enzymes (non représentés) donnent et acceptent des hydrogènes et stabilisent électrostatiquement l'accumulation de charge le long du mécanisme réactionnel.
Explications
Les peptidases sont omniprésentes, d. ils se trouvent dans tous les tissus et cellules de tous les organismes. On distingue les peptidases intracellulaires et extracellulaires.
Fonction
Les peptidases sont présentes dans tous les organismes et constituent 1 à 5 % du contenu du génome. Ces enzymes sont impliquées dans un grand nombre de réactions physiologiques allant de la simple digestion de protéines alimentaires à des cascades hautement régulées (par exemple : cascade de la coagulation sanguine, système du complément, voies de l'apoptose et cascade activant la profénoloxidase de l'invertébré).
Occurrences
Les peptidases intracellulaires assument une grande variété de tâches dans de nombreux compartiments cellulaires. Elles participent donc à la régulation post-traductionnelle du contenu protéique de la cellule :
- Les protéines, y compris les peptidases elles-mêmes, sont converties à l'état actif après leur production (voir biosynthèse des protéines) par clivage de fragments peptidiques (protéolyse limitée).
- Les peptidases signal clivent les peptides signal des protéines pour s'assurer que les protéines synthétisées de manière intracellulaire sont dirigées vers leur site approprié.
- Les peptidases sont impliquées dans le traitement des antigènes. Un grand complexe de peptidase à plusieurs sous-unités appelé protéasome joue un rôle important.
- Lorsque les protéines ne sont plus nécessaires ou sont endommagées, elles sont dégradées par les peptidases présentes dans les lysosomes. De plus, toutes les cellules eucaryotes possèdent un système protéolytique dépendant de l'ATP localisé dans le cytosol.
Les peptidases extracellulaires sécrétées se trouvent dans les organismes animaux, en particulier dans le tube digestif, où elles catalysent le clivage hydrolytique des aliments. Cependant, ils se retrouvent également dans d'autres fluides extracellulaires où ils effectuent parfois des tâches très spécifiques, telles que les peptidases du système de coagulation du sang, le système du complément et le système fibrinolytique.
Voir aussi les aminopeptidases, les carboxypeptidases, les endopeptidases, les exopeptidases et les entérokinases; et le système rénine-angiotensine.
Importance des peptidases dans la formation de tumeurs
Les peptidases jouent un rôle important dans la métastase des tumeurs malignes. Pour la formation de métastases de tumeurs solides malignes, il est nécessaire que les cellules tumorales migrent à travers la membrane basale constituée de protéoglycanes de collagène (type IV), de laminine et d'héparine sulfate. Les peptidases telles que les sérine protéinases, les cathepsines protéinases et les métalloprotéinases matricielles jouent un rôle essentiel dans la résolution de ce problème.
Classification
Les peptidases, selon la base de données MEROPS 1, sont classées en fonction des similitudes de leur structure tridimensionnelle. Ceux-ci incluent le Clan qui contient toutes les peptidases provenant du même ancêtre commun des peptidases. Si la structure tridimensionnelle n'est pas disponible, la classification est effectuée en fonction de l'ordre des résidus catalytiques de la chaîne peptidique et des séquences qui les flanquent :
- Sérine peptidases;
- thréonine peptidases;
- cystéine peptidases;
- Peptidases aspartiques (aspartate);
- Métallopeptidases;
- Glutamyl peptidases;
- Mélangé avec un type catalytique (sérine, cystéine, thréonine).
Un clan est formé de différentes familles de protéases qui regroupent des peptidases homologues dans leur séquence d'acides aminés. La thréonine et la glutamyle peptidase n'ont été décrites qu'en 1995 et 2004 respectivement. Le mécanisme d'action des protéases consiste en l'hydrolyse d'une liaison peptidique à l'aide des acides aminés sérine, cystéine et thréonine (dans les protéases à sérine, à la cystéine et à la thréonine) ou d'une molécule d'eau glutamyle peptidases) qui attaque le groupe carbonyle de la liaison peptidique de la protéine cible.
Inhibiteurs
Par inhibiteurs de la peptidase, des substances de bas poids moléculaire telles que la pepstatine, iodoacétate ou phénanthroline, les peptidases peuvent inhiber leur fonction.
La fonction des peptidases est inhibée par les enzymes inhibant la protéase. Des exemples d'inhibiteurs de protéase sont la classe de serpine (protéase séreuse ou peptidase dans les inhibiteurs) incorporant l'alpha 1-antitrypsine. Les autres serpines sont l'inhibiteur 1 du complément, l'antithrombine, l'alpha 1-antiquimotrypsine, l'inhibiteur 1 de l'activateur du plasminogène (coagulation, fibrinolyse) et la neuroserpine récemment découverte.
Certains virus tels que le VIH dépendent des protéases dans leur cycle de reproduction car certaines protéines virales sont codées dans une longue chaîne peptidique et sont libérées par les protéases, ne prenant alors que leur conformation et leur fonction idéales. Ainsi, les inhibiteurs de protéase sont développés en tant que milieu antiviral.
Les protéases, en tant que protéines, sont clivées par d'autres protéases, parfois de la même variété. Cela peut constituer une méthode importante de régulation de l'activité protéolytique.
Synonymes, antonymes
Voir tous les synonymes pour "peptidase".3 synonymes (sens proche) de "peptidase" :
- enzyme protéolytique
- protéase
- protéinase
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PEPTIDASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot PEPTIDASE est dans la page 2 des mots en P du lexique du dictionnaire.
Mots en P à proximité
péplomère péponide pepsine pepsinogène pepstatine peptidasepeptide peptide de transit peptide signal peptidoglycane péramorphose
En rapport avec "peptidase"
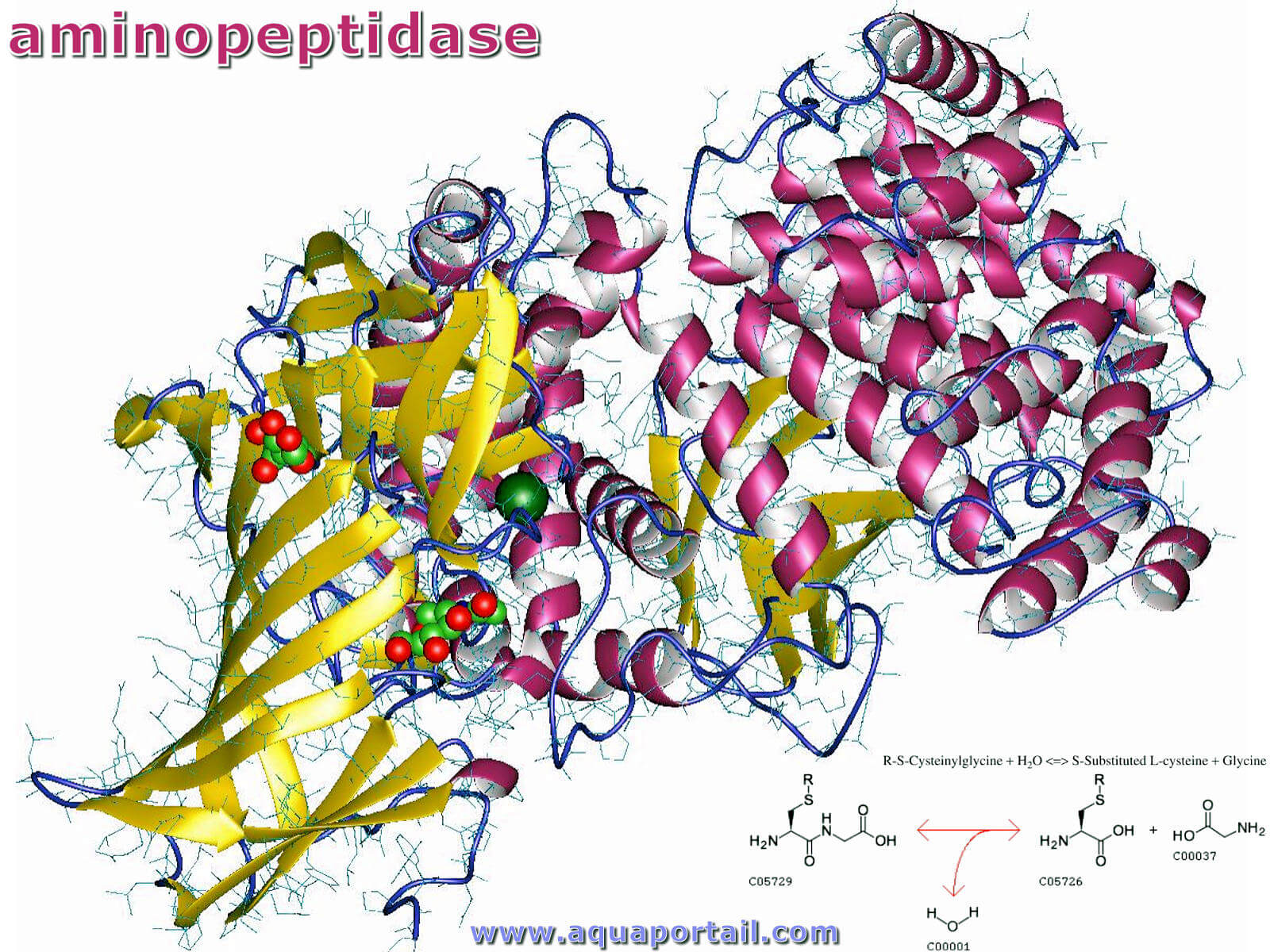
Une aminopeptidase est une peptidase, une enzyme de la bordure en brosse de l'intestin grêle qui catalyse l'hydrolyse des liaisons peptidiques de l'extrémité...

Une carboxypeptidase est une exopeptidase, une peptidase qui catalyse la dégradation des polypeptides par leur extrémité C-terminale.
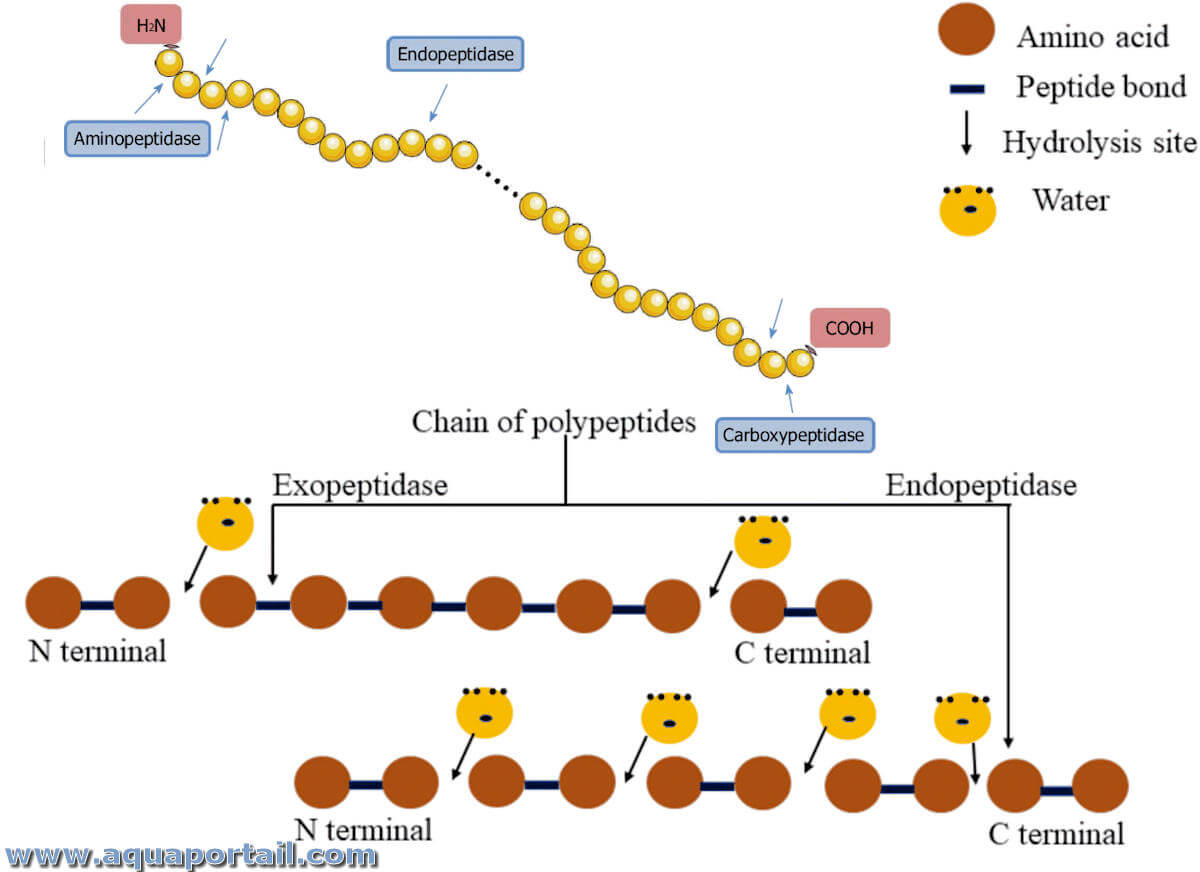
Une endopeptidase, ou une (endo)protéinase, est une forme de protéase, une peptidase à l'intérieur qui rompt les liaisons l'intérieur de la chaîne protéique.
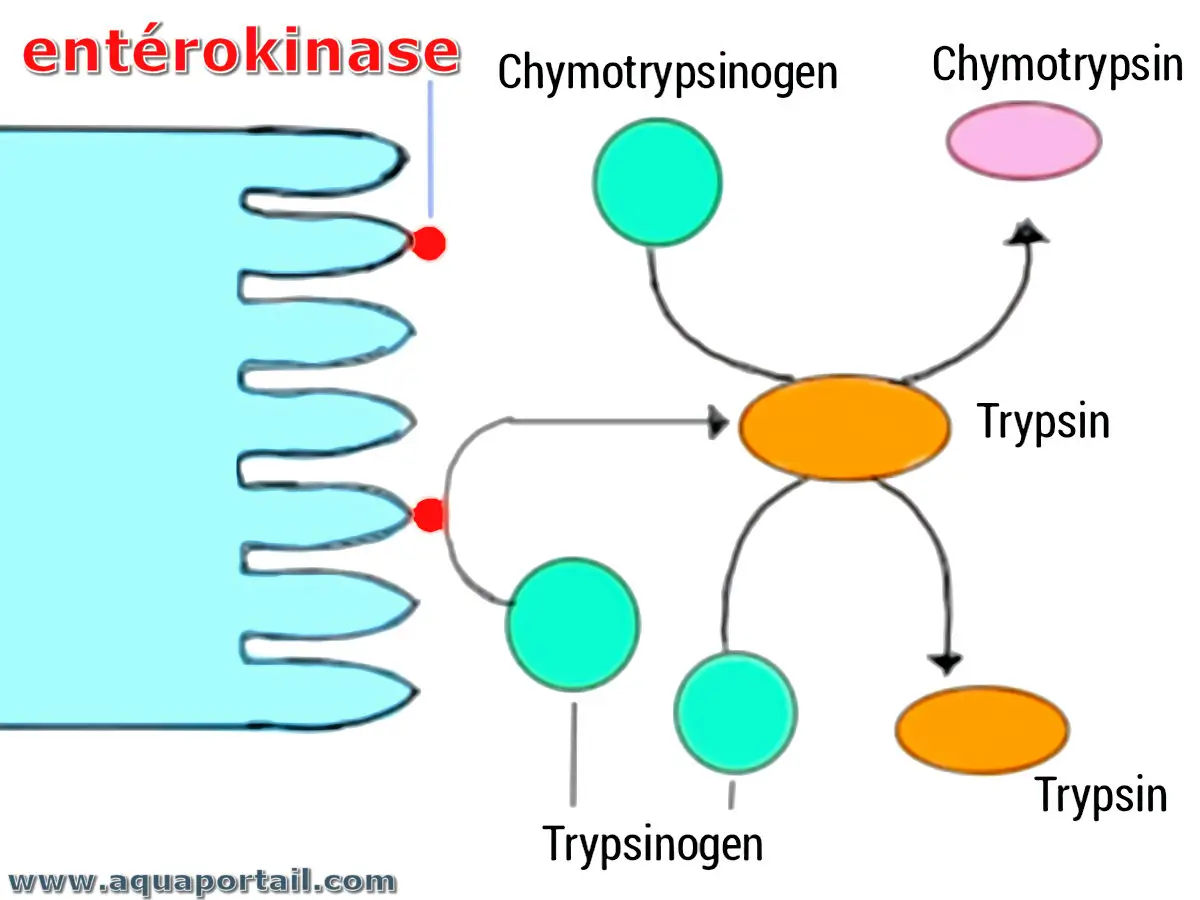
Une entérokinase, ou entéropeptidase, participe à la digestion des protéines. Elle est une enzyme dans l'intestin grêle avec un rôle de conversion...
