Aminopeptidase
Définition
Une aminopeptidase est une peptidase, une enzyme de la bordure en brosse de l'intestin grêle qui catalyse l'hydrolyse des liaisons peptidiques de l'extrémité aminée des polypeptides. Son opposé est une carboxypeptidase.
Les aminopeptidases sont un groupe d'hydrolases qui catalysent le clivage des acides aminés de l'extrémité N-terminale des peptides et des protéines
Structure de l'aminopeptidase :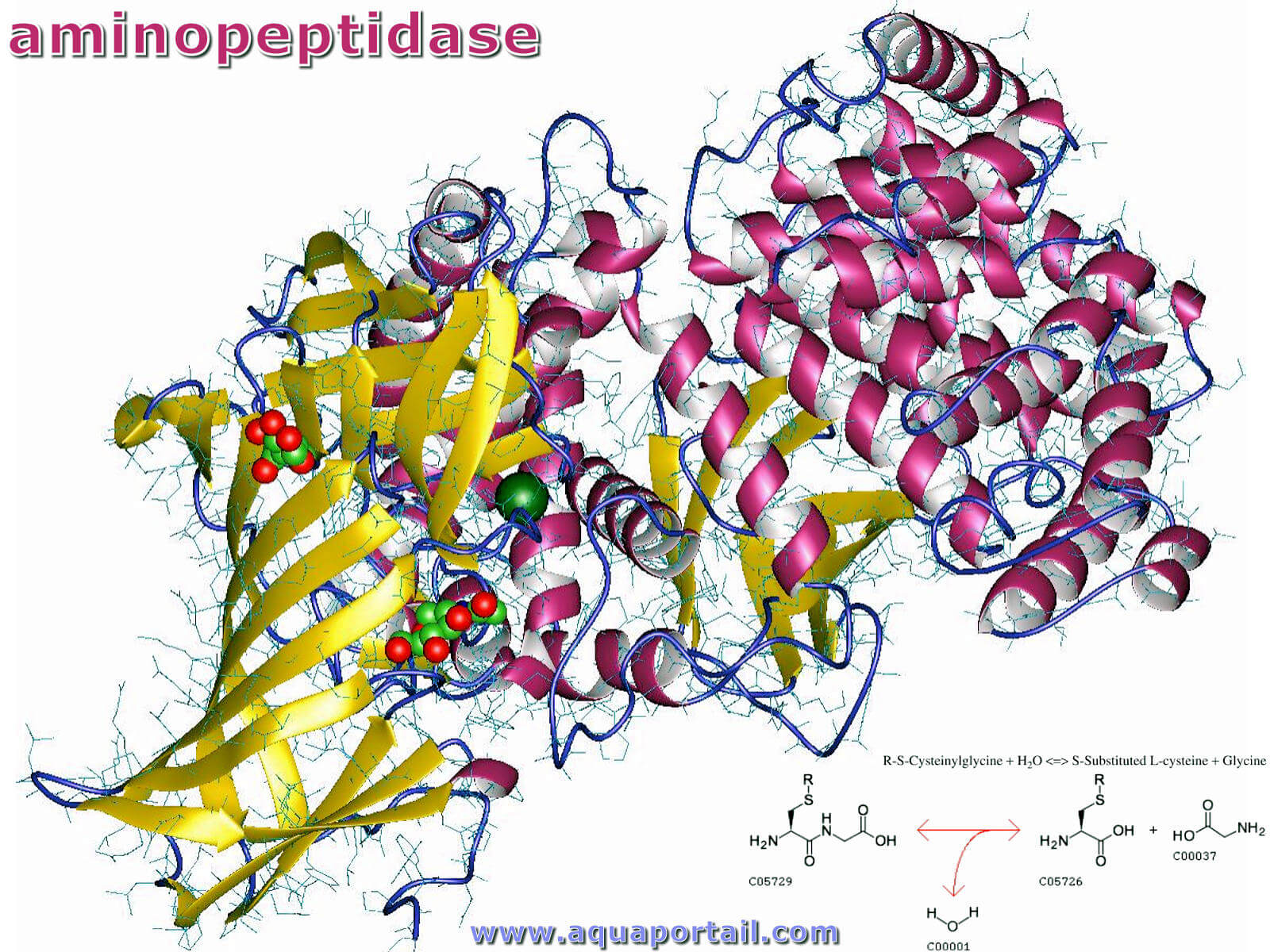
Les aminopeptidases, qui sont largement distribuées dans la nature, sont l'une des deux principales sous-classes des exopeptidases, des enzymes protéolytiques qui éliminent les acides aminés des extrémités des peptides et des protéines (l'autre étant les carboxypeptidases). Comme leur nom l'indique, les aminopeptidases attaquent leurs substrats exclusivement à partir de l'extrémité amino-terminale.
Explications
Les aminopeptidases sont des enzymes qui catalysent le clivage des acides aminés individuels de l'extrémité N- terminale d'une protéine. Les aminopeptidases se trouvent dans tous les êtres vivants. Une vingtaine d'entre eux ont été découverts chez l'homme. En plus de la maturation des protéines, ils servent également à réguler les niveaux d'hormones peptidiques et la digestion des protéines dans l'intestin dans le métabolisme humain.
Les aminopeptidases appartiennent au groupe des exopeptidases, c'est-à-dire H. les enzymes de fractionnement des protéines qui décomposent les protéines au niveau des liaisons peptidiques terminales. Dans la plupart des cas, les aminopeptidases sont des métalloprotéases. Pour tous les acides aminés naturels, il existe des aminopeptidases spécifiques qui ne les séparent qu'à l'extrémité N- terminale d'une protéine (arginine aminopeptidase, leucine aminopeptidase, etc.). Beaucoup de ces enzymes sont fermement attachées à la paroi cellulaire.
Les peptidases décomposent les protéines par hydrolyse de la liaisons peptidiques. Alors que les endopeptidases décomposent les protéines au sein de leurs molécules, les exopeptidases les décomposent du "bord moléculaire". Les aminopeptidases attaquent spécifiquement l'extrémité N-terminale ou amino-terminale des peptides et séparent ainsi un seul acide aminé (comme les aminoacyl peptide hydrolases et les iminoacyl peptide hydrolases).
L'aminopeptidase peut être utilisée dans la résolution enzymatique, cinétique de DL-amides 2-arylglycine. Lors de l'utilisation d'une L–aminopeptidase comme catalyseur, le L -2-arylglycinamide est hydrolysé énantiosélectivement en L -2-arylglycine, tandis que le D -2-arylglycinamide reste inchangé.
Voir aussi les kininases : les aminopeptidases ont deux fonctions différentes dans le métabolisme de la kinine (à ne pas confondre avec la quinine !).
Alanine aminopeptidase
L'alanine aminopeptidase est une aminopeptidase à large spécificité de substrat. Il participe à l'hydrolyse des protéines lors de la digestion. Il peut être impliqué dans la formation de calculs biliaires. Il participe à la dégradation des neurotransmetteurs dans les neurones. L'alanine aminopeptidase hydrolyse les antigènes liés au MHCII et est un marqueur de l'invasivité dans la leucémie myéloïde aiguë. Il est utilisé pour traiter les tumeurs.
De plus, c'est le récepteur cellulaire pour l'entrée pic glycoprotéine du coronavirus HCoV-229ème et impliqué dans l'entrée cellulaire du cytomégalovirus h CMV. Il est formé de nombreux types de cellules, par exemple les cellules des reins, l'intestin, des voies respiratoires, les granulocytes, les monocytes, les fibroblastes, les cellules endothéliales, péricytes sur la barrière hémato-encéphalique et sur la membrane synaptique des neurones. Avec angiogenèse, elle est de plus en plus formé par diverses cellules tumorales.
L'alanine aminopeptidase est glycosylée et sulfatée et se lie aux ions zinc. En tant qu'aminopeptidase, elle hydrolyse les peptides avec un acide aminé neutre à l'extrémité N, par exemple l'alanine. Il y a une partie cytoplasmique N- terminale, un domaine transmembranaire et extracellulaire une métalloprotéase de type II.
Aminopeptidase T
Des aminopeptidases apparentées ont été clonées à partir de T. thermophilus et B. stearothermophilus; l'ADNc code pour des protéines de 45 015 et 46 207 daltons, respectivement. Leu MCA et Phe MCA étaient de bons substrats pour ces enzymes exprimées dans E. coli. Le B. stearothermophilus aminopeptidase II (APII) n'est semblable qu'à 43 % à AP-T; cette enzyme est classée dans MEROPS comme M29.002 et doit être considérée comme une peptidase apparentée. Le produit du gène de l'aminopeptidase S (ampS) de Bacillus subtilis a été rapporté comme un membre putatif de cette famille de protéines basé sur l'homologie de ampS au gène APII. Cette protéine présente une forte similitude (53 %) avec APII.
Ainsi, la famille AP-T (AminoPeptidase T) est probablement omniprésente dans les bactéries autres que les thermophiles.
Aminopeptidase O
L'aminopeptidase O (AP-O) a été identifiée à l'origine par une recherche informatique de nouvelles aminopeptidases putatives sur la base des séquences disponibles de membres de la famille d'exopeptidases M1. Cette approche a révélé la présence d'une séquence codante putative dans le chromosome 9q22 d'une métalloprotéase encore non caractérisée. L'amplification par PCR à partir d'une bibliothèque d'ADNc cérébral a confirmé l'existence d'un fragment de 2,5 kb contenant un initiateur dans le cadre et des codons d'arrêt qui codaient pour une nouvelle protéine avec une similitude de séquence avec d'autres aminopeptidases M1.
Selon la base de données MEROPS, la famille des aminopeptidases M1 est incluse dans le clan MA (E) des gluzincines qui sont caractérisées par le motif consensus de liaison au zinc HE20HX18ème, où les deux histidines et le dernier glutamate agissent comme une liaison au zinc résidus, et le premier glutamate se comporte comme une base générale dans la catalyse. De plus, les aminopeptidases M1 ont dans leur séquence le motif consensus GXMENX, qui participe au logement du substrat et à la stabilisation de l'état de transition. La famille M1 des métalloprotéases de zinc constitue un groupe très intéressant d'enzymes qui jouent un rôle important dans la physiologie humaine et dont les altérations sont associées à plusieurs maladies humaines, dont le cancer.
Aminopeptidase PILS
L'aminopeptidase PILS (ERAP-1) est un exemple d'une enzyme identifiée d'abord par des techniques de biologie moléculaire avant de caractériser ses fonctions physiologiques. En conséquence, il existe différents noms pour l'enzyme utilisée à différents moments et dans différents contextes. Initialement, trois groupes ont rapporté indépendamment l'identification d'une nouvelle métallopeptidase dépendante du Zn par des tests de criblage d'homologie à partir d'ADNc humain et de rongeur.
Aminopeptidase Ey
L'aminopeptidase Ey est une enzyme dimère à sous-unités homologues, chacune ayant une masse moléculaire relative de 150 000 Da. Il contient 1,0 mole de zinc par mole de chaque sous-unité. La molécule d'enzyme est vue comme un dimère composé de deux sous-unités globulaires par micrographie électronique à un grossissement de 100 000 x. Le pi de l'enzyme est d'environ 2,8, comme déterminé par focalisation isoélectrique. Une forme asialo de l'enzyme, obtenue par traitement avec Arthrobacter sialidase, a un pI de 4,4.
Les études de spectres CD indiquent que l'aminopeptidase Ey nécessite du Zn2+ non seulement pour l'activité catalytique mais aussi pour la stabilisation de la conformation moléculaire. La teneur en hélice α de l'aminopeptidase native Ey a été calculée à 14 %, mais la teneur en hélice α de l'apoenzyme a considérablement diminué à 6 %; les deux formes avaient respectivement le même contenu de feuille β de 68 et 70 %. On peut supposer que la structure tertiaire de l'aminopeptidase Ey est similaire à celle des autres membres de la famille M1, mais aucun de ces éléments n'a été résolu à ce jour.
Synonymes, antonymes
Voir tous les synonymes pour "aminopeptidase".1 synonyme (sens proche) de "aminopeptidase" :
- kininase
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à AMINOPEPTIDASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot AMINOPEPTIDASE est dans la page 5 des mots en A du lexique du dictionnaire.
Mots en A à proximité
aminoacide aminoacyl-adénylate aminoacylation aminoglycoside aminoimidazole aminopeptidaseaminoside aminotransférase amitose Ammanie ammocète
En rapport avec "aminopeptidase"

Une carboxypeptidase est une exopeptidase, une peptidase qui catalyse la dégradation des polypeptides par leur extrémité C-terminale.
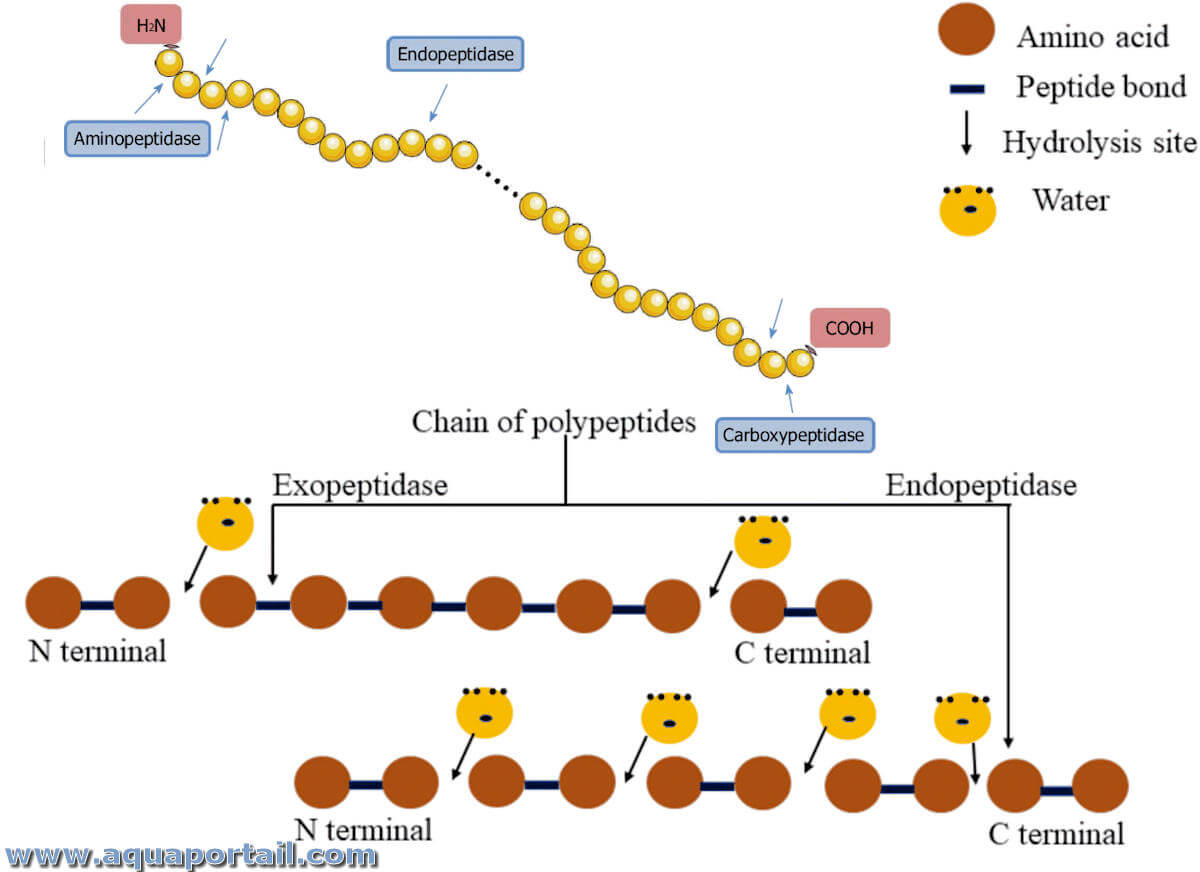
Une endopeptidase, ou une (endo)protéinase, est une forme de protéase, une peptidase à l'intérieur qui rompt les liaisons l'intérieur de la chaîne protéique.

Une exopeptidase, par opposition à une endopeptidase, appartient à une famille d'enzymes incluses dans les enzymes protéolytiques ou les peptidases.

L'enzyme gamma-glutamyltranspeptidase (GGT, gamma-GT, γ-glutamyltransférase) est présente de manière omniprésente dans toutes les formes de vie et joue divers...
