Carboxypeptidase
Définition
Une carboxypeptidase est une exopeptidase, une peptidase qui catalyse la dégradation des polypeptides par leur extrémité C-terminale. Les carboxypeptidases sont des enzymes qui catalysent le clivage hydrolytique des liaisons peptidiques à partir de l'extrémité C-terminale. Les carboxypeptidases contrastent avec les aminopeptidases, qui rompent les liaisons peptidiques mais à l'autre extrémité de la chaîne polypeptidique.
Ces enzymes sont sécrétées par le pancréas sous forme de procarboxypeptidases inactives qui sont déversées dans le duodénum où elles sont activées par l'action de la trypsine.
La carboxypeptidase A pancréatique :
(a) Représentation schématique du substrat et de l'inhibiteur se liant au site actif de la carboxypeptidase A pancréatique dérivée de données cristallographiques. (b) Le modèle hypothétique de Cushman et Ondetti du site actif de l'ACE (IEC = inhibiteur de l'enzyme de conversion) et les modes proposés de liaison au substrat et à l'inhibiteur, conduisant à la conception du captopril. Les liaisons hydrogène et les interactions ioniques sont représentées par des lignes pointillées. (c) Confirmation du modèle de Cushman et Ondetti résultant de l'élucidation de la structure cristalline des testicules humains IEC en complexe avec le captopril. Le captopril, un médicament utilisé dans le traitement de l'hypertension artérielle, est représenté en vert.
Explications
Deux représentants éponymes de ce groupe sont la carboxypeptidase A (EC 3.4.17.1, CAS 11 075–17–5) et la carboxypeptidase B (EC 3.4.17.2, CAS 9025–24–5). Les deux sont des métalloprotéases qui proviennent de leurs précurseurs (procarboxypeptidases) par la trypsine au moyen d'une protéolyse limitée et attaquent les protéines à la fin (exopeptidases). Ils sont sécrétés par le pancréas exocrine.
La carboxypeptidase A clive les acides aminés neutres et partiellement acides. La carboxypeptidase B clive les acides aminés basiques. Dans le cas d'un empoisonnement au méthotrexate, la carboxypeptidase G2 agit comme antidote en séparant le résidu d'acide glutamique.
Les animaux, y compris les humains, et les plantes contiennent différents types de carboxypeptidases qui remplissent diverses fonctions allant du catabolisme à la maturation des protéines. Chez l'homme, les carboxypeptidases A1, A2 et B sont produites dans le pancréas sous forme de proenzymes inactives et activées par l'entéropeptidase une fois qu'elles atteignent la lumière intestinale avec une sécrétion pancréatique.
Les premières carboxypeptidases étudiées ont été celles impliquées dans la digestion des aliments (carboxypeptidases pancréatiques A1, A2 et B). Cependant, la plupart des carboxypeptidases connues ne sont pas impliquées dans le catabolisme, mais aident plutôt à la maturation d'autres protéines dans un processus connu sous le nom de modification post-traductionnelle, ou participent à la régulation d'autres processus biologiques. Par exemple, dans la biosynthèse de peptides neuroendocrines tels que l'insuline. Les carboxypeptidases jouent également des rôles importants dans la coagulation, la production de facteurs de croissance, la cicatrisation des plaies, la reproduction et de nombreux autres processus.
Certaines, mais pas toutes, des carboxypeptidases sont initialement produites sous une forme inactive. Cette forme précurseur est appelée procarboxypeptidase. Dans le cas de la carboxypeptidase pancréatique A, la forme inactive (proenzyme) pro-carboxypeptidase A, est convertie en sa forme active, la carboxypeptidase A par l'action de l'enzyme entéropopeptidase. Il s'agit d'un mécanisme de sécurité qui garantit que la cellule qui produit l'enzyme elle-même n'est pas digérée par son produit.
Carboxypeptidase A
La carboxypeptidase A est normalement synthétisée sous la forme d'un zymogène qui est inactif sans élimination protéolytique de son extrémité propeptide par la trypsine.
L'IEC (inhibiteur de l'enzyme de conversion) est une dipeptidyl-carboxypeptidase de 150 à 180 kDa, qui clive les deux acides aminés terminaux du décapeptide angiotensine I (Ang I), un produit de la réaction de l'Ao et de la rénine, pour former l'octapeptide Ang II. L'IEC catalyse deux réactions censées jouer un rôle important dans la régulation de la pression artérielle avec la conversion de l'angiotensine I (décapeptide inactif) en angiotensine II (octapeptide) avec une activité vasoconstrictrice très puissante.
Les enzymes sont importantes pour un large éventail de processus physiologiques qui sont trop nombreux pour être complètement couverts ici. La carboxypeptidase A (CPD A) a été la première protéase à zinc et la deuxième enzyme à zinc découvertes.
Carboxypeptidase B
La carboxypeptidase B pancréatique a une plage de pH optimale de 7,0 à 9,0 et se clive successivement aux extrémités carboxyle des résidus basiques arginine et lysine.
Rôle des carboxypeptidases dans la digestion
Le pancréas exocrine sécrète trois endopeptidases (trypsine, chymotrypsine et élastase) et deux exopeptidases (carboxypeptidase A et carboxypeptidase B) sous des formes inactives. L'entérokinase sur la bordure en brosse commence une cascade d'activation des enzymes pancréatiques en convertissant le trypsinogène en trypsine. La trypsine activée convertit plus de trypsinogène en trypsine et active toutes les protéases pancréatiques restantes.
Les endopeptidases clivent les protéines au milieu de leurs chaînes avec spécificité. La trypsine, par exemple, clive les liaisons peptidiques dans lesquelles les acides aminés basiques (lysine et arginine) contribuent au groupe carboxyle. La chymotrypsine clive les liaisons peptidiques dans lesquelles les acides aminés aromatiques (tyrosine, phénylalanine et tryptophane) contribuent au groupe carboxyle. Les carboxypeptidases clivent des acides aminés simples des extrémités carboxyle libres des protéines. La carboxypeptidase A clive les acides aminés aromatiques ou à chaîne ramifiée; la carboxypeptidase B clive les acides aminés basiques. Le résultat final de la protéolyse pancréatique est des acides aminés libres et un mélange d'oligopeptides.
Synonymes, antonymes
Voir tous les synonymes pour "carboxypeptidase".0 synonyme (sens proche) pour "carboxypeptidase".
1 antonyme (sens contraire) :
Les mots ou les expressions apparentés à CARBOXYPEPTIDASE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CARBOXYPEPTIDASE est dans la page 2 des mots en C du lexique du dictionnaire.
Mots en C à proximité
carboxamide carboxyhémoglobine carboxylase carboxylation carboxyle carboxypeptidasecarboxysome carburant carbure de calcium carcajou carcinoculture
En rapport avec "carboxypeptidase"
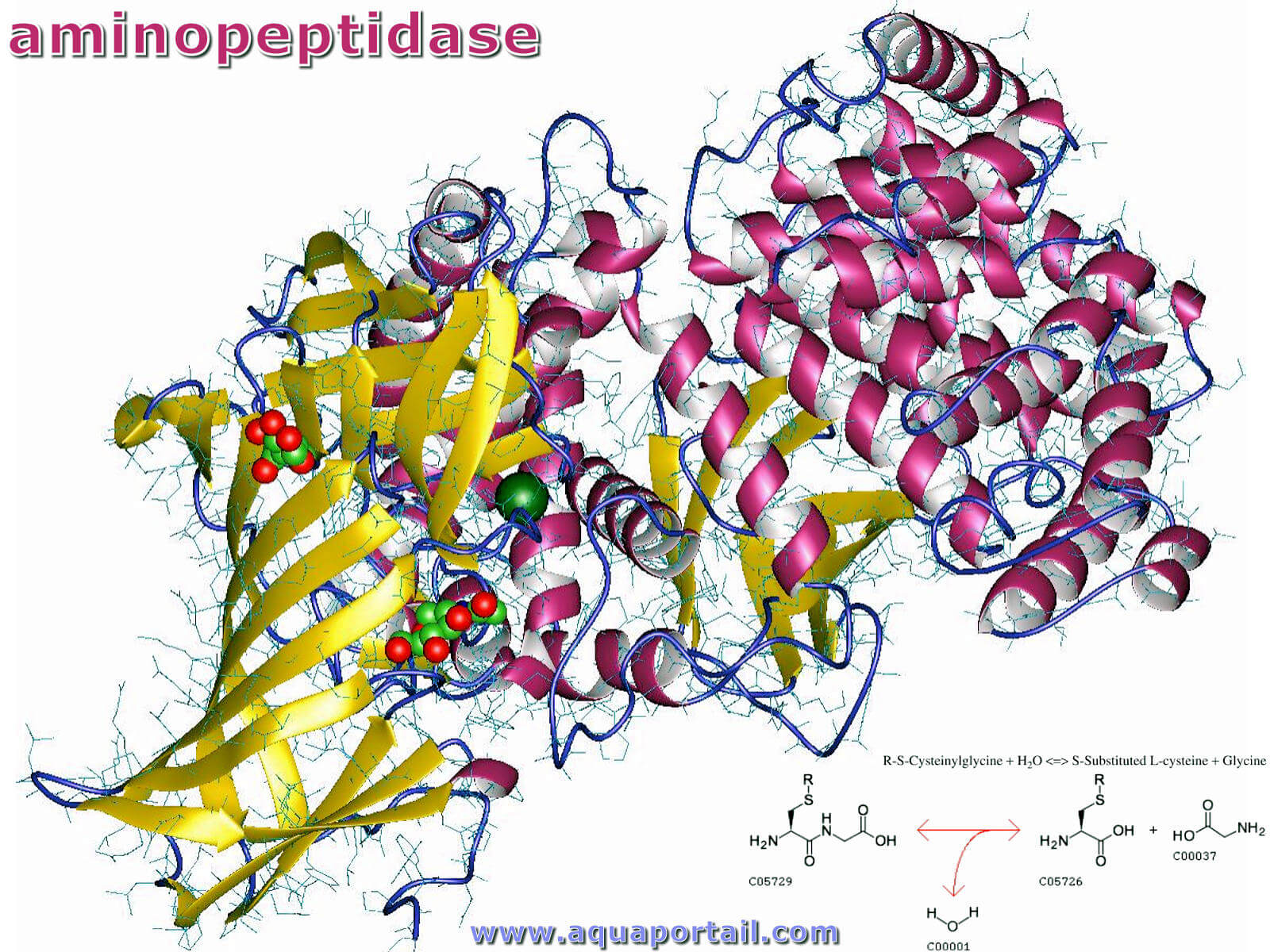
Une aminopeptidase est une peptidase, une enzyme de la bordure en brosse de l'intestin grêle qui catalyse l'hydrolyse des liaisons peptidiques de l'extrémité...
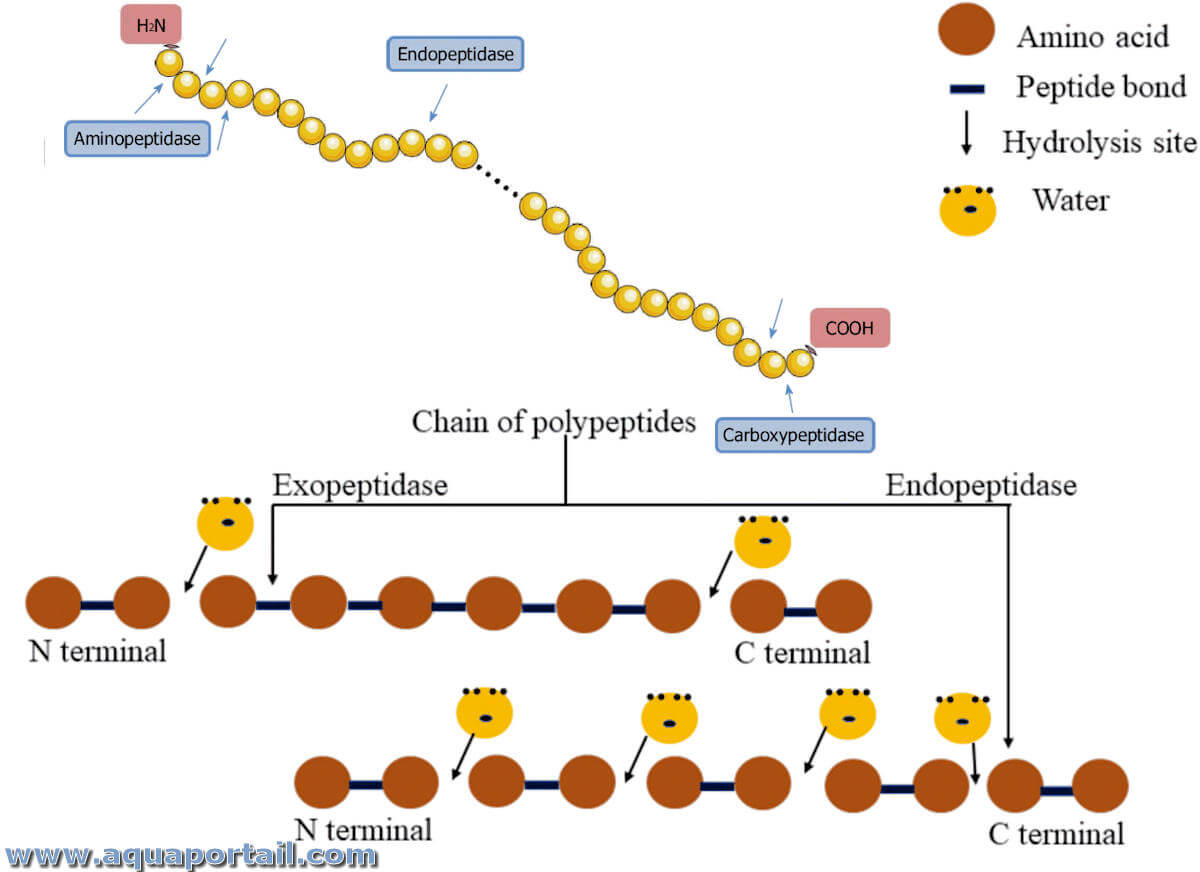
Une endopeptidase, ou une (endo)protéinase, est une forme de protéase, une peptidase à l'intérieur qui rompt les liaisons l'intérieur de la chaîne protéique.

Une exopeptidase, par opposition à une endopeptidase, appartient à une famille d'enzymes incluses dans les enzymes protéolytiques ou les peptidases.

L'enzyme gamma-glutamyltranspeptidase (GGT, gamma-GT, γ-glutamyltransférase) est présente de manière omniprésente dans toutes les formes de vie et joue divers...
