Trypsine
Définition
La trypsine est une enzyme protéolytique pancréatique, forme active du trypsinogène par perte d'un hexapeptide grâce à l'entérokinase. Cette peptidase rompt les liaisons peptidiques des protéines par hydrolyse pour former des peptides et des acides aminés plus petits. Elle active la chymotrypsinogène en trypsine et la procarboxypeptidase en carboxypeptidase.
Une molécule de trypsine :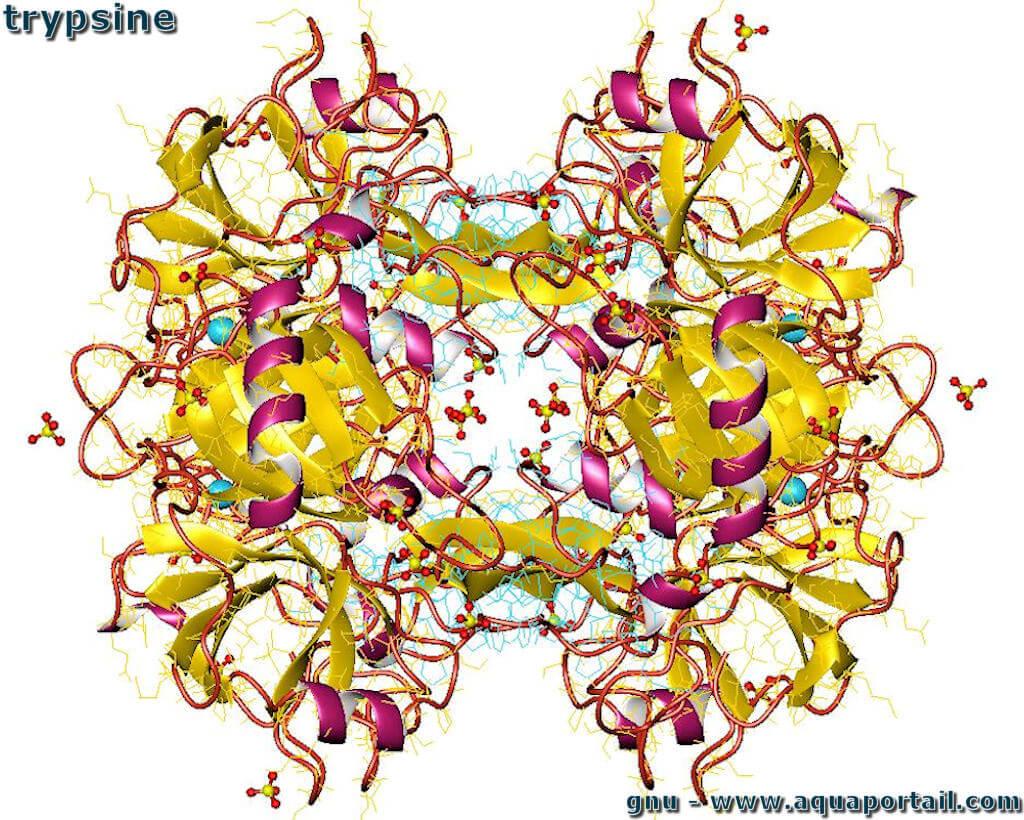
La trypsine est une enzyme dégradant les protéines, qui décompose les protéines nutritionnelles dans l'intestin grêle de l'homme et de nombreuses espèces animales.
Explications
La trypsine est produite dans le pancréas et sécrétée dans le duodénum (partie de l'intestin), où elle est essentielle à la digestion. Le pH optimal est 8 et la température optimale est 37 °C. Il s'agit d'une enzyme spécifique car elle lie le peptide aux positions carboxyle des résidus d'arginine (Arg) ou de lysine (Lys) dans la chaîne peptidique, les deux acides aminés avec des groupes R chargés positivement, fragmentant le peptide initial.
La trypsine est produite par le pancréas sous forme de trypsinogène (enzyme inactive), puis est activée dans le duodénum par l'entéropeptidase en trypsine (enzyme active) par clivage protéolytique.
La trypsine a été découverte en 1876 par le physiologiste allemand Wilhelm Kühne alors qu'il étudiait le mécanisme de la digestion. La substance a été obtenue artificiellement pour la première fois en frottant un pancréas.
Biosynthèse
Les protéases que sont la trypsine, la chymotrypsine et les carboxypeptidases sont sécrétées par le pancréas sous forme de précurseurs de zymogène inactif. L'enzyme intestinale entéropeptidase, qui est liée à l'épithélium intestinal, contrôle la conversion du trypsinogène précurseur en trypsine. La trypsine s'active (réaction positive) et convertit la chymotrypsinogène, la proélastase ainsi que la procoxypeptidase et d'autres enzymes inactives en leurs formes actives (chymotrypsine, élastase et carboxypeptidase).
Processus chimique
La trypsine est sécrétée dans le pancréas et agit dans le duodénum en hydrolysant les peptides dans ses composants structurels de base appelés acides aminés (ces peptides sont à leur tour le résultat de l'activité de l'enzyme pepsine, qui dégrade les protéines dans l'estomac). Cela est nécessaire pour le processus d'absorption des protéines présentes dans les aliments, car même si les peptides sont beaucoup plus petits que les protéines, ils sont encore trop gros pour être absorbés par la membrane intestinale. La trypsine réalise l'hydrolyse des liaisons peptidiques. Le mécanisme enzymatique est le même que celui des autres sérine protéases : une triade catalytique convertit la sérine du site actif en nucléophile. Ceci est réalisé en modifiant l'environnement électrostatique de la sérine. La réaction enzymatique catalysée par les trypsines est thermodynamiquement favorable mais présente une énergie d'activation élevée (cinétiquement défavorable). Les trypsines ont un pH de fonctionnement optimal de 8 et une température de fonctionnement optimale de 37 °C.
Le résidu d'aspartate (Asp 189) situé dans la région catalytique (S1) des trypsines a pour fonction d'attirer et de stabiliser les lysines et les arginines (chargées positivement) et est donc responsable de la spécificité de l'enzyme. Cela signifie que les trypsines coupent principalement les protéines à l'extrémité carboxylique (ou C-terminale) de leurs résidus lysine et arginine, sauf lorsque le résidu suivant est une proline. Les trypsines sont des endopeptidases, c'est-à-dire que la coupe est effectuée au milieu de la chaîne peptidique et non dans les résidus terminaux de celle-ci.
Les trypsines activées activent à leur tour davantage de trypsinogène (autocatalyse) et le reste en enzymes, de sorte que seule une petite quantité d'entéropeptidase est nécessaire pour démarrer la réaction. Ce mécanisme d'activation est très courant parmi les protéases à sérine et sert à prévenir l'autodigestion dans le pancréas.
L'activité des trypsines n'est pas affectée par l'inhibiteur phénylalanylchlorométhylcétone (TPCK), qui désactive la chymotrypsine. Ceci est important car, dans certaines applications, telles que la spectrométrie de masse, la spécificité de la coupe est importante.
Fonction biologique
La trypsine est l'une des endopeptidases qui clivent les protéines sur des sites spécifiques. La trypsine est une sérine protéase. La trypsine clive sélectivement après la liaison peptidique de la région intestinale aux acides aminés basiques lysine, arginine et également à la cystéine modifiée. Les protéinases ne sont pas spécialisées dans certaines protéines mais dans certaines séquences d'acides aminés (caractéristiques structurelles) au sein des protéines; Ceci est important pour le processus de digestion, car sinon une enzyme spécifique serait nécessaire dans le petit intestin pour chaque protéine présente.
Les endopeptidases sont des substances importantes dans le séquençage chimique et analytique des protéines. Les protéines divisées (dénaturées) sont facilement hydrolysées et se lient elles-mêmes aux molécules d'eau.
Une fonction et un effet similaires ont été libérés par la pepsine des parois de l'estomac.
La trypsine a un pH optimum de 8–8,5. Il existe une idée fausse répandue selon laquelle la trypsine a un pH optimisé pour l'intestin grêle. Cependant, le pH dans l'intestin grêle est dans la gamme acide à faiblement alcalin.
Chez l'Homme
La trypsine humaine est un mélange de trois enzymes digestives qui décomposent les protéines dans l'intestin grêle et font partie des peptidases : la trypsine-1 (trypsine cationique, deux tiers), la trypsine-2 (trypsine anionique, environ un tiers) et la trypsine-4 (mésotrypsine, un pourcentage légèrement inférieur). De nombreuses enzymes similaires chez les mammifères, les insectes, les poissons et les champignons portent également le nom de trypsine.
La carence en trypsine-1 chez l'homme entraîne une malnutrition due à un déficit en protéines. La cause peut être une mutation du gène TRY1. Une autre conséquence d'une telle mutation est la pancréatite héréditaire, dans laquelle la trypsine-1 propre à l'organisme ne peut pas être décomposée et le pancréas est digéré. La mutation sur le gène de la trypsine-2 peut contribuer à la pancréatite chronique.
Utilisations
Dans les laboratoires de culture cellulaire, la trypsine est utilisée pour dissoudre les cellules adhérentes du fond des boîtes de culture ou pour séparer les cellules. À moins que les cellules ne soient traitées à la trypsine pendant trop longtemps, elles ne seront pas endommagées et seules les protéines extracellulaires seront clivées.
En protéomique, la trypsine est la protéase la plus couramment utilisée pour générer des peptides en vue d'une analyse spectrométrique de masse, par exemple pour une digestion in-gel.
Pour l'analyse des chromosomes sous la forme d'un caryogramme, les chromosomes sont traités à la trypsine selon la technique de la bande GTG, puis colorés selon la coloration de Giemsa.
La trypsine pharmaceutique est utilisée uniquement dans les préparations combinées.
La trypsine coupe les chaînes peptidiques principalement du côté carboxyle des acides aminés lysine ou arginine, sauf si l'une ou l'autre est suivie par la proline. Il est utilisé pour de nombreux processus biotechnologiques. Le processus est couramment appelé protéolyse de la trypsine ou trypsinisation, et les protéines qui ont été digérées / traitées à la trypsine sont dites avoir été trypsinisées.
Inhibiteurs
Les inhibiteurs de la trypsine et de la chymotrypsine sont présents dans les légumineuses (notamment la pectine); dans le soja, connu sous le nom d'inhibiteurs de protéase, qui peuvent être en grande partie éliminés par la cuisson à haute température; et dans les pommes de terre dans lesquelles la solanine est un inhibiteur de l'acétylcholinestérase et de la trypsine, avec une action réduite et sans risque en utilisation courante.
Réaction de détection
L'activité de la trypsine peut être détectée par le N-benzoyl-D, la L–arginine p-nitroanilide (BAPNA). Le BAPNA est clivé par la trypsine d'arginine pour donner de la p-nitroaniline. La concentration croissante en p-nitroaniline qui en résulte peut être surveillée par spectroscopie à une longueur d'onde de 405 nm.
Synonymes, antonymes
Voir tous les synonymes pour "trypsine".0 synonyme (sens proche) pour "trypsine".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à TRYPSINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot TRYPSINE est dans la page 4 des mots en T du lexique du dictionnaire.
Mots en T à proximité
truiticulture truxale trypanophobie trypanosome trypophobie trypsinetrypsinogène tryptase tryptophane tsunami tube ambulacraire
En rapport avec "trypsine"
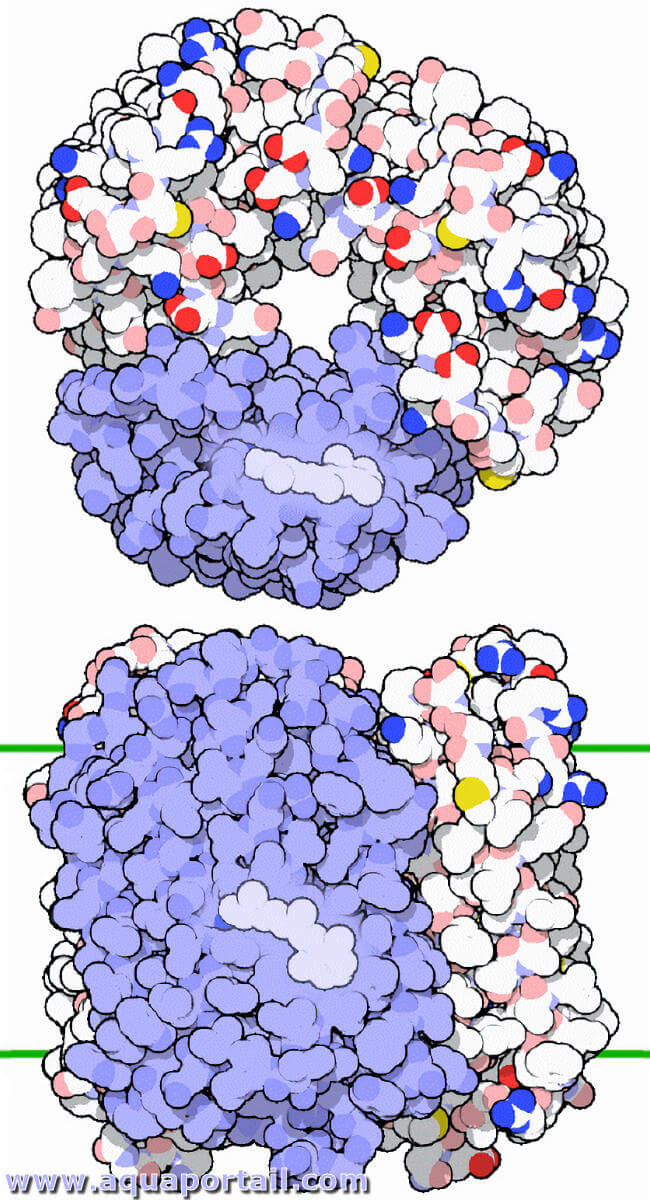
La bactériorhodopsine (ou protéorhodopsine) est un pigment des archéobactéries photosynthétiques extrêmes halophiles.
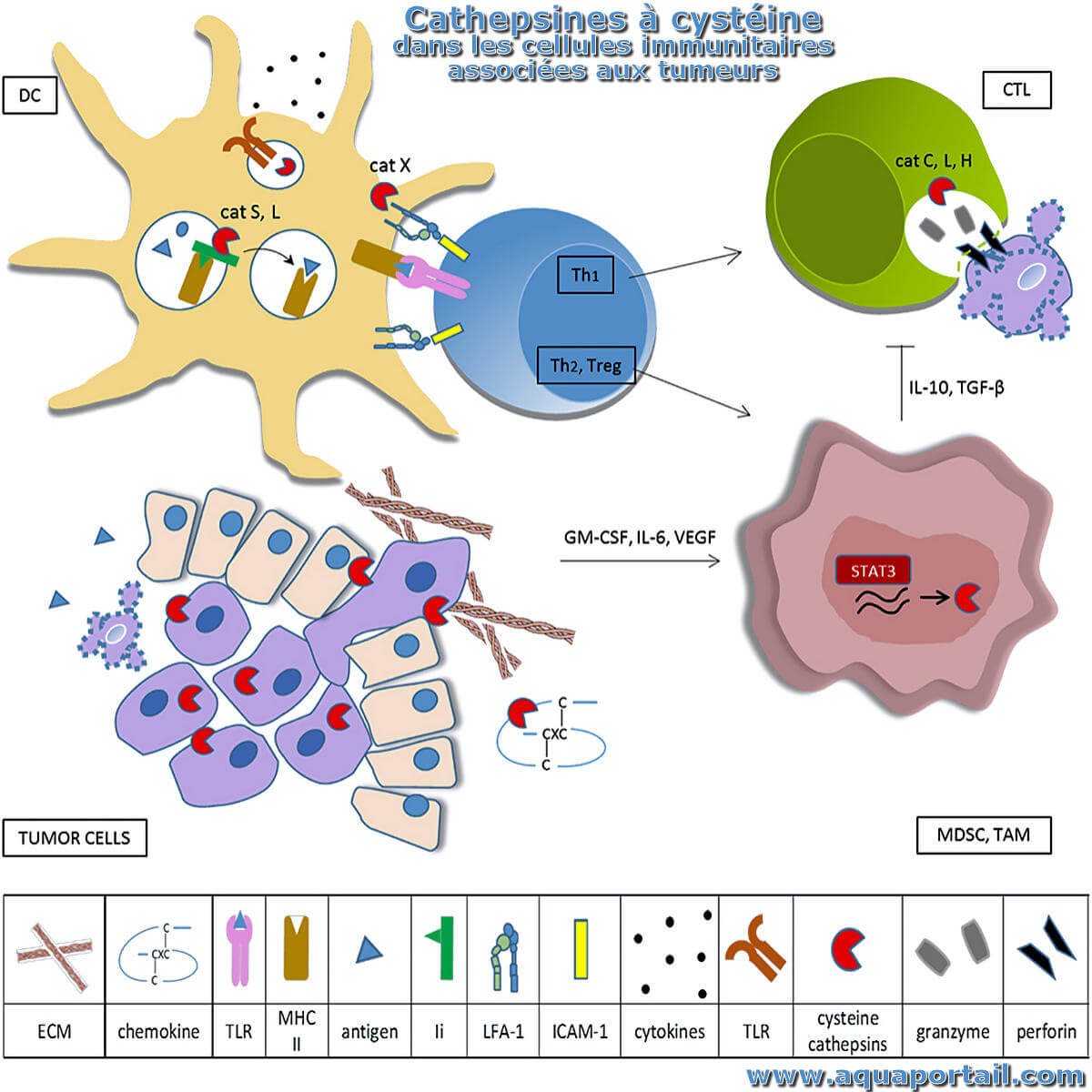
La cathepsine est une protéase lysosomale des cellules animales existant sous de nombreuses formes.
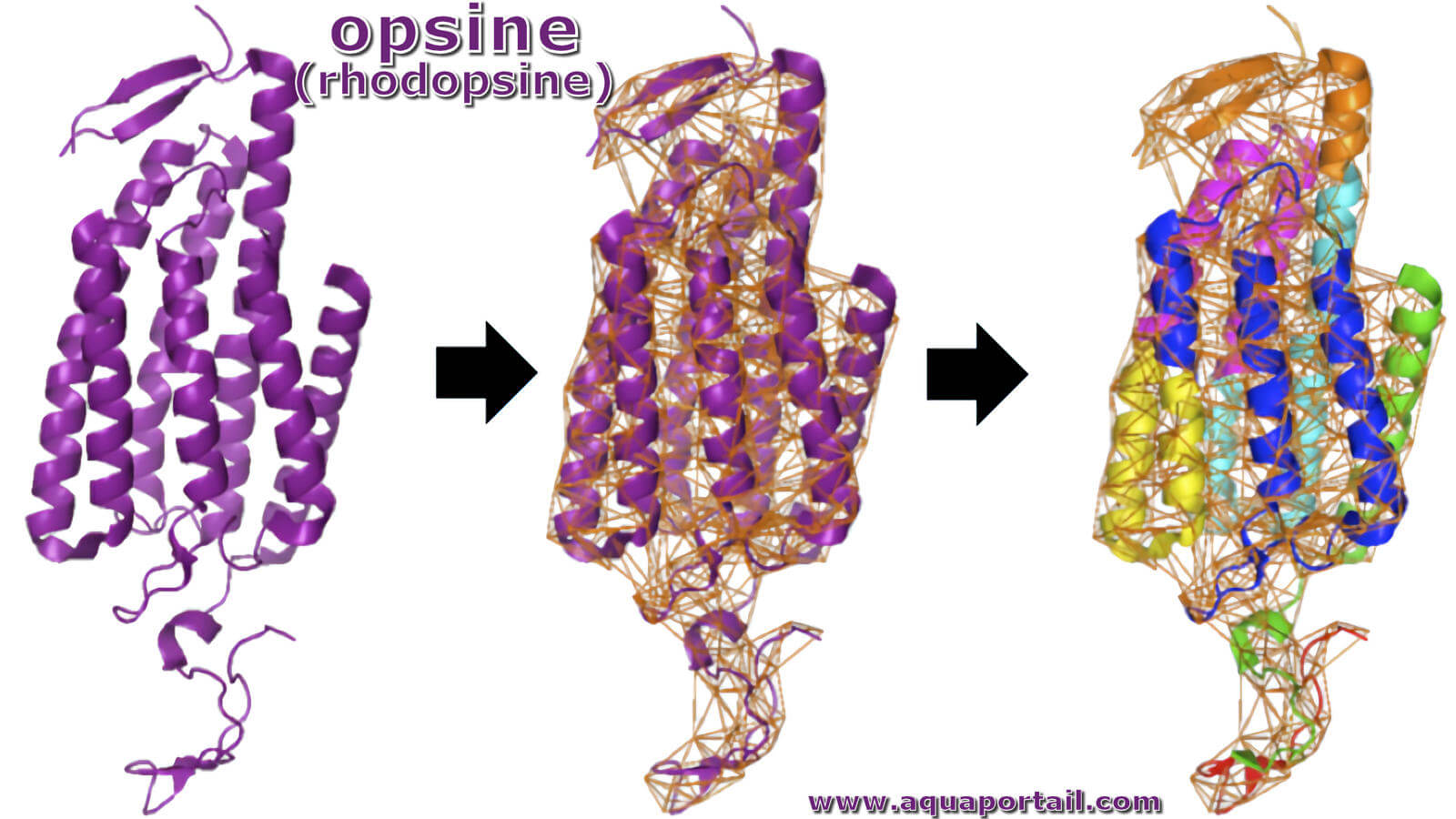
L'opsine est une glycoprotéine des disques des photorécepteurs à 7 domaines transmembanaires qui se lie au 11-cis-rétinal pour former la rhodopsine...
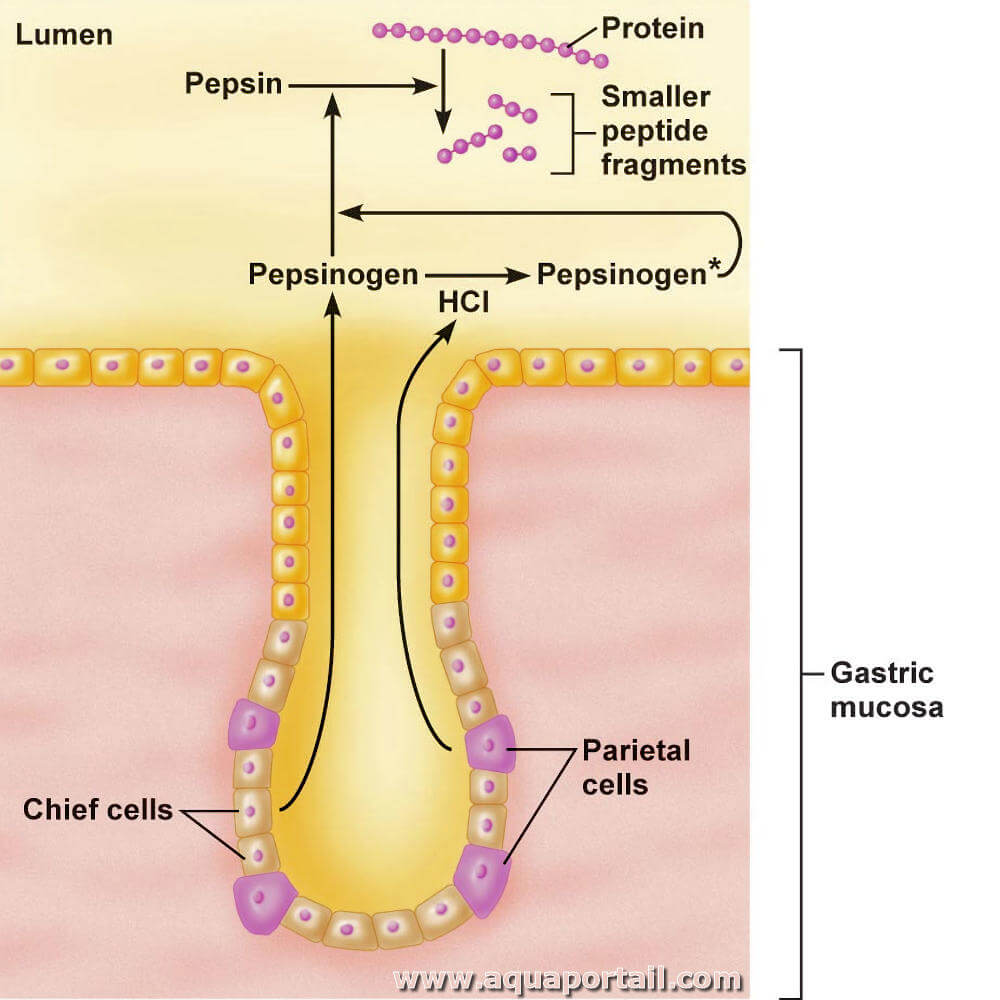
La pepsine est une enzyme digestive qui est créé dans l'estomac et hydrolyse les protéines dans l'estomac.
