Cathepsine
Définition
La cathepsine est une protéase lysosomale des cellules animales existant sous de nombreuses formes. Les cathepsines sont des régulateurs clés du système immunitaire inné et adaptatif. Elles se trouvent, dans les lysosomes, les granulocytes éosinophiles et les ostéoclastes.
Les cathepsines sont des endoprotéases qui provoquent une dégradation hydrolytique (protéolyse) de la matrice extracellulaire et de la membrane basale. En effet, les protéases sont des enzymes qui divisent les protéines.
Des cathepsines à cystéine :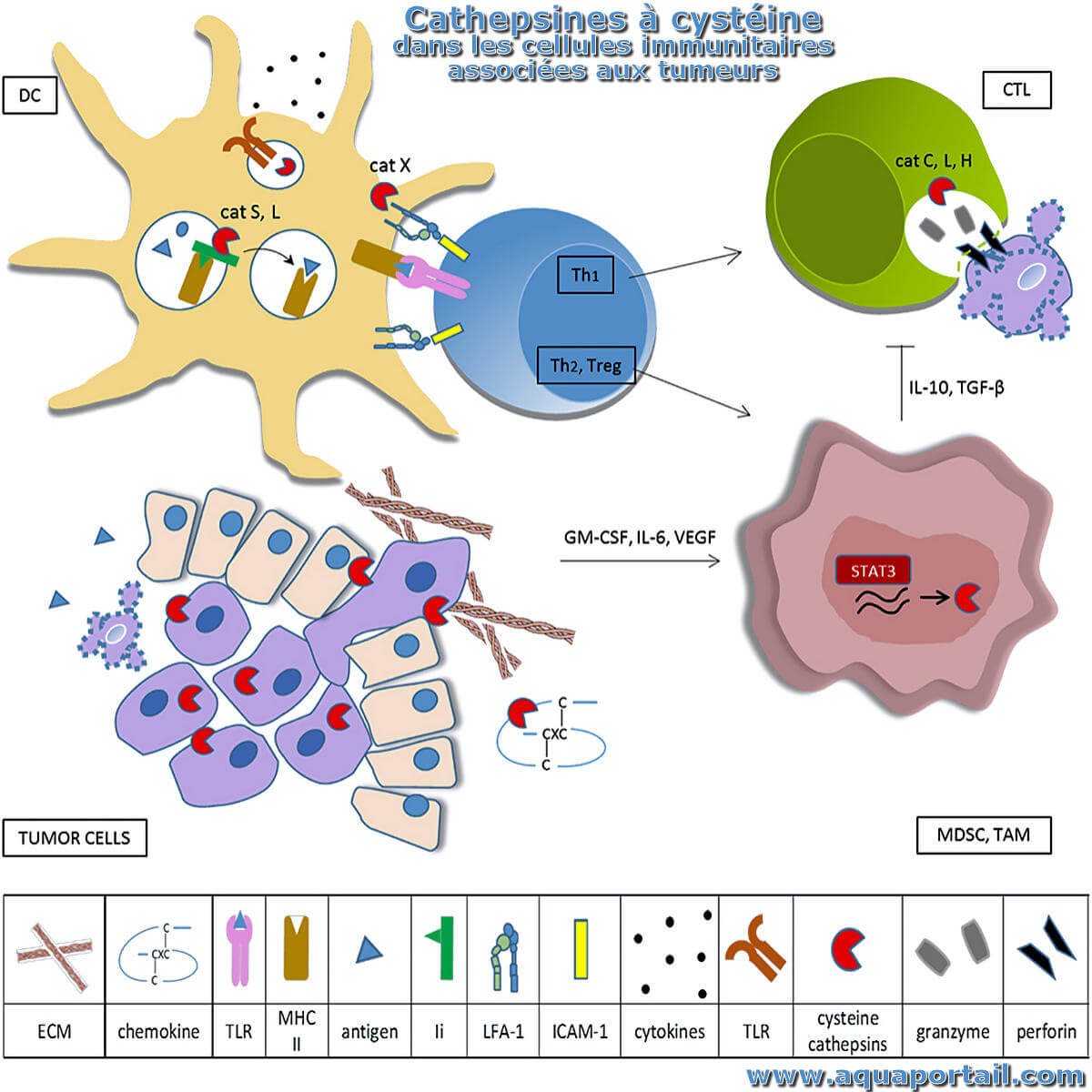
Les cathepsines à cystéine sont des régulateurs clés du système immunitaire inné et adaptatif.
Explications
Les cathepsines sont des protéases qui peuvent cliver des protéines cibles critiques et sont libérées des lysosomes et sont impliquées dans l'apparition de la cytotoxicité.
Les cathepsines (CTS) sont des protéases présentes chez tous les animaux ainsi que chez d'autres organismes. La plupart des cathepsines sont des endopeptidases, à l'exception des cathepsines C et Z.
Le terme cathepsine comprend les sérine protéases, les protéases aspartiques et les protéases cystéine.
Les cathepsines sont une famille étendue de protéases à cystéine qui ont une large activité protéolytique, y compris une activité sur le collagène et les protéoglycanes de types II, IX et XI. Comme les MMP, les cathepsines sont régulées par des cytokines et par des proto-oncogènes tels que Ras. L'IL-1 et le TNF induisent l'expression de la cathepsine L dans les FLS en culture.
Fonctionnement
Les protéases clivent sélectivement les protéines en coupant les liaisons peptidiques qui lient des acides aminés spécifiques. Elles font partie d'une famille d'enzymes plus large appelée protéases, qui sont des cibles thérapeutiques bien connues. Bien que leurs activités soient optimales dans des conditions acides et réductrices lysosomales, les cathepsines peuvent contribuer de manière significative à la dégradation de la matrice extracellulaire.
Les cathepsines ne fonctionnent qu'à pH très acide et participent à l'autolyse apoptotique et à la digestion intracellulaire. Certains peptides cyclisés via des ponts disulfures ont un effet inhibiteur potentiel sur les cathepsines humaines L, B, H et K.
Toutes les cathepsines à peptide cystéine sont exprimées sous forme de polypeptides consistant en une séquence signal, un propeptide et un domaine catalytique. Le peptide signal est clivé au site de la translocation dans le réticulum endoplasmique. Le propeptide est clivé dans l'environnement de plus en plus acide du système endosomal/lysosomal, ce qui donne un domaine catalytique entièrement actif des cathepsines.
Rôle
Les cathepsines sont impliquées dans la dégradation des organites cellulaires, comme les mitochondries obsolètes ou la matrice osseuse contenant du collagène. Elles sont probablement également impliquées dans l'angiogenèse, c'est-à-dire la formation de nouveaux vaisseaux sanguins dans le cadre de la cicatrisation des plaies et dans le contexte de la croissance tumorale invasive.
La fonction principale des cathepsines est le recyclage des protéines dans le lysosome, mais elles sont également connues pour être impliquées dans une gamme d'autres processus physiologiques et pathologiques, y compris la maturation du complexe CMH de classe II, le remodelage osseux, la différenciation des kératinocytes, la progression tumorale et métastases, polyarthrite rhumatoïde, arthrose et athérosclérose.
Les cathepsines peuvent être prouvées comme un marqueur pronostique défavorable dans diverses tumeurs telles que le carcinome pancréatique.
Liste des cathepsines
Les cathepsines sont distinguées en 3 groupes principaux (notamment pour les réactifs de recherche de clones d'ADNc) :
- Cathepsines d'aspartyle :
- Cathepsine D;
- Cathepsine E.
- Cathepsines sérine :
- Cathepsine A;
- Cathepsine G.
- Cathepsines cystéine :
- Cathepsine B;
- Cathepsine C;
- Cathepsine H;
- Cathepsine J;
- Cathepsine K;
- Cathepsine L;
- Cathepsine L1;
- Cathepsine O;
- Cathepsine Q-like 2;
- Cathepsine R;
- Cathepsine S;
- Cathepsine V;
- Cathepsine W;
- Cathepsine Z.
Histoire
La molécule de cathepsine a été découverte en 1929 par Richard Willstätter (1872–1942, chimiste allemand) après les travaux de Eugen Baumann (1846–1896, pharmacien, chimiste et biochimiste allemand).
Cathepsine K
La cathepsine K est impliquée dans la résorption osseuse par les ostéoclastes. Cette protéase est unique parmi les cathepsines car elle peut dégrader le collagène de type I natif. Il est exprimé dans le tissu synovial de la PR par les macrophages et les fibroblastes et est présent à des concentrations significativement plus élevées que dans l'arthrose. Les taux sériques de cathepsine K sont en corrélation avec l'étendue des dommages radiographiques.
Un rôle potentiel des cathepsines en tant que médiateurs de la destruction osseuse dans l'arthrite a été confirmé dans des études dans lesquelles les inhibiteurs de la cystéine protéase diminuent de manière significative les lésions articulaires dans les modèles d'arthrite de rongeur. Dans le modèle murin transgénique TNF, le déficit en cathepsine K a diminué, mais n'a pas éliminé, les érosions osseuses.
Synonymes, antonymes
Voir tous les synonymes pour "cathepsine".0 synonyme (sens proche) pour "cathepsine".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à CATHEPSINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot CATHEPSINE est dans la page 3 des mots en C du lexique du dictionnaire.
Mots en C à proximité
caténation caténé caténine caténulé cathéméral cathepsinecathinone catinage cation cationique caudal
En rapport avec "cathepsine"
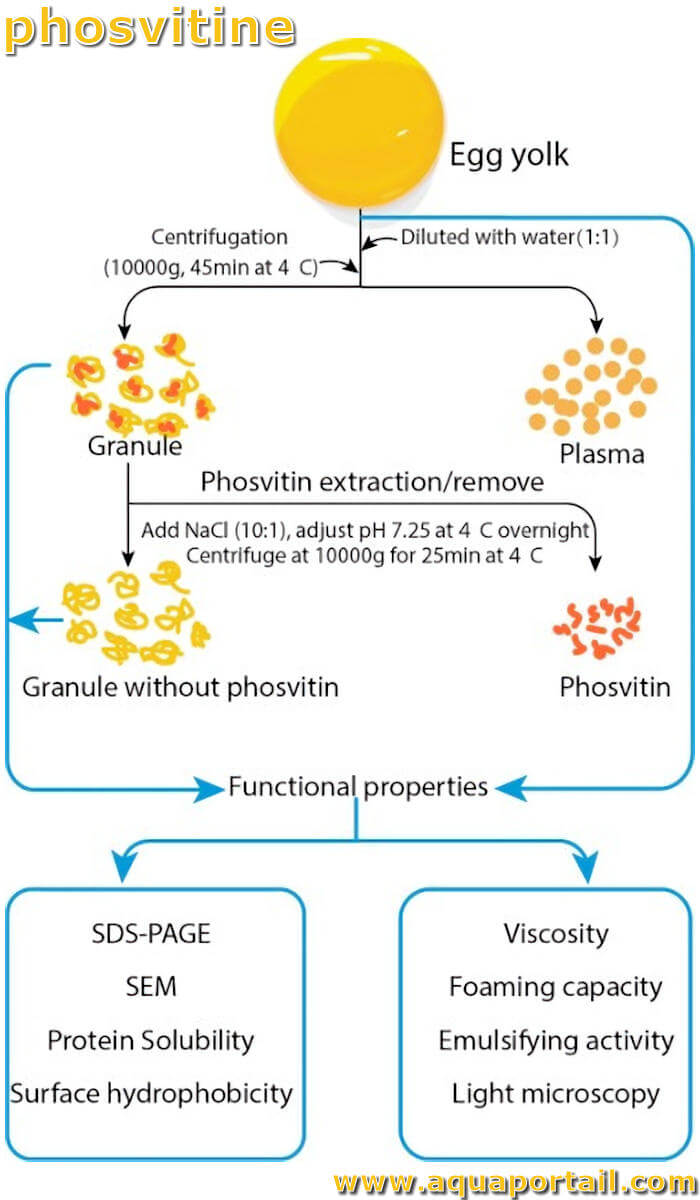
La phosvitine est une phosphoprotéine du jaune d'oeuf. La phosvitine, qui est régulée par le foie, contient environ 110 résidus de phosphosérine...
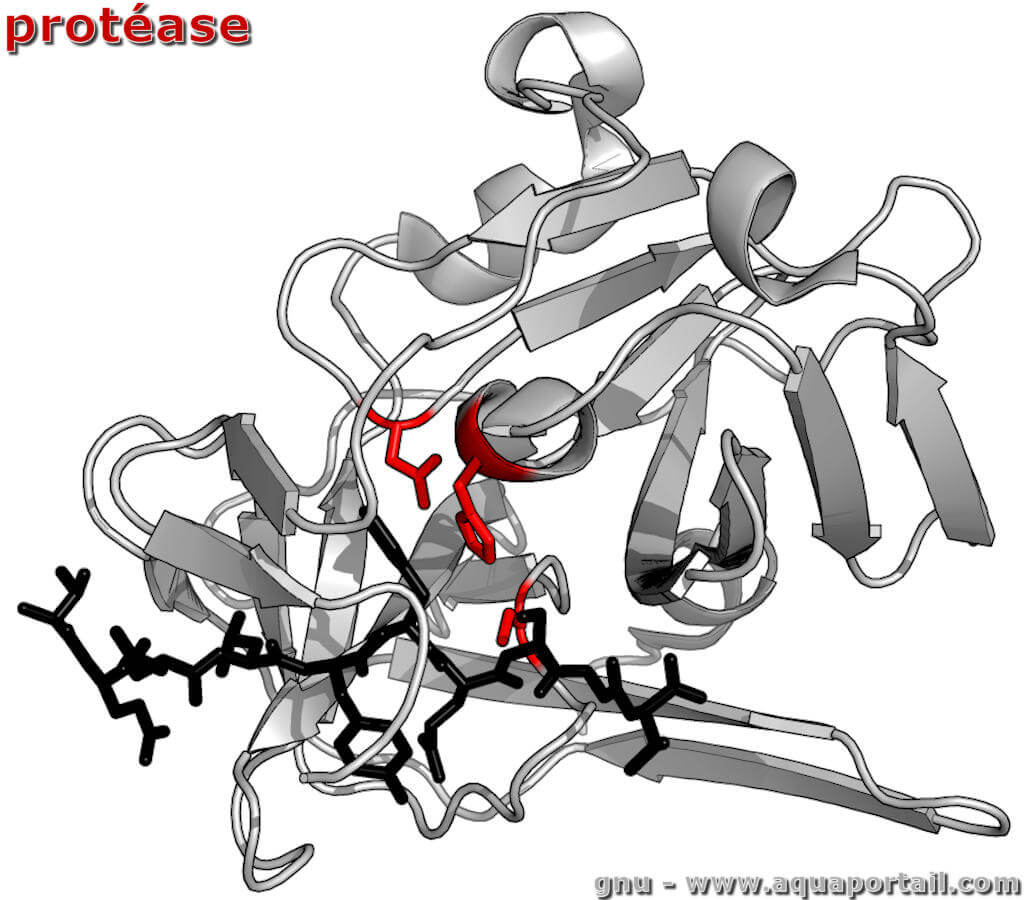
Une protéase est une peptidase, une enzyme protéolytique qui coupe une liaison peptidique au sein d'une séquence protéique, mais pas aux extrémités.

La sérine protéase compose une famille d'enzymes protéolytiques (protéases) présentant une homologie de 40 % dans leurs séquences d'acides aminés.
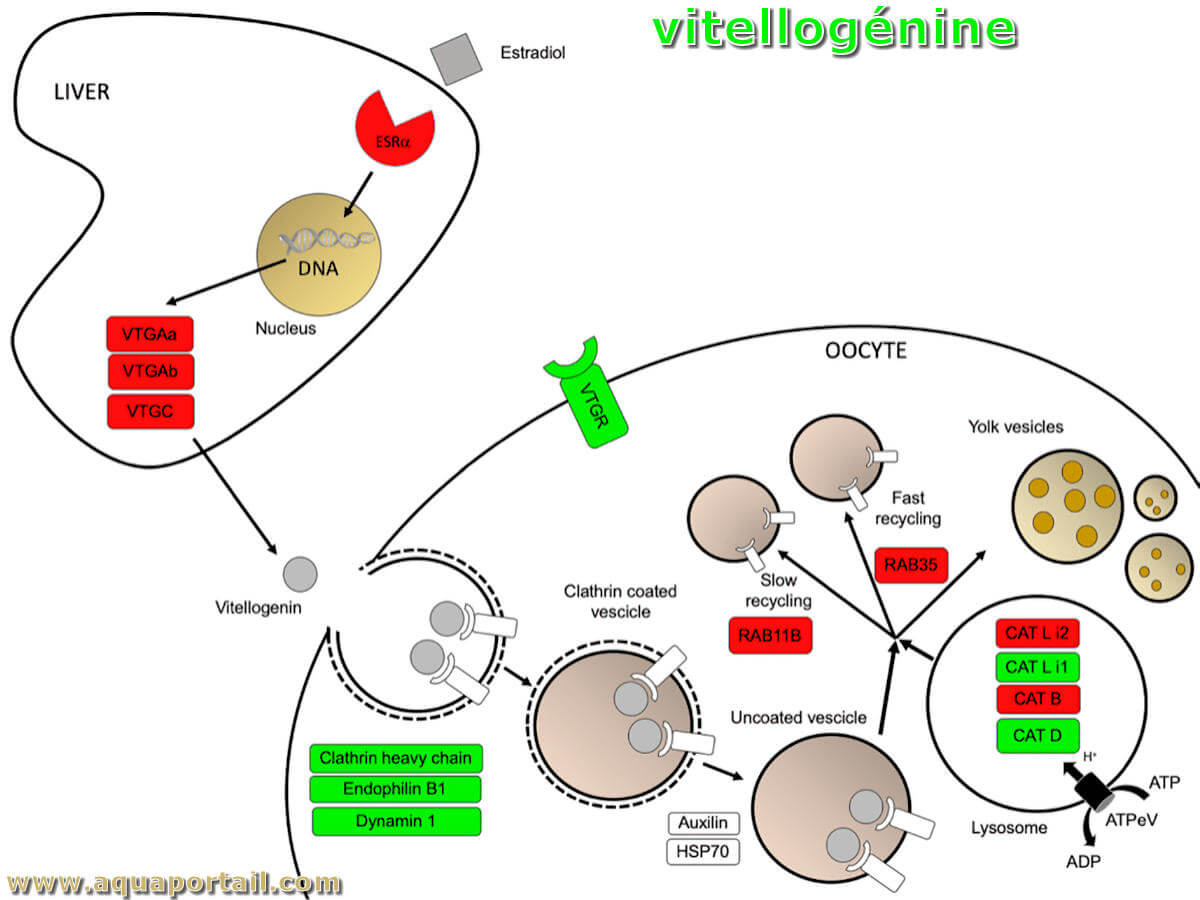
La vitellogénine (VTG) est une protéine présente dans le sang, à partir de laquelle la substance du jaune d'oeuf est dérivée.
