Peptide signal
Définition
Un peptide signal est un court peptide situé dans l'extrémité N-terminale d'une protéine, porteur d'informations pour la sécrétion des protéines. Ils sont omniprésents chez tous les procaryotes et eucaryotes. Ils permettent à une protéine d'être adressée au système membranaire endocellulaire.
Les peptides signal n'ont pas été traditionnellement considérés comme des produits sécrétés ou libérés par les cellules qui peuvent être mesurés dans la circulation, car il a été supposé que le peptide signal était dégradé après clivage du peptide prépro.
L''organisation d'un peptide signal :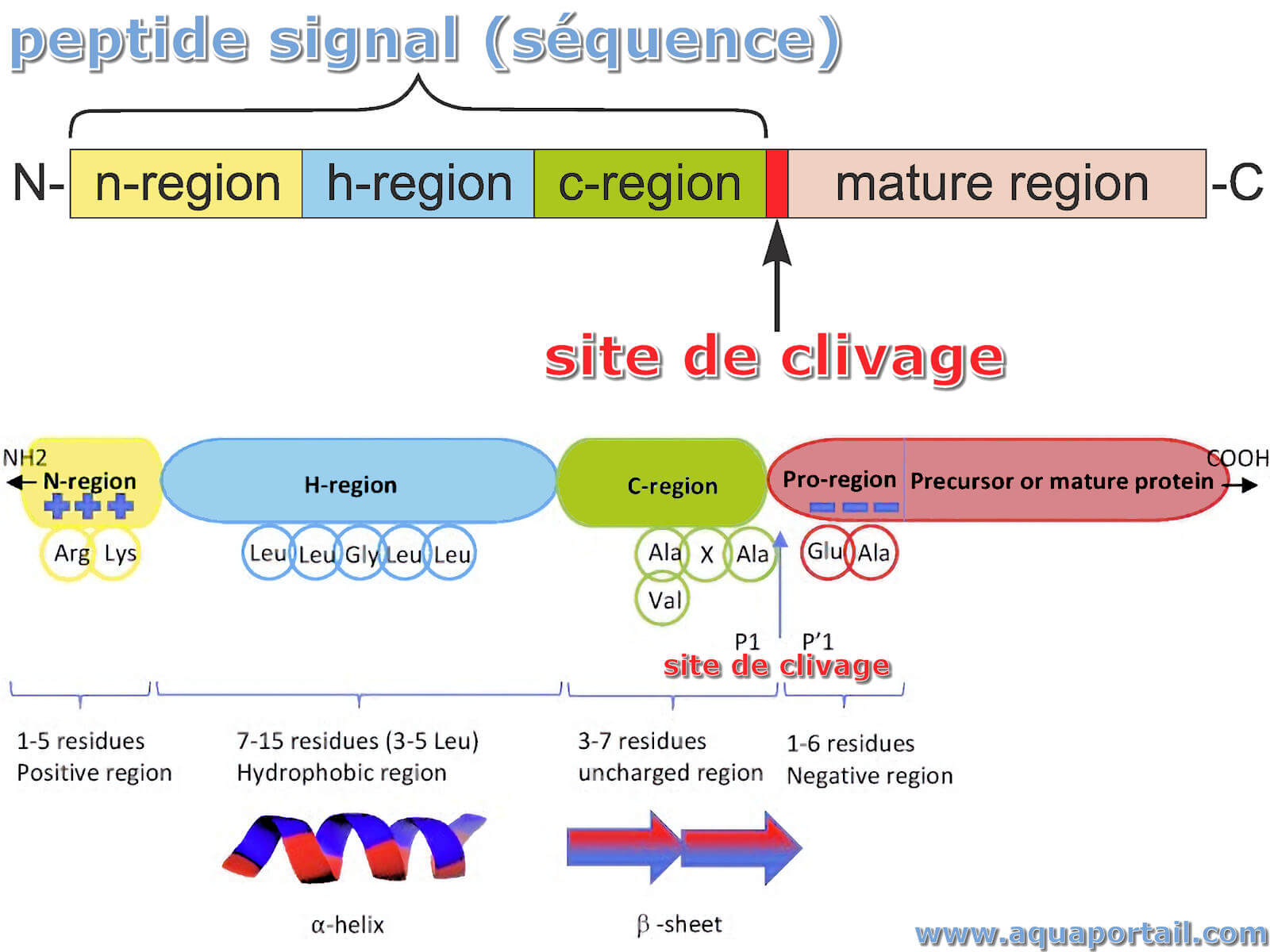
Organisation d'un peptide signal typique. Les longueurs des régions de la séquence signal ne sont pas dessinées à l'échelle.
Séquence signal
La séquence signal est une courte chaîne peptidique, avec 15 à 50 acides aminés, qui existe à l'extrémité N-terminale de nombreuses protéines de sécrétion nouvellement synthétisées. La séquence signal, avec peptide de transit, est une séquence d'acides aminés d'une protéine. Cette séquence d'acides aminés détermine la destination, la voie de transport de la protéine dans la cellule et l'efficacité de sécrétion.
Explications
Les peptides signal sont des préséquences N-terminales responsables du ciblage des protéines vers le système endomembranaire et les compartiments subcellulaires ou extracellulaires ultérieurs, et conditionnent par conséquent leur bon fonctionnement. L'importance des peptides signal stimule le développement de nouvelles méthodes de calcul pour leur détection. Ces méthodes utilisent des systèmes d'apprentissage entraînés sur des ensembles de données comprenant des peptides signal provenant de différents types de protéines et de groupes taxonomiques.
En conséquence, la précision des prédictions est élevée dans le cas de peptides signaux bien représentés dans les bases de données, mais peut être faible dans d'autres cas atypiques. Ces peptides signal atypiques sont présents dans les protéines trouvées dans les parasites apicomplexés, agents responsables du paludisme et de la toxoplasmose. Les protéines apicomplexanes ont une composition unique en acides aminés en raison de leurs génomes biaisés en AT. Par conséquent, nous avons conçu un nouveau modèle probabiliste plus flexible et universel pour la reconnaissance des peptides signaux eucaryotes atypiques. Notre approche appelée "signal Hsmm" inclut des connaissances sur la structure des peptides signal et les propriétés physico-chimiques des acides aminés. Il est capable de reconnaître les peptides signaux des parasites du paludisme et des espèces apparentées avec plus de précision que les programmes populaires. De plus, il est encore suffisamment universel pour fournir une prédiction d'autres peptides signal à égalité avec les meilleurs prédicteurs de préformation.
Les protéines de sécrétion sont libérées par les cellules (des glandes); elles jouent un rôle dans les organites tels que le réticulum endoplasmique et le complexe de Golgi, et sont intégrées dans les membranes cellulaires. Les peptides signaux assurent que ces protéines sont transportées vers leur destination correcte. Les peptides signaux sont généralement clivés à l'arrivée.
Les peptides signaux existent sur les protéines membranaires dites de type I. Aucun peptide signal réel n'est présent dans les protéines membranaires de type II et de type III : là, le domaine transmembranaire avant fonctionne comme une séquence signal. Un domaine transmembranaire est biochimiquement similaire à un peptide signal, sauf qu'il n'est pas clivé. Les domaines transmembranaires sont similaires aux peptides spécialisés qui transportent une protéine vers sa cible (peptides cibles).
Occurrence et importance
Les séquences signal se trouvent généralement dans les protéines dont la destination est en dehors de la cellule, dans les biomembranes ou dans les compartiments. Une séquence signal est généralement requise pour le transport dans le réticulum endoplasmique, les chloroplastes, les mitochondries, les peroxysomes ou le noyau cellulaire et leurs membranes. En combinant différentes séquences de signaux, il est possible d'importer des protéines dans différents organites en même temps, comme la mitochondrie et le chloroplaste.
Bien que les cellules bactériennes ne soient pas compartimentées, les protéines bactériennes peuvent avoir des séquences signal. Ceux-ci peuvent déterminer les protéines à transporter dans la membrane cellulaire ou l'espace extracellulaire.
Compartiments cibles
Le transport dans la lumière ou la membrane du réticulum endoplasmique (RE) peut avoir lieu au cours de la biosynthèse des protéines (transport cotranslationnel des protéines, translocation) ou uniquement en tant que protéine finie qui a été précédemment produite dans le cytoplasme (transport protéique post-traductionnel). Les protéines avec des séquences signal plus hydrophiles sont de préférence transportées après traduction.
Cependant, les protéines avec des séquences signaux plus hydrophobes sont transportées par voie cotranslationnelle. Le processus intervient sur le réticulum endoplasmique rugueux, qui est rempli de ribosomes. Le mécanisme de transport est complexe et comprend non seulement le ribosome et l'ARNm qui lui sont liés, mais également des protéines en interaction telles que la particule de reconnaissance de signal (SRP) et les protéines associées aux ribosomes. Un récepteur SRP et le complexe de protéines tunnel (complexe SEC, Translocon) sont également nécessaires dans la membrane du RE.
Toutes les protéines sécrétoires et la plupart des protéines intégrées dans la membrane ont une séquence signal avec peptide signal de 15 à 50 acides aminés à leur extrémité N-terminale avec certaines propriétés. Les séquences signal peuvent également être trouvées dans une protéine ou à l'extrémité C.
La séquence exacte des acides aminés individuels est moins importante que leurs propriétés physiques : un noyau hydrophobe central (h) est flanqué de N-terminal (n) avec des acides aminés chargés positivement et C-terminal (c) par des acides aminés polaires. La région C-terminale contient souvent des acides aminés cassant l'hélice tels que la proline ou la glycine. La zone N-terminale est la moins conservée. Dans la plupart des cas, la séquence signal est clivée de la protéine réelle par la signal peptidase (SPase) après le passage de la membrane. L'interface est définie par de petits résidus d'acides aminés non chargés aux positions -3 et -1 de la région polaire C-terminale de la séquence signal.
La séquence d'acides aminés KDEL assure un transport de la protéine dans le réticulum endoplasmique et une rétention dans celui-ci, dans le cas des protéines sécrétoires avec une séquence KDEL, la séquence signal dans le RE est clivée par protéolyse, car sinon elles seraient retenues par les protéines KDELR1, 2 et 3, entre autres.
Pour certaines protéines transmembranaires, le premier domaine transmembranaire est également la séquence signal. Le segment, également appelé séquence d'ancrage du signal, se distingue par une région centrale hydrophobe plus longue et une interface peptidique signal manquante par rapport à la séquence signal normale.
La majorité des protéines qui sont transportées vers le RE ont un signal orienté N-terminal ou des séquences d'ancrage de signal. Cependant, il existe également des protéines membranaires intégrales qui sont insérées dans la membrane RE sans séquence signal N-terminale. Ces protéines sont reconnues via un segment hydrophobe situé en C-terminal. Comment ces protéines s'insèrent dans la membrane RE n'a pas encore été clarifiée.
Les adaptines se lient au peptide signal et à partir de là, elles recrutent des clathrines et d'autres protéines accessoires, après leur liaison aux clathrines.
Noyau cellulaire
Une séquence signal, appelée ici signal de localisation nucléaire (séquence prototypique PKKKRKV), est également requise pour l'importation de protéines post-traductionnelles dans le noyau cellulaire. Ceci est reconnu par un récepteur d'importation de noyau, qui est transporté avec lui dans le noyau. Les protéines sont exportées du noyau cellulaire en utilisant un NES (signal d'exportation nucléaire) via exportine et Ran-GTP avec un mécanisme typique de la protéine G. Le NES se compose de la séquence LxxxLxxLxL avec L représentant les acides aminés aliphatiques tels que la leucine et x pour tout acide aminé.
Mitochondrie
La protéine est importée dans la mitochondrie après la traduction, c'est-à-dire une fois la biosynthèse des protéines terminée. Tous les processus d'importation ont lieu via la même machine de transport, le complexe TOM (translocase de la membrane externe) de la membrane mitochondriale externe. Il existe également un certain nombre d'autres complexes protéiques qui assurent l'intégration des protéines dans la membrane mitochondriale externe (complexe SAM, machines de tri et d'assemblage), l'importation dans la membrane mitochondriale interne et la matrice mitochondriale (complexes TIM, translocase de la membrane interne).
Les précurseurs de protéines peuvent être divisés en deux groupes : le premier groupe est constitué de protéines avec des signaux N-terminaux qui sont destinés à la matrice mitochondriale, de certaines protéines de la membrane interne et de l'espace intermembranaire entre la membrane externe et la membrane interne. Les résidus d'acides aminés portent des charges positives et interagissent avec les récepteurs d'importation de l'organite et le dirigent également vers leur destination via la membrane interne. Ils sont généralement constitués de 20 à 40 acides aminés, qui forment une hélice α amphiphile reconnue par l'importateur. La séquence signal est coupée par une peptidase après l'importation.
Le deuxième groupe comprend toutes les protéines de la membrane externe, de nombreuses protéines de la membrane interne et l'espace intermembranaire. Ils ne transportent que des signaux internes qui ne peuvent pas être coupés.
Chloroplaste
La protéine est importée dans les chloroplastes après la traduction via les complexes protéiques TOC (Translocase de la membrane chloroplastique externe) et TIC (Translocase de la membrane chloroplastique interne).
Les peptides signaux des plastes sont situés à l'extrémité N-terminale du précurseur protéique et ont certaines propriétés physiques : ils sont riches en acides aminés avec des résidus hydroxylés, n'ont pas de résidus acides et ne forment pas de structure secondaire. La pré-séquence est phosphorylée et interagit avec les protéines Hsp70 et 14–3–3, qui accompagnent la protéine jusqu'au transporteur. Après l'importation, la séquence signal est coupée par une peptidase. Les protéines de la membrane externe ne nécessitent pas de peptide signal N-terminal, le mécanisme d'intégration est encore inconnu.
Les protéines dont la destination est la membrane ou la lumière des thylakoïdes peuvent également contenir des séquences signal supplémentaires.
Peroxysome
L'importation post-traductionnelle de protéines dans le peroxysome est basée sur deux types différents de séquences de signaux, qui sont appelés PTS1 et PTS2 (de l'anglais : Peroxisome Targeting Signal, par exemple "signaux pointant vers des peroxysomes").
Les séquences PTS1 sont de courts signaux C-terminaux qui contiennent la séquence d'acides aminés de (S/A/C) - (K/R/H) - (L/L/M). Ils sont reconnus par le récepteur Peroxin-5 (Pex5p).
Les séquences PTS2 sont des signaux de 9 acides aminés qui sont approximativement 20 résidus de l'extrémité N-terminale. Le récepteur des signaux PTS2 est la peroxine-7 (Pex7p).
Synonymes, antonymes
Voir tous les synonymes pour "peptide signal".1 synonyme (sens proche) de "peptide signal" :
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PEPTIDE SIGNAL sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression PEPTIDE SIGNAL est dans la page 2 des mots en P du lexique du dictionnaire.
Mots en P à proximité
pepsinogène pepstatine peptidase peptide peptide de transit peptide signalpeptidoglycane péramorphose perceur perche perche commune
En rapport avec "peptide signal"
Un peptide de transit est un peptide permettant à une protéine d'être adressée au plaste.
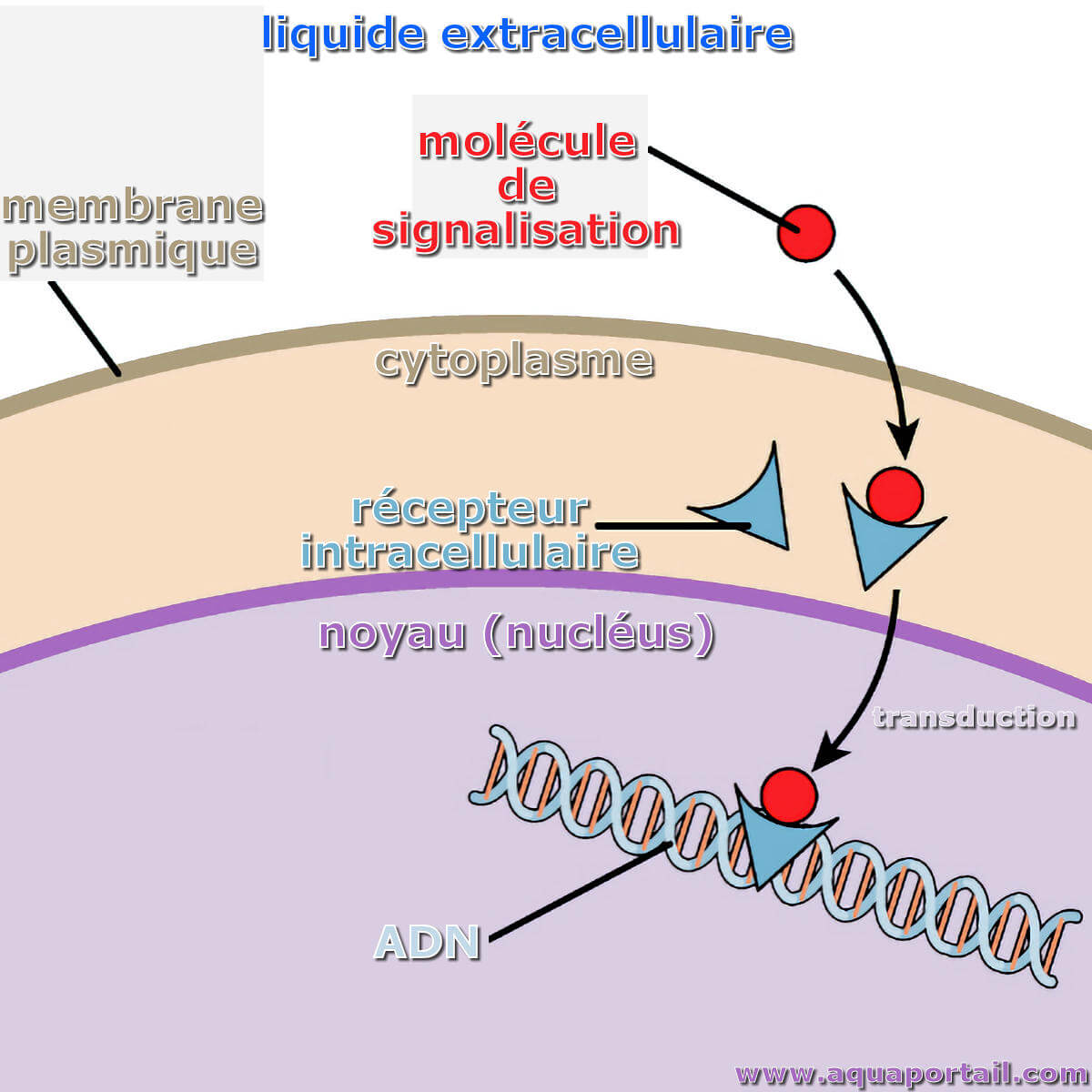
Une molécule de signal (signalisation cellulaire) est une molécule extracellulaire, de nature biochimique variée, qui donne une information à une cellule...
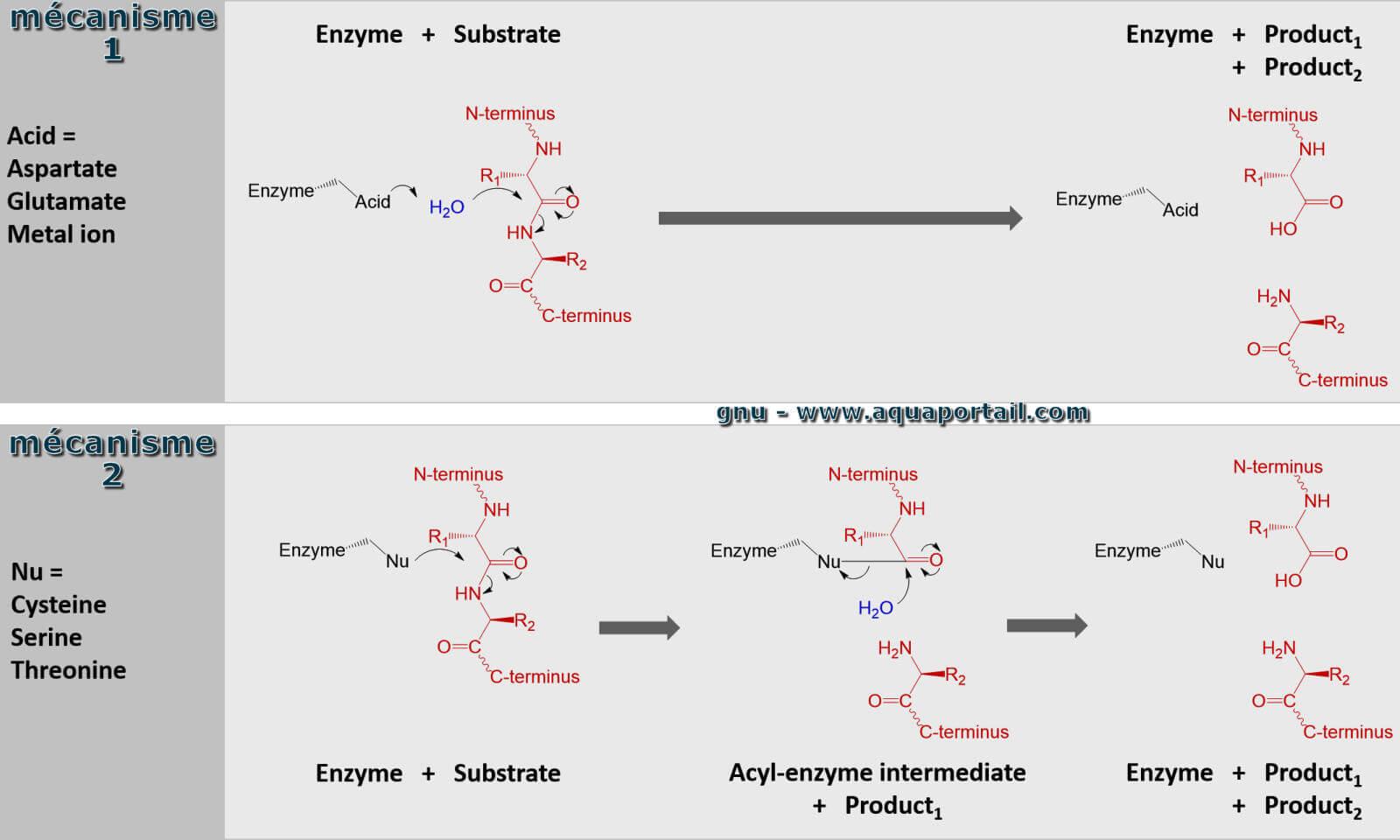
Une peptidase est une hydrolase liant les peptides, une enzyme capable de cliver des protéines ou des peptides.

La transduction du signal est le processus par lequel un signal extracellulaire, par exemple provenant de la liaison de ligands extracellulaires...
