Protéine transmembranaire
Définition
Une protéine transmembranaire est une protéine membranaire intégrale qui passe à travers la bicouche lipidique de la membrane cellulaire, une fois (passage unique) ou plusieurs fois (passage multiple). Elle traversent les deux feuilles de la bicouche phospholipidique d'une biomembrane.
Les protéines transmembranaires comprennent des protéines fonctionnellement très différentes telles que les récepteurs transmembranaires, les porines, les canaux ioniques, les transporteurs, les pompes dépendantes de l'ATP et les molécules d'adhésion cellulaire. Ils peuvent être dans la membrane plasmique ou dans la membrane d'un organite être ancrés et peuvent être structurellement classés en fonction de leurs composants protéiques qui traversent la membrane, le domaine transmembranaire.
2 types de protéine transmembranaire :
Représentation schématique de différentes protéines transmebranaires avec différents domaines transmembranaires (membrane jaune) : (A) domaines α-hélicoïdaux (rouge) en un seul passage (à gauche) et dans les domaines multi-passes (B) en tonneau β (bleu).
Explications, organisation et fonctionnement
Afin de pénétrer la bicouche lipidique, une chaîne polypeptidique doit avoir des chaînes latérales hydrophobes et protéger son groupe de squelette polaire. Ceci est réalisé, entre autres, par la formation d'une structure secondaire qui contribue à la formation de liaisons hydrogène. Tous les segments transmembranaires connus sont donc constitués d'hélices α (très courantes) ou de barils β (rares).
La structure complète n'est connue que pour quelques protéines membranaires.
Une distinction est faite entre les protéines à passage mono-transmembranaire qui traversent la membrane une seule fois et les protéines multi-transmembranaires qui traversent la membrane à plusieurs reprises. Les protéines transmembranaires à passage unique sont en outre différenciées en différents types selon le type d'ancrage et la position de leurs extrémités. L'extrémité N se trouve extracellulairement avec des protéines transmembranaires de type 1 qui sont ancrées dans la membrane cellulaire. En revanche, dans le cas des protéines transmembranaires de type 2, l'extrémité C se situe extracellulairement.
On distingue trois domaines. Tout d'abord, une zone qui traverse la membrane, avec des caractéristiques hydrophobes (qui repousse l'eau) pour interagir avec les lipides de la bicouche lipidique (membrane cellulaire). De plus, un domaine cytosolique et un domaine extracytosolique en contact avec l'intérieur et l'extérieur de la cellule, respectivement, de caractère hydrophile ("sont liés à l'eau"). Le résultat est une protéine amphipathique.
En tant que protéine intégrale, elle ne peut être isolée de la bicouche qu'en appliquant des détergents, tels que le SDS. Les fonctions principales sont de servir de canaux de transport pour les ions ou les molécules, tels que les aquaporines qui transportent l'eau à travers la membrane; réception de signaux cellulaires, ancrage au cytosquelette ou à la matrice extracellulaire, etc.
Dans la région transmembranaire (domaine transmembranaire d'environ huit à douze acides aminés), les protéines transmembranaires sont souvent constituées à partir des acides aminés moins polaires ou plus hydrophobes, qui entrent en interaction protéine-lipide avec les lipides de la membrane (hydrophobicité).
Transmembrane en une seule étape (un seul passage)
La protéine transmembranaire ne traverse la bicouche lipidique qu'une seule fois. L'extrémité N-terminale de la protéine se trouve d'un côté de la membrane et l'extrémité C-terminale de l'autre. De ce type sont les récepteurs-PTK (avec une activité de protéine tyrosine kinase), des enzymes de l'appareil de Golgi, etc. Un exemple bien étudié est la glyphorine de la membrane des globules rouges. Les domaines de ces protéines sont classés comme :
- Domaine transmembranaire : elle a une structure secondaire en hélice α, avec une longueur d'environ 25 à 30 acides aminés. Les résidus latéraux doivent être principalement hydrophobes, tels que l'alanine, la leucine, l'isoleucine, etc. pouvoir interagir avec l'intérieur de la bicouche par les forces hydrophobes et les forces de van der Waals. Il est important de noter que l'intérieur de l'hélice est occupé et ne sert pas de canal. Aux extrémités de l'hélice, il peut y avoir des résidus chargés, qui interagissent avec la tête polaire des phospholipides bicouches.
- Domaines non transmembranaires : elles sont généralement hydrophiles et globulaires, de longueur variable, qui sont maintenus par des liaisons hydrogène et des forces électrostatiques. Des liaisons disulfure -SS- et des chaînes oligosaccharides peuvent exister dans le domaine extracytosolique, ce qui n'est pas le cas dans le domaine cytosolique.
Cette classification se réfère à la position des protéines N- et C-terminales des différents côtés de la bicouche lipidique. Les types I, II, III et IV sont des molécules à passage unique. Les protéines transmembranaires de type I sont ancrées à la membrane lipidique avec une séquence d'ancrage d'arrêt de transfert et ont leurs domaines N-terminaux ciblés vers la lumière du réticulum endoplasmique (RE) pendant la synthèse (et l'espace extracellulaire, si les formes matures se trouvent sur les membranes cellulaires).
Les types II et III sont ancrés avec une séquence d'ancrage de signal, le type II étant ciblé sur la lumière RE avec son domaine C-terminal, tandis que le type III a leurs domaines N-terminaux ciblés sur la lumière RE. Le type IV est subdivisé en IV-A, avec leurs domaines N-terminaux ciblés sur le cytosol et IV-B, avec un domaine N-terminal ciblé sur la lumière. Les implications pour la division dans les quatre types sont particulièrement manifestes au moment de la translocation et de la traduction liée au RE, lorsque la protéine doit passer à travers la membrane RE dans une direction dépendant du type.
Transmembrane à plusieurs étapes (passages multiples)
Les protéines transmembranaires traversent la bicouche lipidique à deux reprises ou plus, généralement à travers plusieurs hélices α, bien qu'il y ait des cas d'insertions à travers la lame β. Il existe de nombreux exemples : récepteurs associés aux protéines G trimériques, canaux ioniques, porines (y compris nucléoporines) dans les bactéries, et encore dans l'érythrocyte la protéine Band 3, une protéine transmembranaire multi-passe qui traverse la membrane avec 12 hélices α, et avec ses extrémités vers le cytosol.
Il existe deux types de protéines transmembranaires : en hélice alpha et bêta-barils. Les protéines alpha-hélicoïdales sont présentes dans les membranes internes des cellules bactériennes ou la membrane plasmique des eucaryotes, et parfois dans les membranes externes. Il s'agit de la principale catégorie de protéines transmembranaires. Chez l'homme, 27 % de toutes les protéines ont été estimées être des protéines membranaires alpha-hélicoïdales. Les protéines bêta-barriques se trouvent jusqu'à présent uniquement dans les membranes externes des bactéries Gram-négatives, les parois cellulaires des bactéries gram-positives, les membranes externes des mitochondries et chloroplastes, ou peuvent être sécrétées sous forme de toxines porogènes. Toutes les protéines transmembranaires à barillet bêta ont une topologie de haut en bas la plus simple, qui peut refléter leur origine évolutive commune et un mécanisme de pliage similaire.
En plus des domaines protéiques, il existe des éléments transmembranaires inhabituels formés par des peptides. Un exemple typique est la gramicidine A, un peptide qui forme une hélice β transmembranaire dimère. Ce peptide est sécrété par les bactéries Gram-positives comme antibiotique. Aucune hélice transmembranaire en polyproline-II n'a été signalée dans les protéines naturelles. Néanmoins, cette structure a été observée expérimentalement dans des peptides artificiels spécifiquement conçus.
Selon l'hélice, on distingue :
- Plusieurs étapes dans l'hélice α: ces protéines ont autant d'hélices α qu'elles traversent parfois la membrane. Ces hélices sont liées par des boucles dans leurs domaines cytosolique et extracytosolique. Les hélices α ne peuvent servir que de simple moyen d'ancrage à la bicouche, ou peuvent former un canal à travers lequel diverses substances peuvent passer. Dans ce dernier cas, les hélices ont des résidus hydrophobes qui donnent à l'extérieur du canal, pour interagir avec la bicouche; tandis que les résidus qui donnent au canal interne sont hydrophiles.
De cette façon, de nombreuses substances polaires qui, en l'absence de protéines, ne pouvaient pas traverser la membrane, le peuvent désormais. Pour former un canal ionique, un minimum de 5 hélices α est requis. Les hélices α peuvent se déplacer, glisser les unes sur les autres, pour produire un changement de conformation. Cela sert à réguler l'ouverture des canaux, à transporter les composés par les perméases et à la transduction du signal.
- feuille β en plusieurs étapes : les cas de protéines transmembranaires à étapes multiples dans la β-lamine sont beaucoup moins fréquents. Des exemples sont donnés dans les chloroplastes, les mitochondries et les bactéries. La feuille β nécessite seulement environ 10 acides aminés pour passer à travers la bicouche. Il existe des protéines dont le nombre de β-lamines est compris entre 8 et 22.
Elles forment normalement des canaux à travers lesquels passent différents solutés. C'est le cas des pores de porine, une protéine présente dans la membrane de certaines bactéries, ainsi que dans les mitochondries et les chloroplastes, à travers lesquels des substances de poids moléculaire inférieur à 800 Da passent par simple diffusion. La porine traverse la membrane avec 16 antiparallèles à β-lamelles, qui simulent les portées d'un baril. Ces feuilles alternent les acides aminés polaires et apolaires, les polaires sont orientés vers la lumière du canal, et les apolaires entrent en contact avec la partie hydrophobe de la bicouche lipidique.
C'est une différence par rapport à l'hélice α. Les boucles entre la β-lamelle se projettent dans la lumière du canal, leur donnant une spécificité. En plus de la porine, d'autres exemples sont les pores en forme de tonneau de maltoporine, pour le maltose, et les pores de protéine FepA, pour les ions fer, tous deux dans les bactéries. Cependant, toutes les protéines à plusieurs étapes de la β-lamine n'agissent pas comme des canaux. Il existe des enzymes dans la β-lamine, comme la lipase OMPLA, et certains récepteurs membranaires. Dans ces cas, les résidus polaires de la lame β obstruent le canal, rendant cette fonction impossible. La seule fonction du canon est l'ancrage à la membrane.
Contrairement à l'hélice α, la lame β se lie les uns aux autres de manière plus rigide, empêchant les changements de conformation, limitant ainsi leur polyvalence.
Synonymes, antonymes
Voir tous les synonymes pour "protéine transmembranaire".0 synonyme (sens proche) pour "protéine transmembranaire".
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à PROTÉINE TRANSMEMBRANAIRE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
L'expression PROTEINE TRANSMEMBRANAIRE est dans la page 9 des mots en P du lexique du dictionnaire.
Mots en P à proximité
protéine G protéine globulaire protéine kinase protéine membranaire protéine recombinante protéine transmembranaireprotéine végétale protéine Wnt protéines brutes protéines cytoplasmiques protéines d'organismes unicellulaires
En rapport avec "protéine transmembranaire"

La force de van der Waals est une force à courte portée existant à la fois dans les phases gazeuse et liquide en raison de la fluctuation des nuages...

Un transporteur membranaire désigne une protéine membranaire qui assure le passage d'ions ou de molécules d'une face à l'autre de la membrane.

Une protéine globulaire, ou une sphéroprotéine, est une forme sphérique de protéine avec une structure plus complexe, qui diffère fondamentalement d'une...
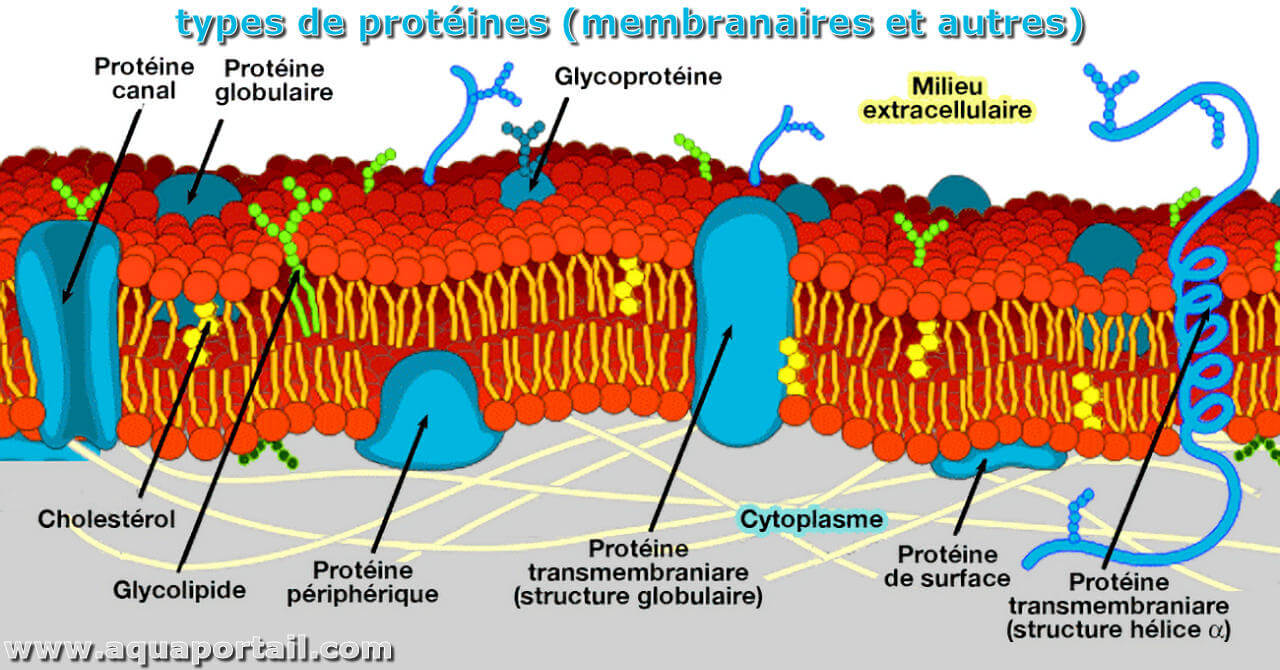
Une protéine membranaire est une protéine qui n'est pas libre dans la cellule, mais qui existe uniquement liée à une membrane cellulaire.
