Aquaporine
Définition
Une aquaporine est une protéine du type transporteur membranaire qui forme des canaux dans la membrane cellulaire pour faciliter le passage de l'eau. Les aquaporines existent chez tous les êtres vivants dotés d'une membrane cellulaire. Elles ont été trouvées dans les archées, les bactéries et les eucaryotes.
L'aquaporine 1 (AQP1) :
Structure des monomères d'aquaporine 1 (AQP1) et leur assemblage tétramère dans les membranes. (À gauche) Structure cristalline du monomère AQP1 montrant des domaines α-hélicoïdaux transmembranaires inclinés (numérotés de 1 à 6) entourant un pore d'eau. Les motifs "NPA" conservés sont indiqués. (À droite) Assemblage tétramérique d'AQP1 dans une membrane dans laquelle les monomères individuels contiennent des pores d'eau.
Explications
Une aquaporine (AQP) est une porine également appelée un pore d'eau avec un rôle de protéine de transport. Les aquaporines, comme protéines transmembranaires, interviennent également dans le transport transmembranaire d'autres molécules, tout en interdisant le passage de certains ions.
Depuis les biomembranes dans son intérieur hydrofuge (hydrophobe), leur conductivité pour les molécules d'eau est très faible. En revanche, la conductivité de l'eau d'un canal d'aquaporine peut atteindre 3 milliards de molécules par seconde. La famille des protéines des aquaporines est divisée en aquaporines dites ordinaires et aquaglycéroporines. Les aquaporines ordinaires sont des canaux d'eau pure.
Les aquaglycéroporines conduisent également de petites molécules organiques telles que la glycérine ou l'urée. Dans des conditions physiologiques, les aquaporines apparaissent sous forme de tétramères : quatre canaux d'aquaporine sont intégrés en tant qu'unité dans une membrane biologique.
Il existe aussi des maltoporines et des nucléoporines.
Structure
Toutes les aquaporines connues ont une structure et une séquence d'acides aminés similaires. La structure principale de l'AQP1 se compose de 268 acides aminés. Ceux-ci forment six hélices α qui couvrent la membrane (protéine membranaire intégrale). Les hélices sont reliées entre elles par des boucles A à E. Les boucles B et E jouent un rôle particulier, chacune formant une courte hélice, qui plongent dans la membrane des deux côtés vers le milieu. Sur chacune des deux boucles, à l'extrémité des deux courtes hélices, il y a un motif structurel caractéristique composé de trois acides aminés (N-P-A, asparagine-proline-alanine), ce qui contribue de manière significative à la sélectivité du canal d'eau. Chacune des deux boucles forme un demi-pores, qui forment ensemble un canal d'eau (heure modèle de verre, sablier modèle).
Le canal est le plus étroit au milieu (0,3 nm), le diamètre est de 2 nm aux deux ouvertures, les extrémités carboxyl et amino terminales de la protéine transmembranaire sont à l'intérieur de la cellule. Dans les membranes biologiques, les aquaporines forment des homotétramères, ce qui signifie que quatre protéines de pore à fonction unique s'accumulent.
Fonction
L'eau ne peut diffuser à travers la double couche lipidique de la membrane cellulaire que dans une mesure limitée. Cellules à très haute perméabilité à l'eau, telles que les cellules tubulaires rénales, sécrétant des cellules des glandes salivaires ou des érythrocytes qui ont besoin de l'aide de canaux d'eau pour un échange rapide de l'eau. La différence entre la diffusion et la perméabilité médiée par canal est significative. La diffusion est un processus qui fonctionne avec une faible capacité dans les deux sens à travers la membrane de toutes les cellules. En présence de canaux d'eau spécifiques, l'eau peut migrer presque sans entrave dans la direction du gradient osmotique. Les aquaporines ne sont ni des pompes ni des échangeurs et aucune énergie métabolique n'est utilisée pour le transport.
Le canal fonctionne de manière bidirectionnelle. L'eau peut traverser le canal dans les deux sens. Alors que la diffusion à travers les membranes ne peut pas être bloquée, les aquaporines peuvent être bloquées par des molécules qui obstruent leurs pores, interrompant ainsi l'écoulement de l'eau.Certaines aquaporines peuvent être obstruées par des composés de mercure qui se lient de manière covalente à une chaîne latérale de cystéine dans le pore.
Blocus de protons
Les aquaporines sont très sélectives. En particulier, ils empêchent les protons de traverser la membrane de sorte que le gradient de protons, vital pour chaque cellule, ne soit pas détruit. (Le gradient de protons est utilisé pour activer les processus de transport - voir par exemple ATPases). Ce n'est pas une évidence, car l'eau n'est pas présente sous la forme d'une seule molécule dans la phase liquide, mais plutôt comme un réseau relié par des liaisons hydrogène. Les protons peuvent sauter de molécule en molécule le long de ces liaisons hydrogène (mécanisme de Grotthuss).
La recherche actuelle se concentre sur la manière d'empêcher les protons de sauter à travers le canal. Il semble important que les aquaporines, en raison de leur structure, forment une barrière électrostatique au milieu du canal. La conséquence en est que les molécules d'eau polaires avec leur oxygène partiellement chargé négativement sont généralement orientées dans la direction du centre du canal, tandis que les hydrogènes partiellement chargés positivement sont principalement orientés vers les sorties du canal. Les premiers travaux (2002) supposaient donc que l'orientation des molécules d'eau perturbait le mécanisme de Grotthuss.
Des travaux récents remettent en question cette interprétation et se concentrent sur la barrière énergétique que le proton le long du canal doit surmonter. Le débat actuel (à partir de juillet 2007) concerne l'origine de la barrière énergétique. Alors que certains scientifiques se concentrent sur la barrière électrostatique créée par la protéine, d'autres soulignent que la protéine ne peut pas remplacer la coquille de solvatation d'un ion proton / oxonium dans l'eau.
Inhibition
L'aquaporine-1 est inhibée par les ions mercure, or ou argent. Ici, l'ion se lie à une cystéine dans l'entrée des pores, bloquant ainsi l'écoulement de l'eau. Ces ions ne se lient pas spécifiquement à l'aquaporine-1 et sont donc toxiques. La découverte d'un inhibiteur non toxique a été publiée en 2009 et est un dérivé du diurétique de l'anse bumétanide et a été mentionnée dans la publication comme AqB013. Cette substance a montré un effet antagoniste contre les aquaporines-1 et -4. La recherche d'autres inhibiteurs spécifiques de l'aquaporine fait actuellement l'objet de recherches.
Diffusion cellulaire facilitée de l'eau dans les plantes
La fonction des aquaporines dans les cellules végétales pourrait être caractérisée comme des composants de la diffusion cellulaire facilitée de l'eau et leur apparition pourrait être démontrée dans les tissus végétaux. Une classe spécifique de protéines d'aquaporine conduit à une diffusion plus facile du CO2 dans les tissus et cellules végétales ou les chloroplastes.
Sens
Les aquaporines ont une importance physiologique, en particulier dans les tissus dans lesquels un flux physiologique élevé intervient, par exemple lors de la construction de la pression de turgescence dans les cellules végétales.
Ainsi :
- Chez les mammifères, les aquaporines régulent l'équilibre hydrique des globules rouges (érythrocytes) et des cellules du rein, du cristallin, du cerveau et de l'escargot de l'oreille interne.
- Dans les voies biliaires hépatiques et la vésicule biliaire, les aquaporines sont responsables de la concentration et de la sécrétion de la bile.
- Dans le système nerveux central, les cellules qui libèrent le liquide céphalo-rachidien contiennent des canaux d'eau. Ils jouent un rôle important dans la barrière hémato-encéphalique et y existent sous la forme d'associations orthogonales, appelées OAP (tableaux orthogonaux de particules).
- Elles régulent l'entrée et la sortie du liquide extracellulaire dans les cellules des capillaires sanguins.
- Dans les alvéoles, elles fournissent le film liquide d'échange de gaz nécessaire.
- Elles facilitent la diffusion dans les plantes et les chloroplastes.
Les dysfonctionnements des aquaporines sont responsables de maladies telles que le diabète insipide rénal, la cataracte, le glaucome (glaucome) et la perte auditive. Les anticorps contre l'aquaporine 4 provoquent des troubles du spectre de la neuromyélite optique dans le système nerveux central. Les aquaporines jouent également un rôle dans l'oedème cérébral consécutif à un traumatisme crânien.
Nomenclature
Les aquaporines d'origine animale sont simplement numérotées (AQP1, AQP4). Habituellement, le nom générique latin correspondant est préfixé, par exemple bovAQP1 (bovins).
Les aquaporines d'origine végétale sont nommées différemment. AtTIP2; 1 signifie qu'il s'agit d'une protéine intrinsèque tonoplaste de la plante (modèle) de cresson arable Arabidopsis thaliana.
Variantes
Les CHIP (protéines intégrales formant des canaux) sont situées dans la membrane cellulaire des globules rouges et des cellules rénales. Chez les mammifères, la densité des aquaporines est particulièrement élevée dans les érythrocytes (environ 200 000 canaux par cellule) et dans les cellules tubulaires proximales du rein, qui absorbent l'eau lors de la formation d'urine.
L'AQP2, qui existe dans les cellules des tubes de collecte des reins (d'où l'ancien nom WCHD des canaux d'eau anglais du conduit de collecte) est stocké dans des vésicules. En cas de manque d'eau, l'hypophyse libère l'hormone vasopressine. La vasopressine se lie à certains récepteurs membranaires des cellules contenant AQP2 et initie une cascade de signaux. Cela provoque la fusion des vésicules avec la membrane cellulaire, augmentant ainsi l'absorption d'eau de l'urine primaire d'un facteur vingt.
Les TIP (protéines intrinsèques de tonoplaste) sont intégrés dans la membrane de la vacuole chez les plantes et assurent que la cellule augmente de volume en raison de l'absorption d'eau pendant la croissance cellulaire.
Les PIP (protéines intrinsèques de la membrane plasmique) se trouvent également uniquement dans les plantes et régulent l'approvisionnement en eau à travers les cellules. De cette manière, en plus des vaisseaux de guidage de l'eau du xylème, il existe un second système de transport d'eau à travers les autres tissus végétaux.
Synonymes, antonymes
Voir tous les synonymes pour "aquaporine".1 synonyme (sens proche) de "aquaporine" :
- pore d'eau
0 antonyme (sens contraire).
Les mots ou les expressions apparentés à AQUAPORINE sont des termes qui sont directement liés les uns aux autres par leur signification, générale ou spécifique.
Le mot AQUAPORINE est dans la page 7 des mots en A du lexique du dictionnaire.
Mots en A à proximité
aquaphobeaquaphobie aquaphobique aquaponie aquaponique aquaporineaquariologie aquariologique aquariologiste aquariologue aquariophile
En rapport avec "aquaporine"
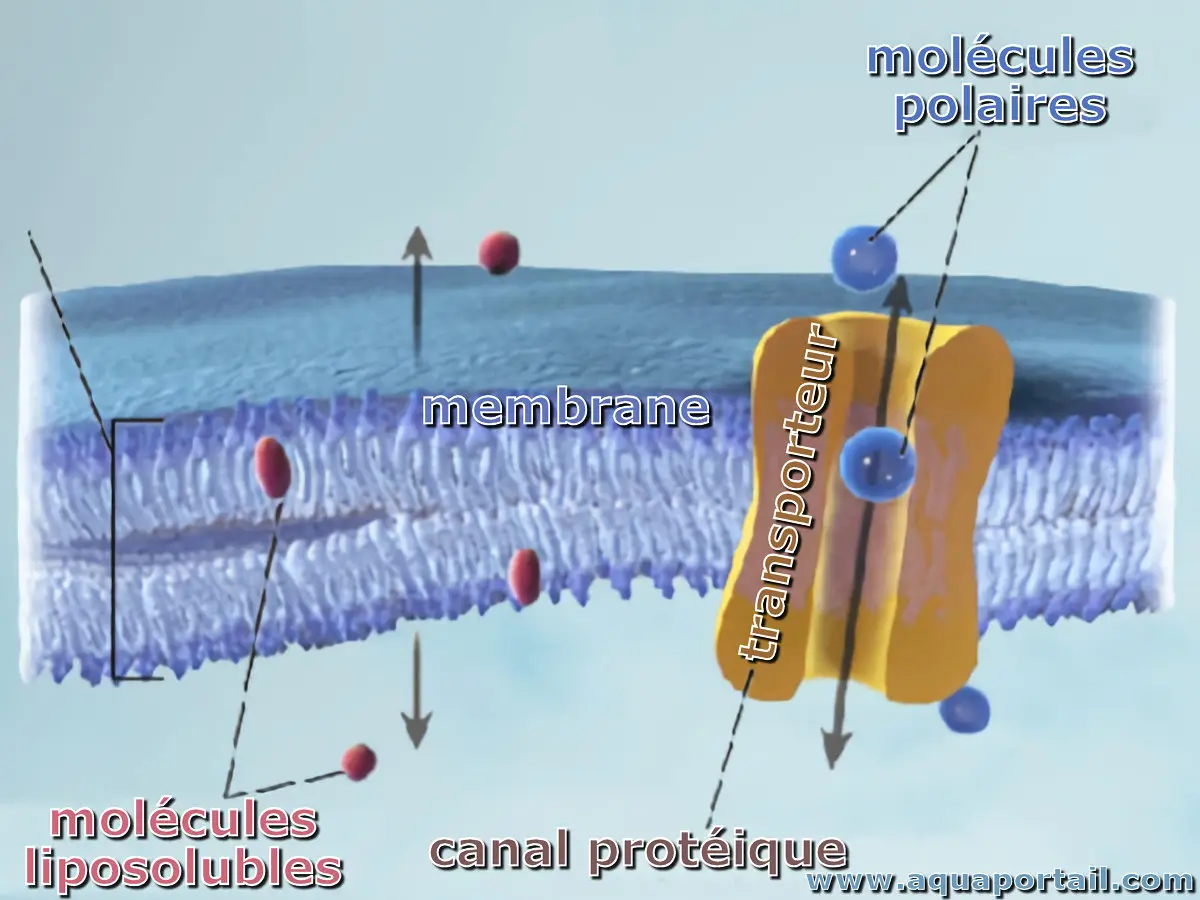
En biologie, un transporteur chimique ou biochimique est une protéine de la membrane plasmique qui se combine à une substance à transporter, tel qu'un...
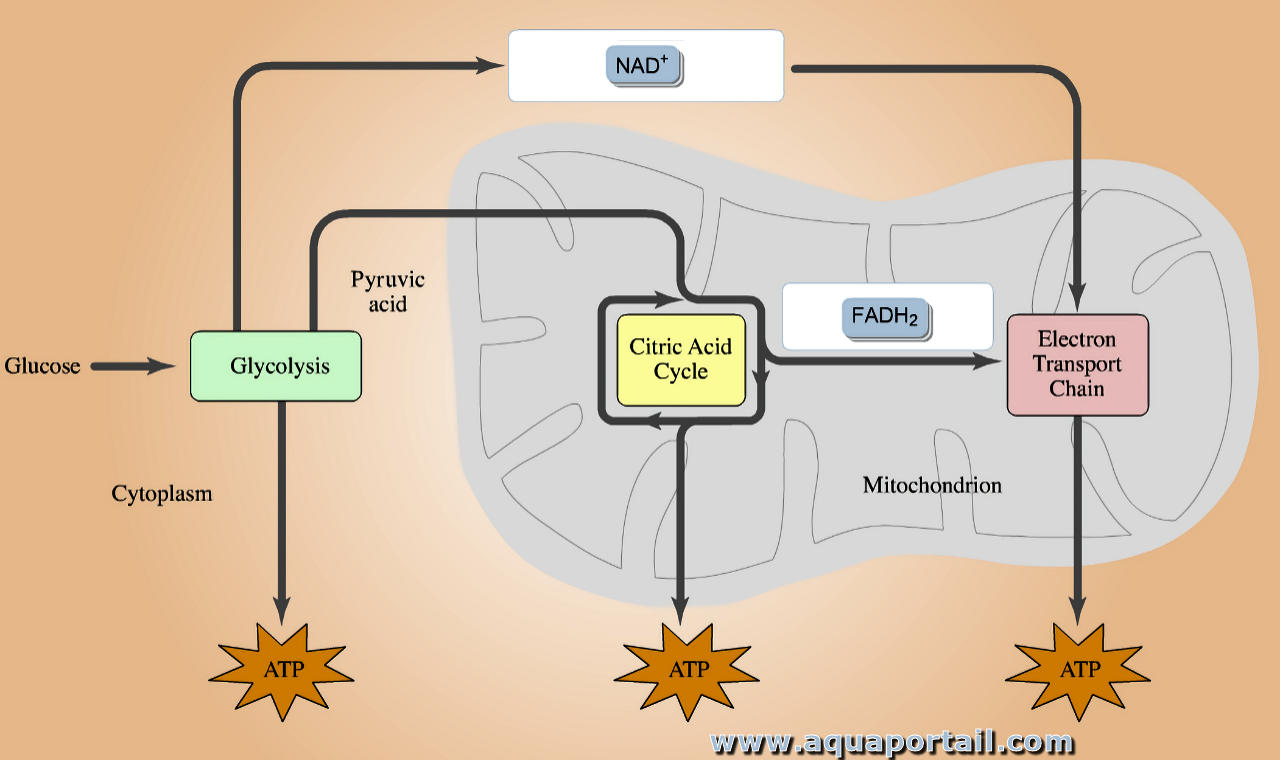
Un transporteur d'électrons qualifie chacune des molécules de la chaîne respiratoire mitochondriale ou de la chaîne photosynthétique chloroplastique...
Un transporteur ionique est un transporteur d'ions constitué de dispositifs moléculaires, les protéines, situés au niveau des membranes cellulaires, notamment...

Un transporteur membranaire désigne une protéine membranaire qui assure le passage d'ions ou de molécules d'une face à l'autre de la membrane.
